Содержание
- 2. Термодинамика – теория тепловых явлений, в которой не учитывается молекулярное строение тел. Выводы термодинамики опираются на
- 3. Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное
- 4. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается
- 5. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества = кинетическая энергия всех атомов и молекул +
- 6. См. диск «Внутренняя Энергия» ВЫВОД: внутренняя энергия U тела определяется макроскопическими параметрами, характеризующими состояние тела.
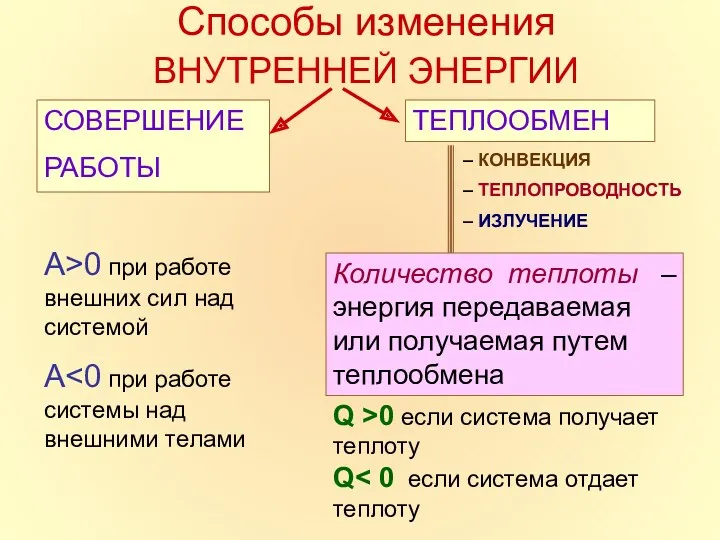
- 7. Способы изменения ВНУТРЕННЕЙ ЭНЕРГИИ СОВЕРШЕНИЕ РАБОТЫ ТЕПЛООБМЕН – КОНВЕКЦИЯ – ТЕПЛОПРОВОДНОСТЬ – ИЗЛУЧЕНИЕ Количество теплоты –
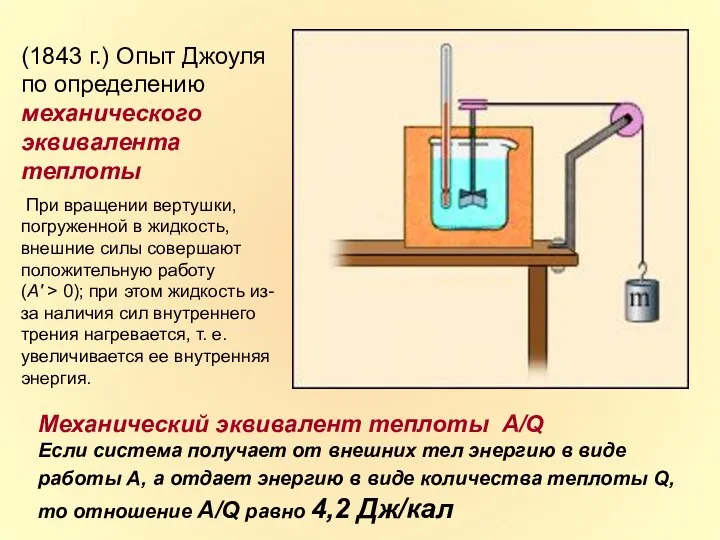
- 8. (1843 г.) Опыт Джоуля по определению механического эквивалента теплоты При вращении вертушки, погруженной в жидкость, внешние
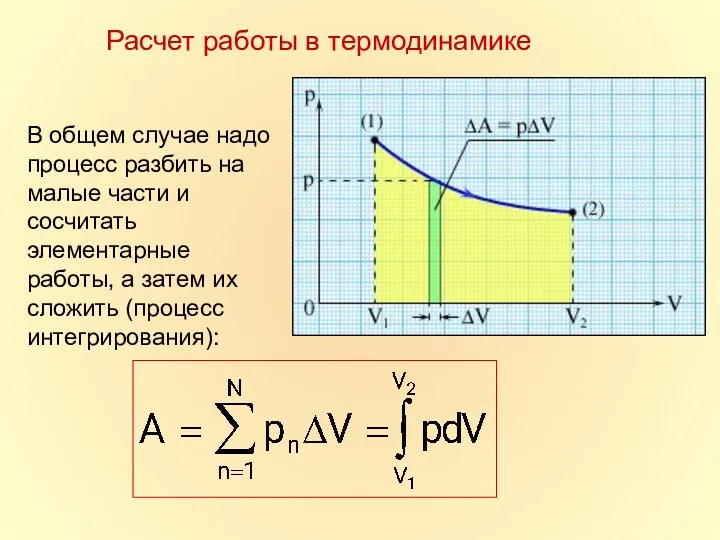
- 9. Расчет работы в термодинамике
- 10. В общем случае надо процесс разбить на малые части и сосчитать элементарные работы, а затем их
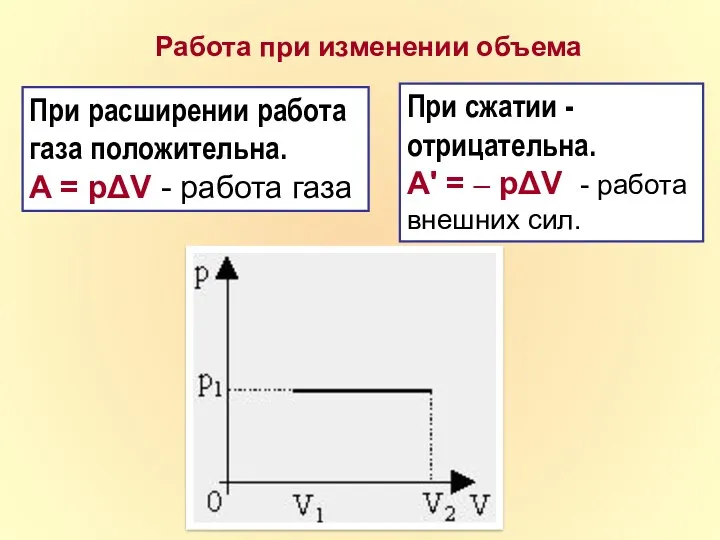
- 11. Работа при изменении объема При расширении работа газа положительна. A = pΔV - работа газа При
- 12. Используя уравнение Менделеева-Клапейрона, получим:
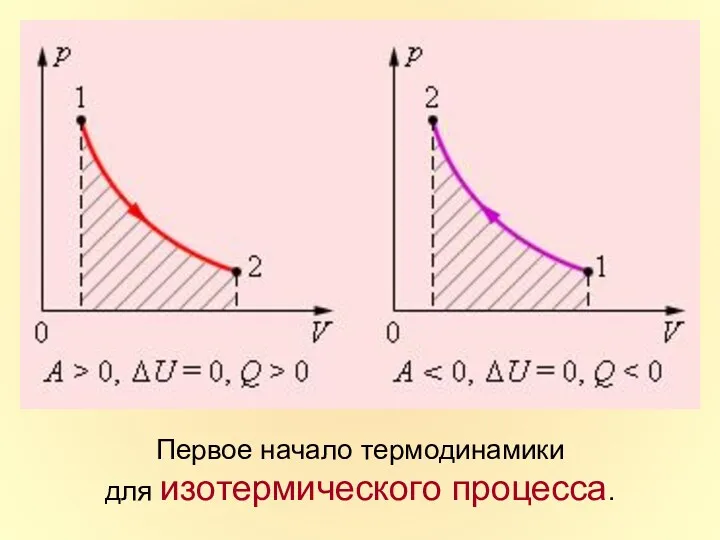
- 13. в изотермическом процессе .
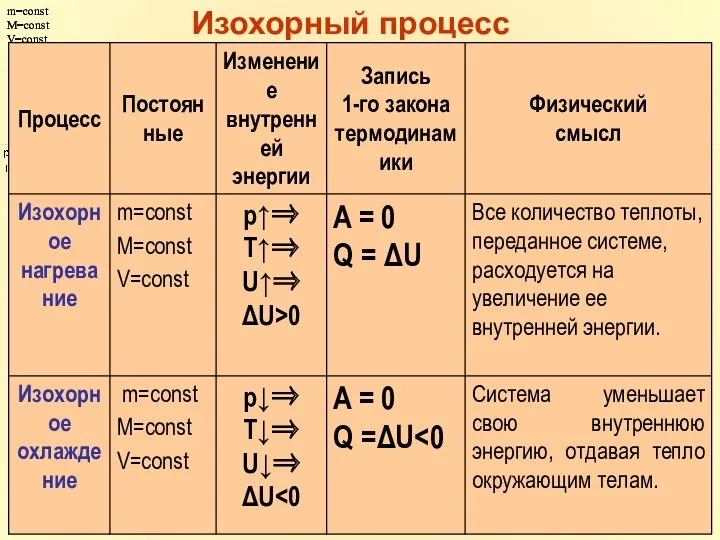
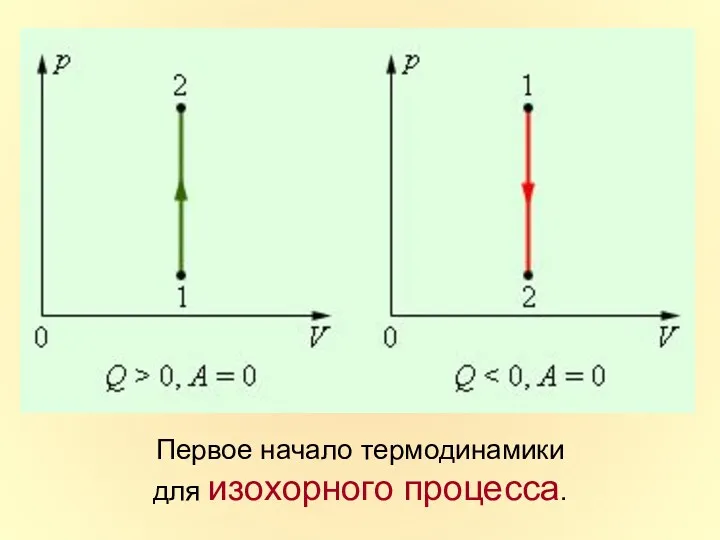
- 14. В изохорном процессе объем не меняется, следовательно, в изохорном процессе работа не совершается!
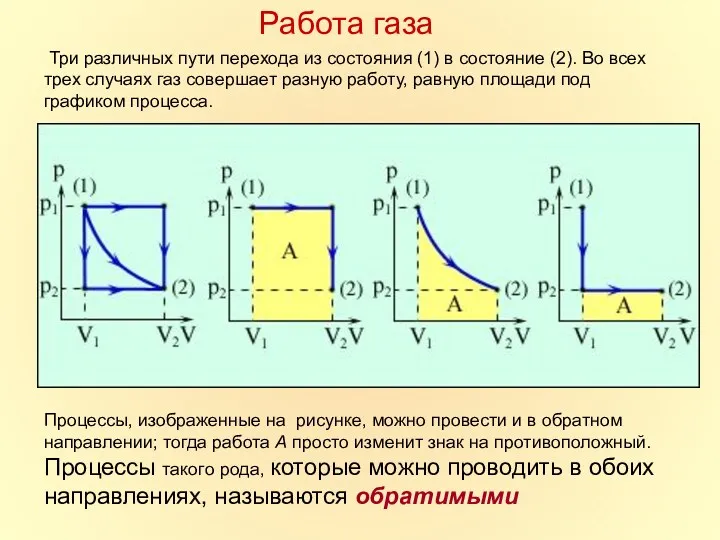
- 15. Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает
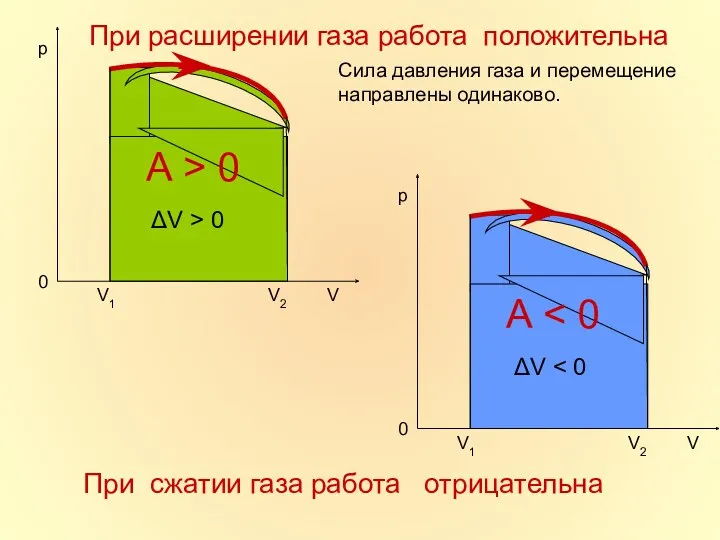
- 16. При расширении газа работа положительна Сила давления газа и перемещение направлены одинаково. При сжатии газа работа
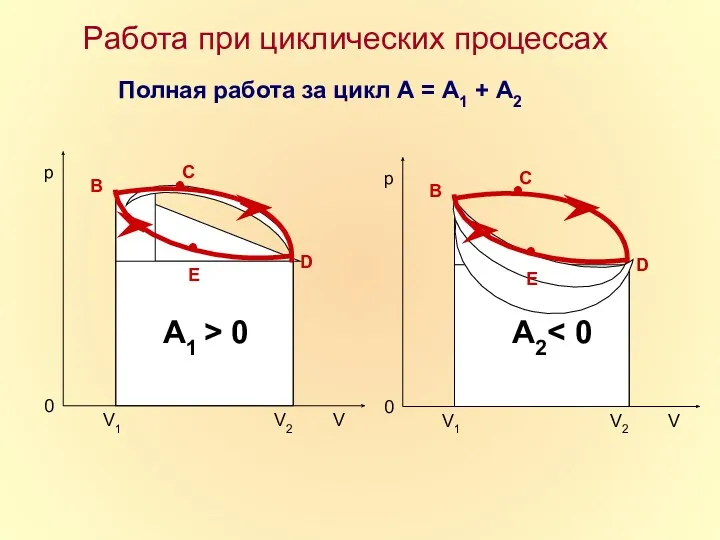
- 17. Работа при циклических процессах Полная работа за цикл А = А1 + А2
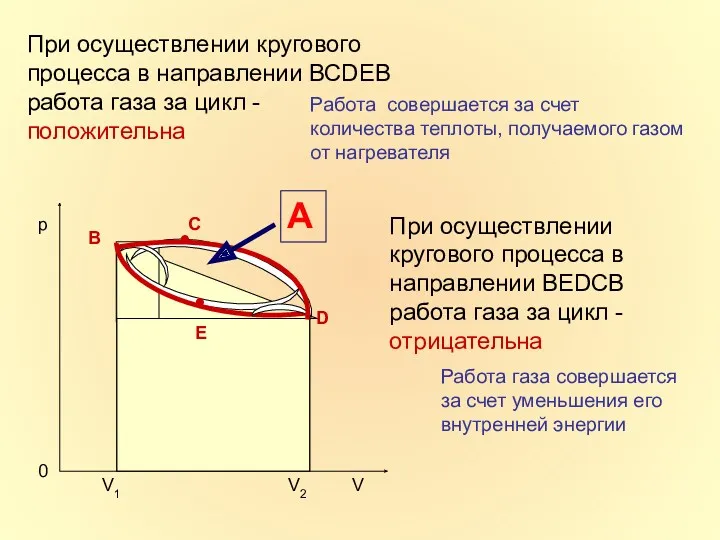
- 18. При осуществлении кругового процесса в направлении ВСDЕВ работа газа за цикл - положительна А При осуществлении
- 19. См. ТеасhPrо 1 закон термодинамики
- 20. Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Изменение ΔU внутренней
- 21. Другая форма записи соотношение, выражающего первый закон термодинамики: Количество теплоты, полученное системой, идет на изменение ее
- 22. Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или
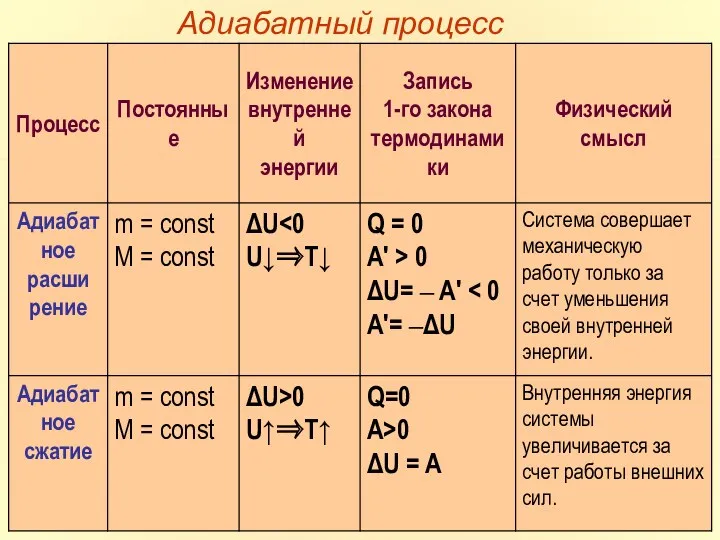
- 23. АДИАБАТНЫЙ ПРОЦЕСС
- 24. Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена
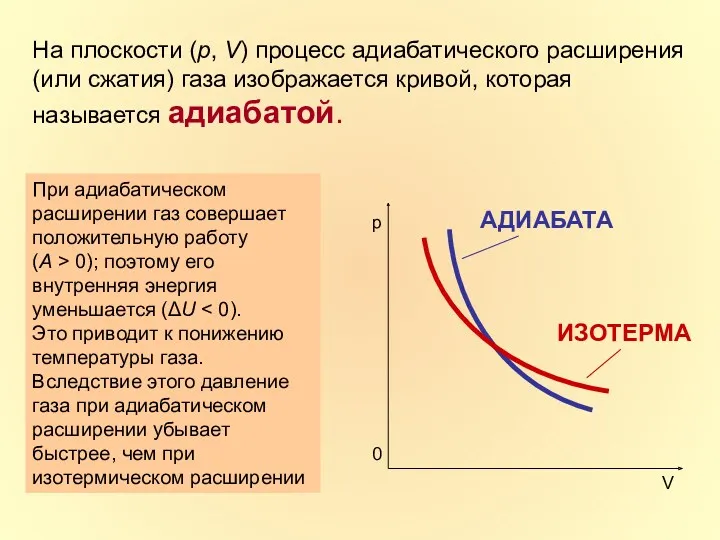
- 25. На плоскости (p, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При
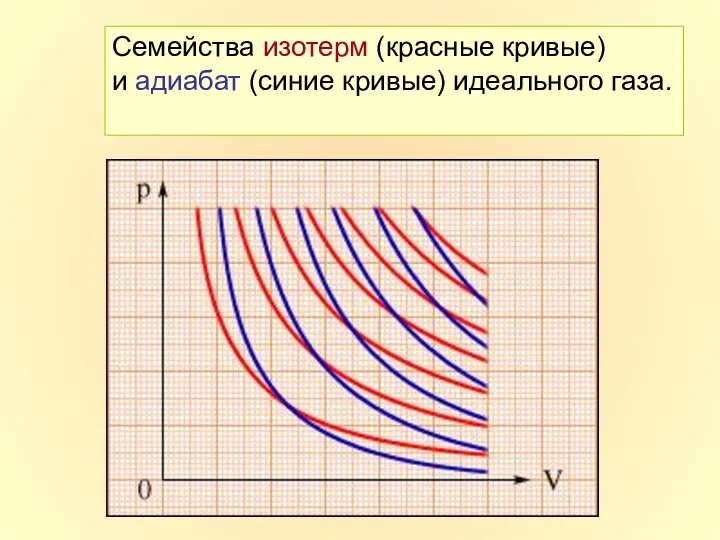
- 26. Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
- 27. Опыт "воздушное огниво". Возьмем толстостенный стеклянный цилиндр с поршнем. На дно цилиндра насыплем измельченной "серы" от
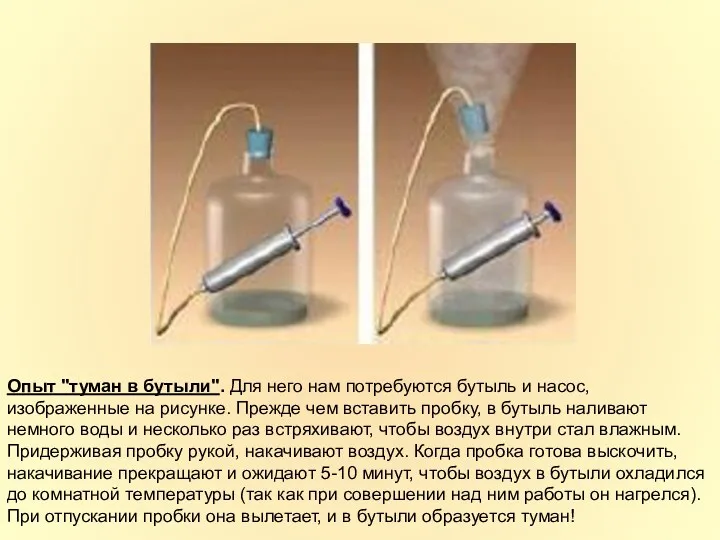
- 28. Опыт "туман в бутыли". Для него нам потребуются бутыль и насос, изображенные на рисунке. Прежде чем
- 29. См. физикон Физика 7-11 Лаборатории Адиабатный процесс
- 30. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К РАЗЛИЧНЫМ ПРОЦЕССАМ
- 32. ı закон термодинамики Q = ΔU + A Изобарный процесс A = p ΔV Изотермический процесс
- 33. Изотермический процесс
- 34. Первое начало термодинамики для изотермического процесса.
- 35. m=const M=const V=const m=const M=const V=const Изохорный процесс
- 36. Первое начало термодинамики для изохорного процесса.
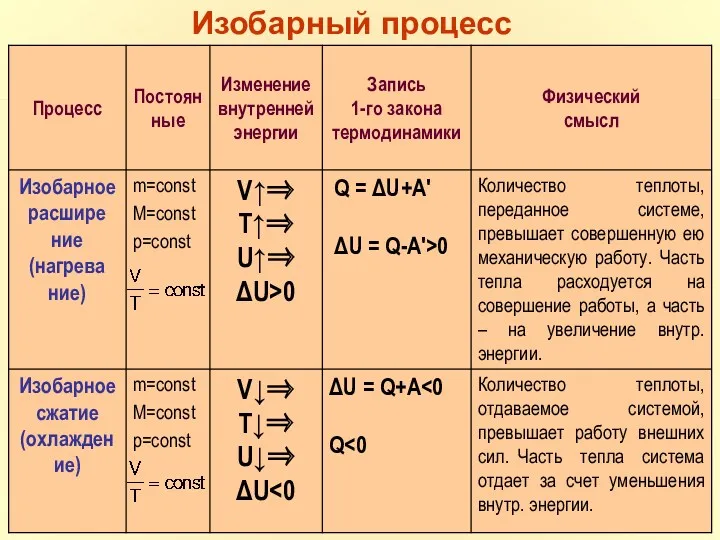
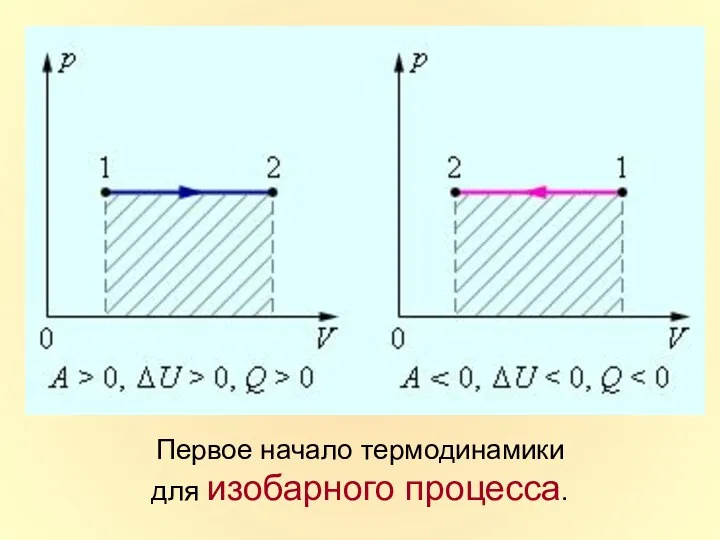
- 37. m=const M=const p=const Изобарный процесс
- 38. Первое начало термодинамики для изобарного процесса.
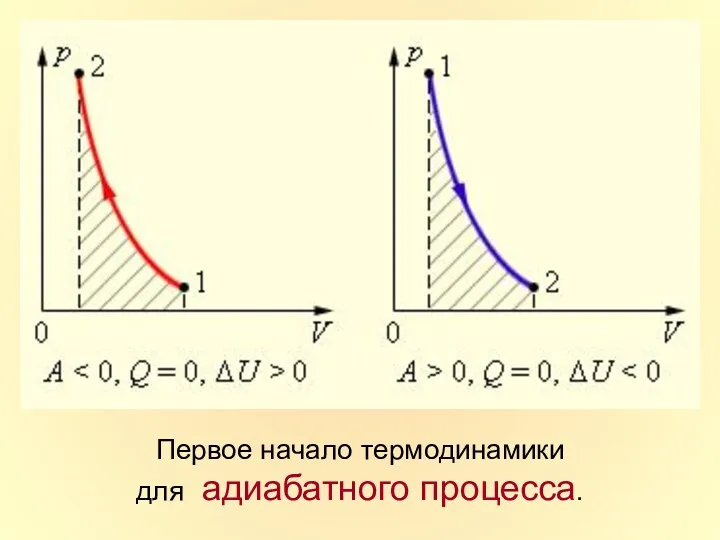
- 39. Адиабатный процесс
- 40. Первое начало термодинамики для адиабатного процесса.
- 42. Скачать презентацию




















 Подготовка к ОГЭ 2021 году в новом формате, по физике
Подготовка к ОГЭ 2021 году в новом формате, по физике Реактивное движение
Реактивное движение Качественные задачи по физике
Качественные задачи по физике Физические основы магнитопорошкового метода контроля
Физические основы магнитопорошкового метода контроля Коэффициент полезного действия механизма
Коэффициент полезного действия механизма Техническое обслуживание и текущий ремонт тормозной системы
Техническое обслуживание и текущий ремонт тормозной системы Вивчення конструкції і зняття кінематичної схеми гайконарізного верстата-автомата. (Лабороторна робота 2)
Вивчення конструкції і зняття кінематичної схеми гайконарізного верстата-автомата. (Лабороторна робота 2) Рентгеновское излучение
Рентгеновское излучение Синхронды машина
Синхронды машина Направление тока и направление линий его магнитного поля. Сила Ампера
Направление тока и направление линий его магнитного поля. Сила Ампера Окружающий мир – иерархическая система
Окружающий мир – иерархическая система Основные положения МКТ. Термодинамические параметры
Основные положения МКТ. Термодинамические параметры Машины для обработки мяса и рыбы
Машины для обработки мяса и рыбы Классификация двигателей внутреннего сгорания
Классификация двигателей внутреннего сгорания Динамика материальной точки и поступательного движения твердого тела
Динамика материальной точки и поступательного движения твердого тела Техническое обслуживание крана машиниста 395
Техническое обслуживание крана машиниста 395 Механическая работа. Единицы работы. Мощность. Единицы мощности
Механическая работа. Единицы работы. Мощность. Единицы мощности Давление. Единицы давления. Способы уменьшения и увеличения давления. 7 класс
Давление. Единицы давления. Способы уменьшения и увеличения давления. 7 класс Атмосферное давление
Атмосферное давление Волны. Звуковые волны. Звук
Волны. Звуковые волны. Звук ВЧ электромагнитные поля в процессах получения керамических тугоплавких материалов для атомной энергетики. Тема 10
ВЧ электромагнитные поля в процессах получения керамических тугоплавких материалов для атомной энергетики. Тема 10 Қаныққан және қанықпаған бу. Ауа ылғалдылығы
Қаныққан және қанықпаған бу. Ауа ылғалдылығы Организация ТО и ремонта автомобиля ВАЗ 2107
Организация ТО и ремонта автомобиля ВАЗ 2107 Лекция 7. Свободные затухающие колебания
Лекция 7. Свободные затухающие колебания Кручение стержней круглого сечения
Кручение стержней круглого сечения Термодинамика. Законы термодинамики
Термодинамика. Законы термодинамики Масс-спектрометрия в протеомных исследованиях. Часть 2: Приложения
Масс-спектрометрия в протеомных исследованиях. Часть 2: Приложения Измерение и оценка факторов: неионизирующие электромагнитные поля (ЭМП) и излучения
Измерение и оценка факторов: неионизирующие электромагнитные поля (ЭМП) и излучения