Содержание
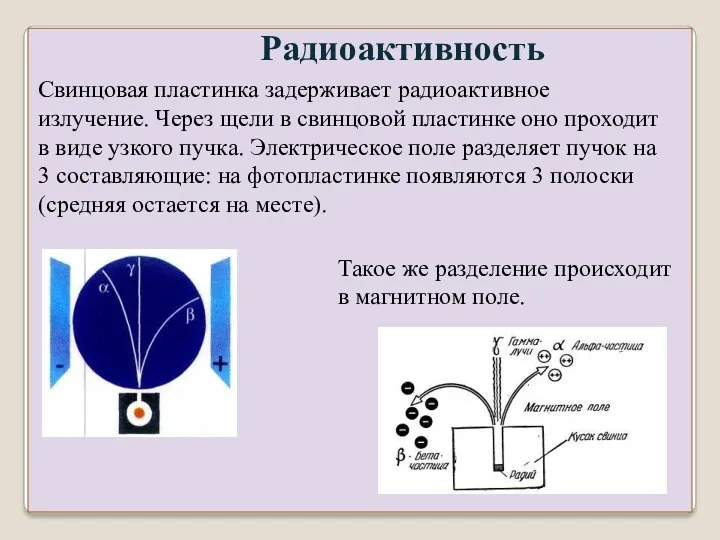
- 2. Радиоактивность Свинцовая пластинка задерживает радиоактивное излучение. Через щели в свинцовой пластинке оно проходит в виде узкого
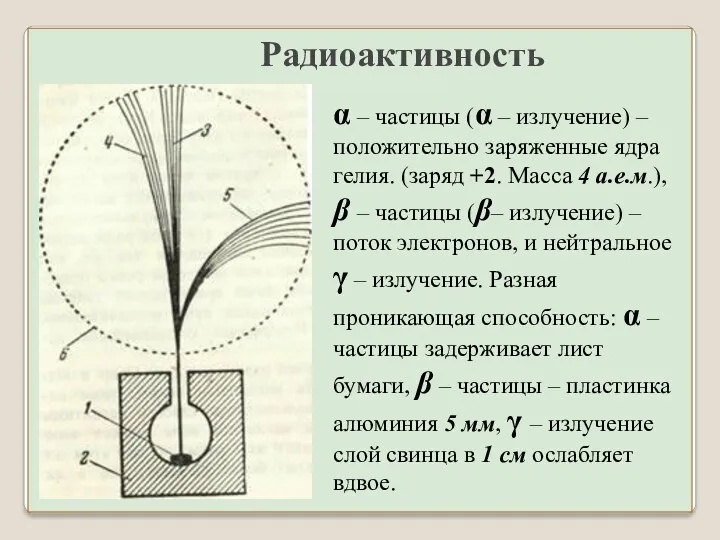
- 3. α – частицы (α – излучение) – положительно заряженные ядра гелия. (заряд +2. Масса 4 а.е.м.),
- 4. Отдельные ядра радиоактивного элемента претерпевают распад независимо друг от друга, ⇒ число ядер dN распадающихся за
- 5. Единицы активности: 1 кюри = 3.7∙1010 с-1 Среднее время жизни:
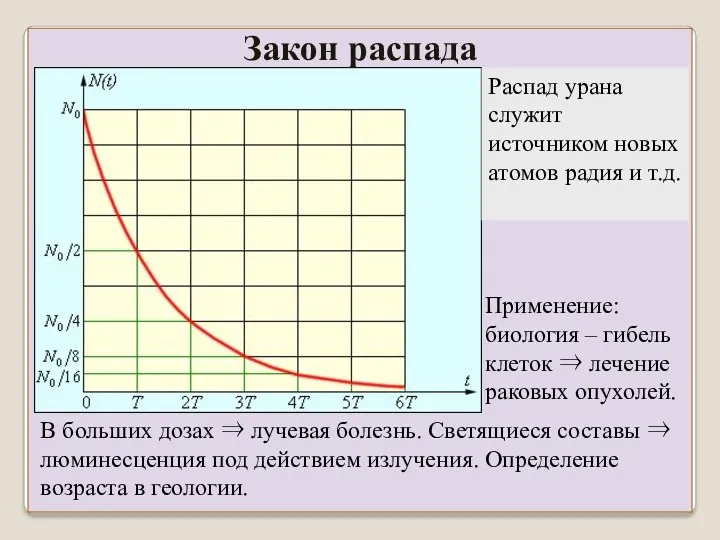
- 6. Интервал времени, в течение которого распадается половина атомов, называется периодом полураспада. Пусть в момент t =
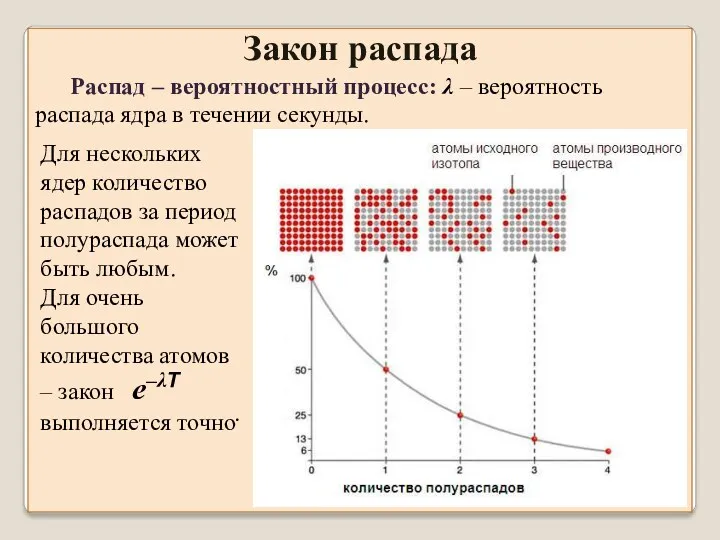
- 7. Распад – вероятностный процесс: λ – вероятность распада ядра в течении секунды. Закон распада Для нескольких
- 8. Период полураспада – одна из основных характеристик радиоактивного элемента – постоянная величина: не меняется при нагреве,
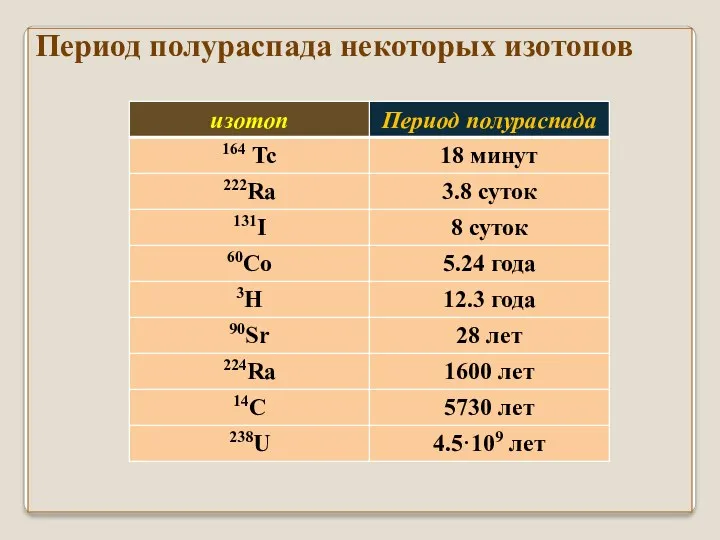
- 9. Период полураспада некоторых изотопов
- 10. В больших дозах ⇒ лучевая болезнь. Светящиеся составы ⇒ люминесценция под действием излучения. Определение возраста в
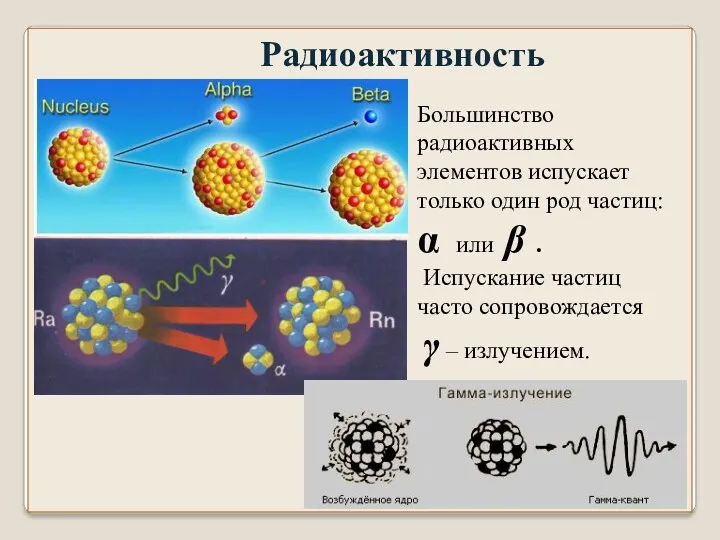
- 11. Радиоактивность Большинство радиоактивных элементов испускает только один род частиц: α или β . Испускание частиц часто
- 12. По жесткости (проникающей способности) γ – излучение превосходит рентгеновское. Последнее приближается к γ – излучению при
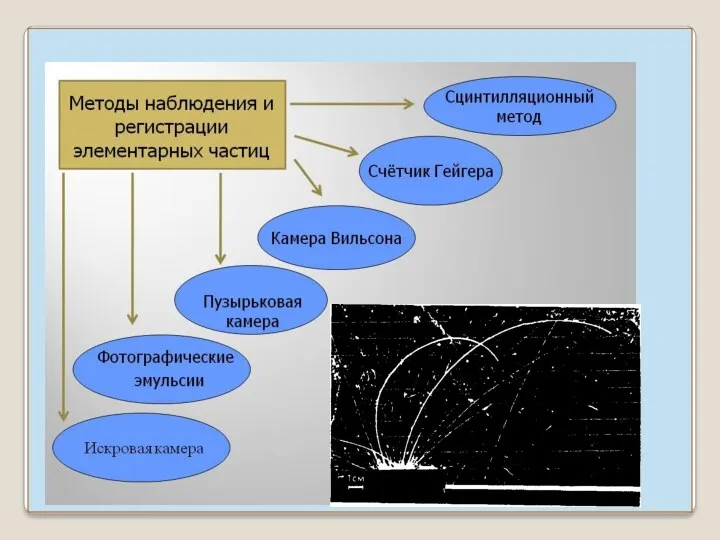
- 15. Сцинтилляции, вызванные α – частицами на экране из сернистого цинка, могут быть обнаружены глазом Однако для
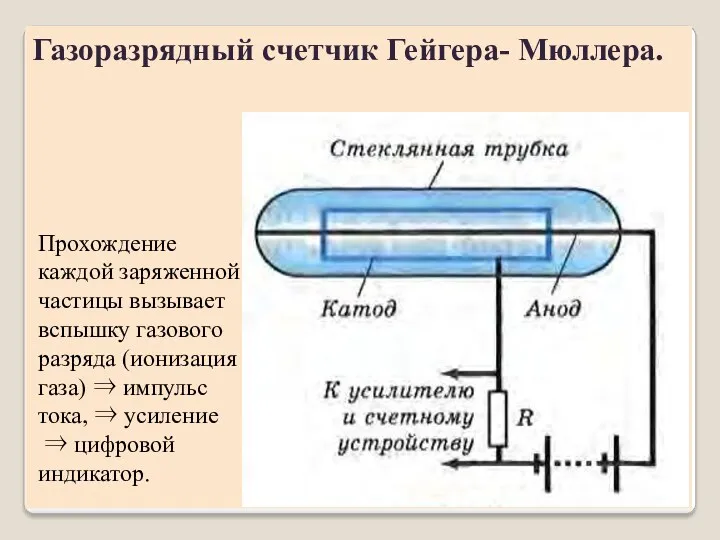
- 16. Газоразрядный счетчик Гейгера- Мюллера. Прохождение каждой заряженной частицы вызывает вспышку газового разряда (ионизация газа) ⇒ импульс
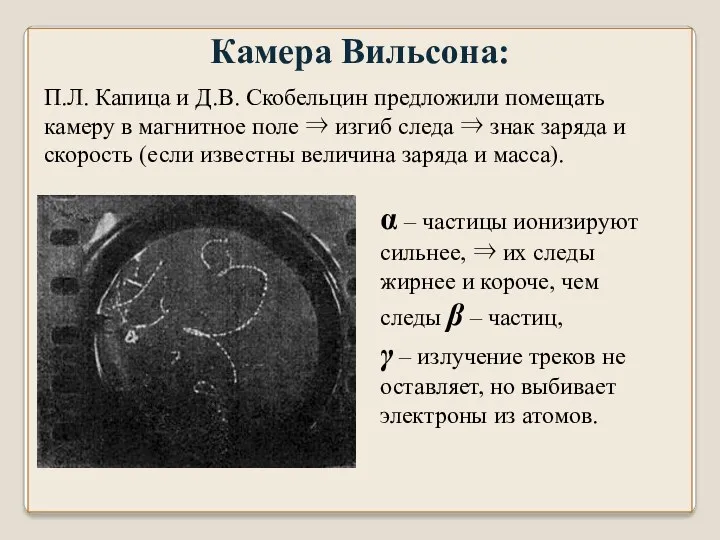
- 17. Камера Вильсона прибор для наблюдения путей быстрых заряженных частиц (треков). В камере находится пар воды или
- 18. Первые снимки треков отдельных электронов были получены Вильсоном при помощи созданной им Камеры в 1912 году
- 19. П.Л. Капица и Д.В. Скобельцин предложили помещать камеру в магнитное поле ⇒ изгиб следа ⇒ знак
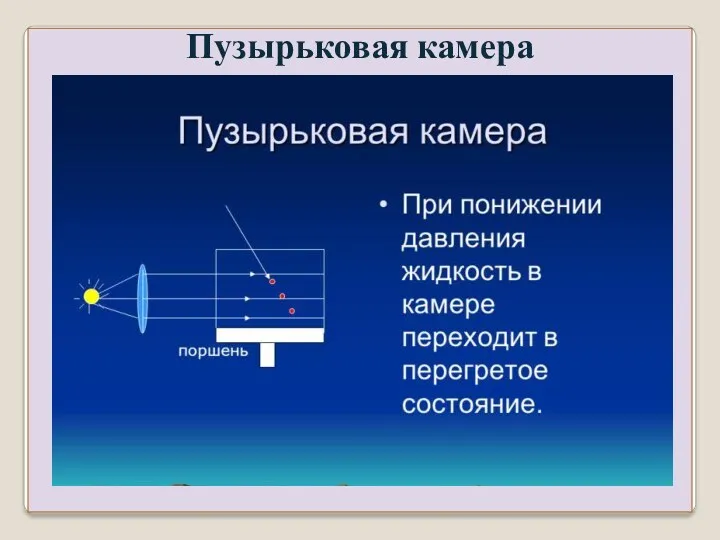
- 20. Пузырьковая камера
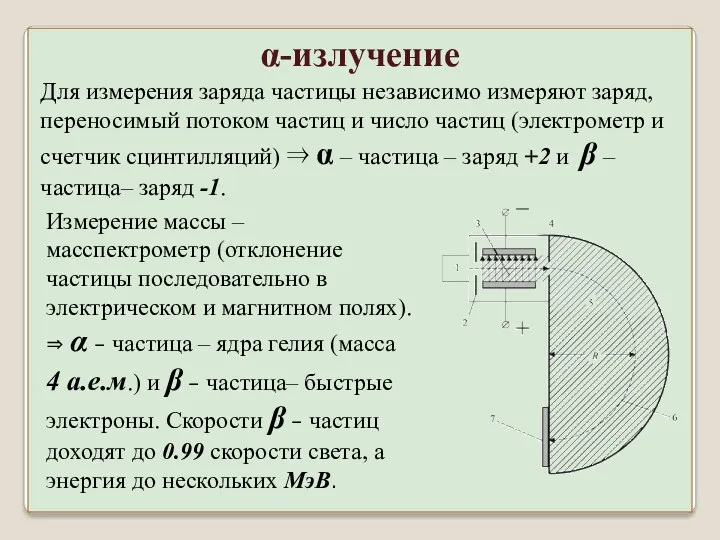
- 21. Для измерения заряда частицы независимо измеряют заряд, переносимый потоком частиц и число частиц (электрометр и счетчик
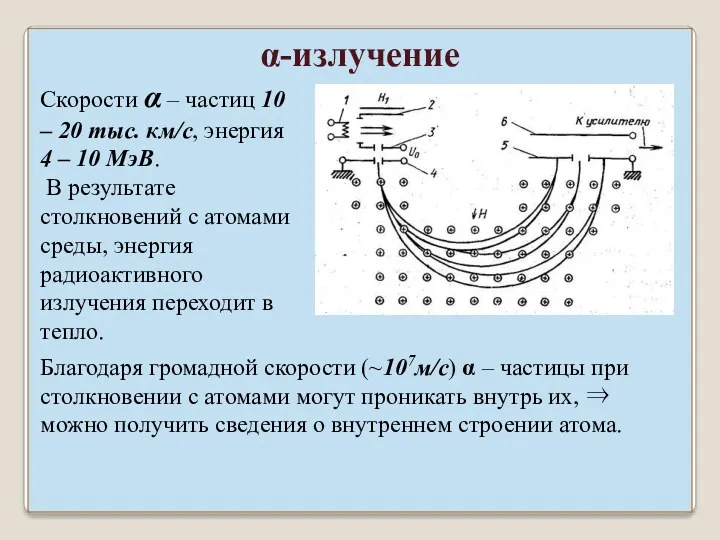
- 22. Скорости α – частиц 10 – 20 тыс. км/с, энергия 4 – 10 МэВ. В результате
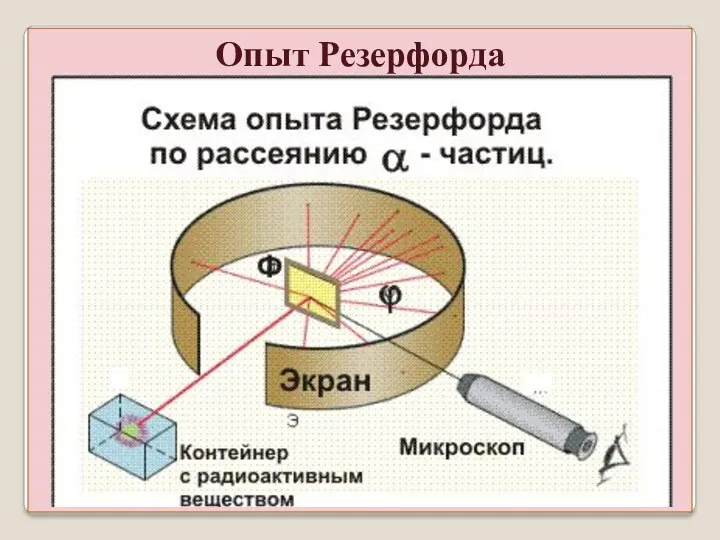
- 23. Опыт Резерфорда
- 24. Источник α – частиц, диафрагма с отверстием формирует узкий пучок. Люминесцирующий экран, на котором видно светящееся
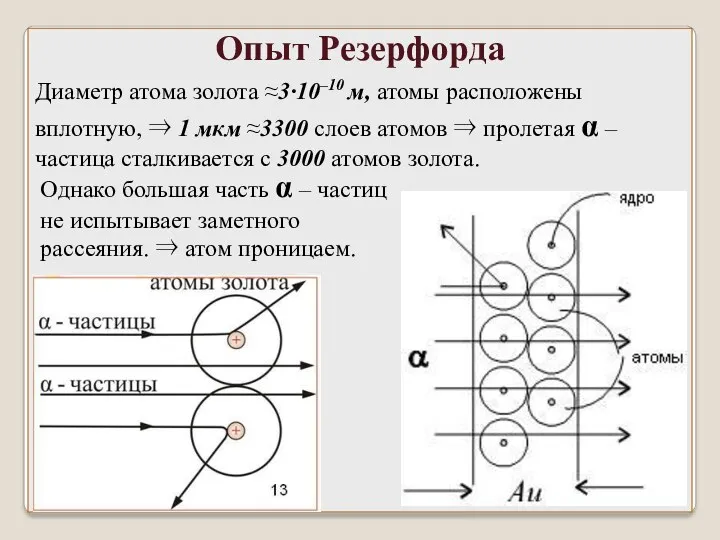
- 25. Диаметр атома золота ≈3∙10–10 м, атомы расположены вплотную, ⇒ 1 мкм ≈3300 слоев атомов ⇒ пролетая
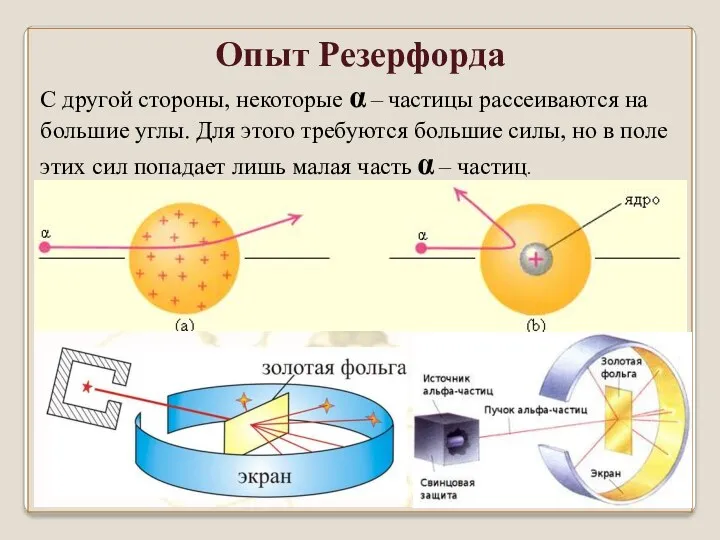
- 26. С другой стороны, некоторые α – частицы рассеиваются на большие углы. Для этого требуются большие силы,
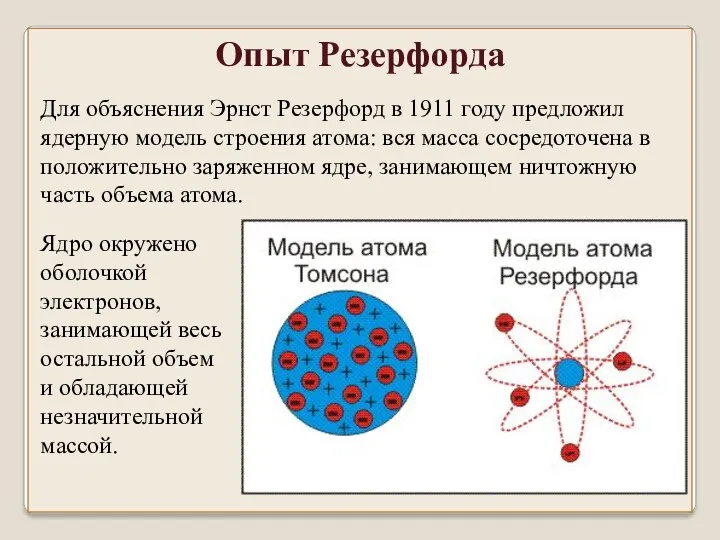
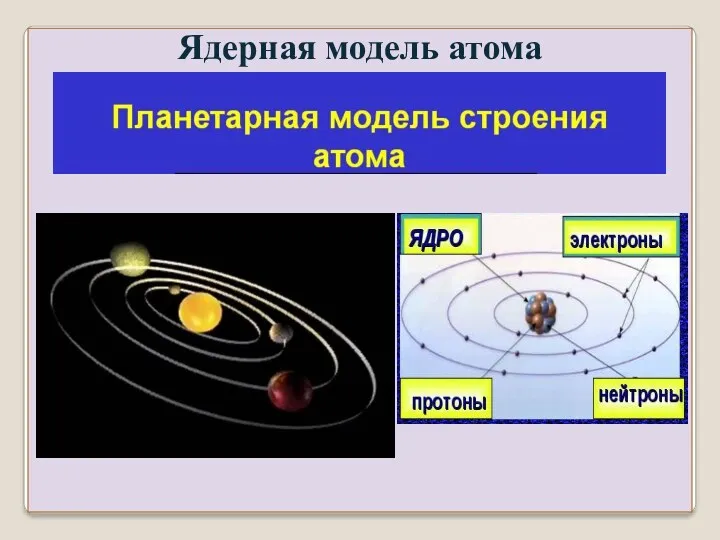
- 27. Для объяснения Эрнст Резерфорд в 1911 году предложил ядерную модель строения атома: вся масса сосредоточена в
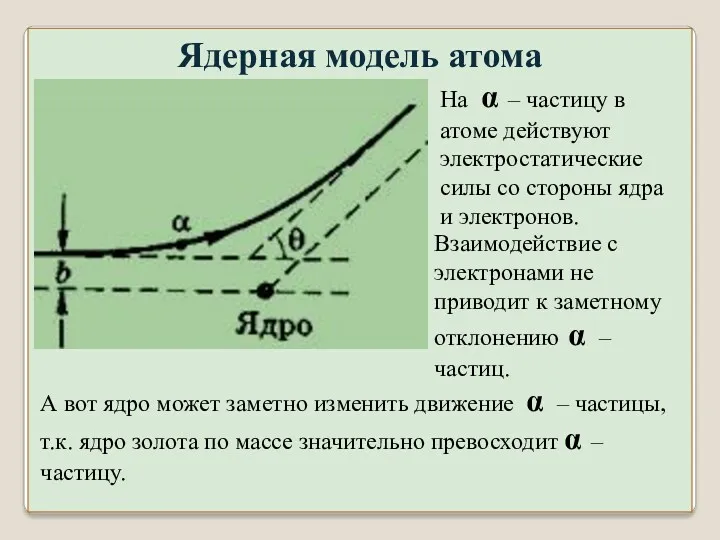
- 28. Ядерная модель атома
- 29. Ядерная модель атома А вот ядро может заметно изменить движение α – частицы, т.к. ядро золота
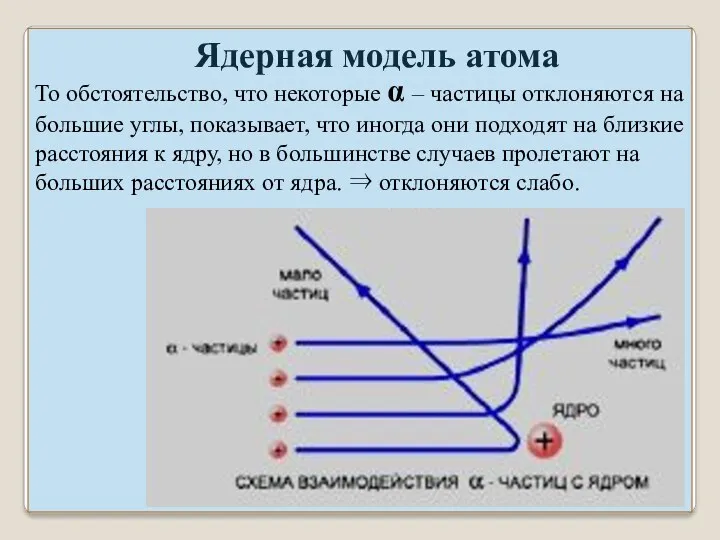
- 30. Ядерная модель атома То обстоятельство, что некоторые α – частицы отклоняются на большие углы, показывает, что
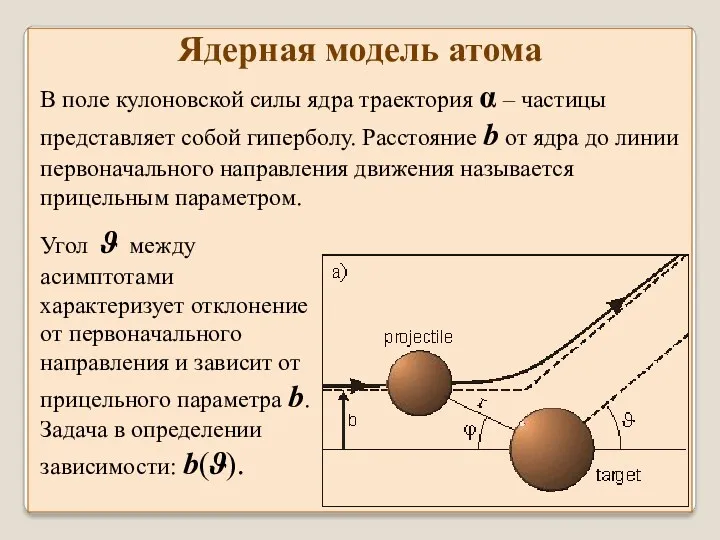
- 31. Ядерная модель атома Используя закон Кулона и законы динамики Ньютона, Резерфорд рассчитал зависимость числа рассеянных α
- 32. Угол ϑ между асимптотами характеризует отклонение от первоначального направления и зависит от прицельного параметра b. Задача
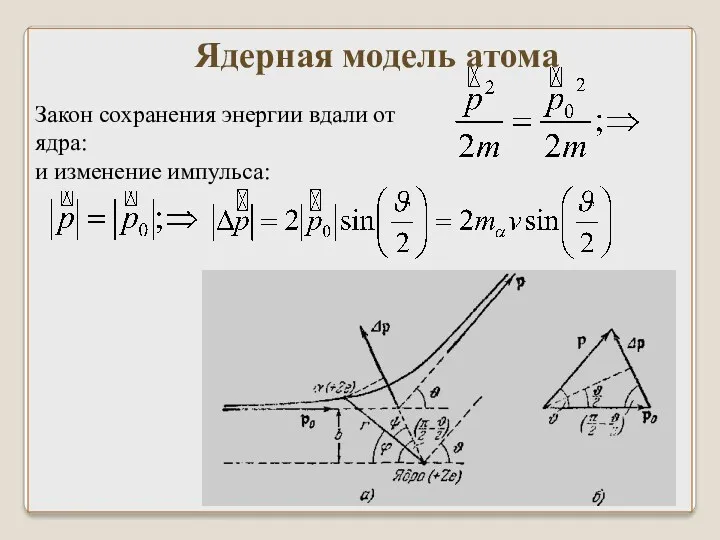
- 33. Ядерная модель атома Закон сохранения энергии вдали от ядра: и изменение импульса:
- 34. Ядерная модель атома Но: По закону Кулона: Закон сохранения момента импульса: ⇒
- 35. После интегрирования: Ядерная модель атома Или: Где ЕК – кинетическая энергия α – частицы.
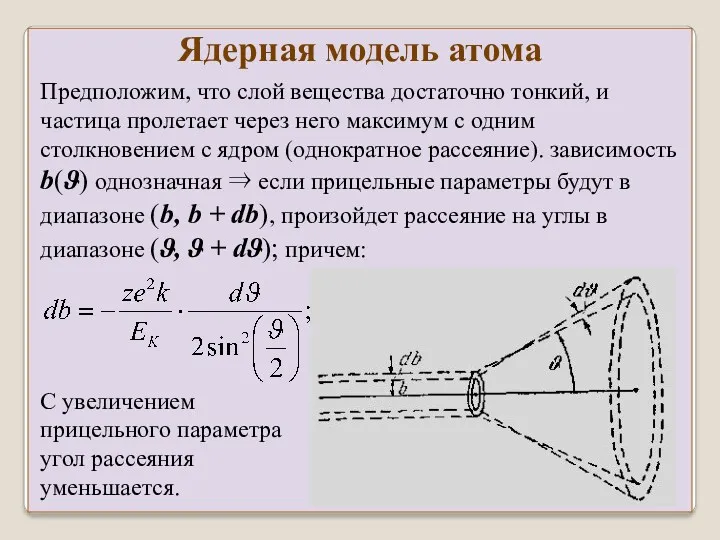
- 36. Предположим, что слой вещества достаточно тонкий, и частица пролетает через него максимум с одним столкновением с
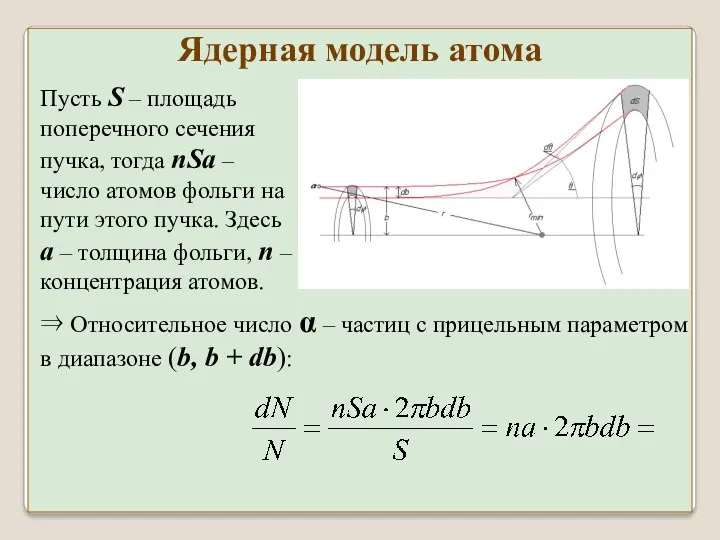
- 37. Пусть S – площадь поперечного сечения пучка, тогда nSa – число атомов фольги на пути этого
- 38. Ядерная модель атома Формула Резерфорда
- 39. Летящая точно по центру ядра α – частица подойдет к ядру на минимальное расстояние: Для серебра
- 40. Модель атома Бора Простейшим является атом водорода, состоящий из ядра с зарядом +e и одного электрона.
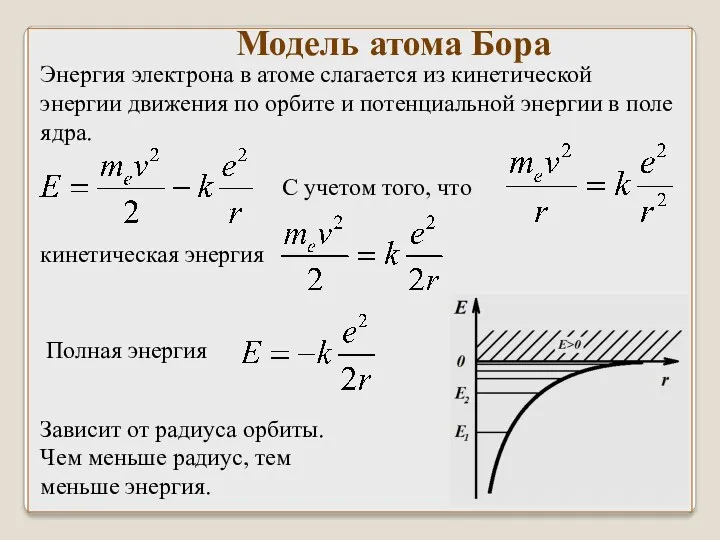
- 41. Модель атома Бора Энергия электрона в атоме слагается из кинетической энергии движения по орбите и потенциальной
- 42. Модель атома Бора Противоречия: Неравноправность любых орбит, не противоречащих законам классической механики и устойчивость атома в
- 43. Н. Бор в 1913 году дал первое объяснение квантовым энергетическим уровням в атомах, линейчатым спектрам, которые
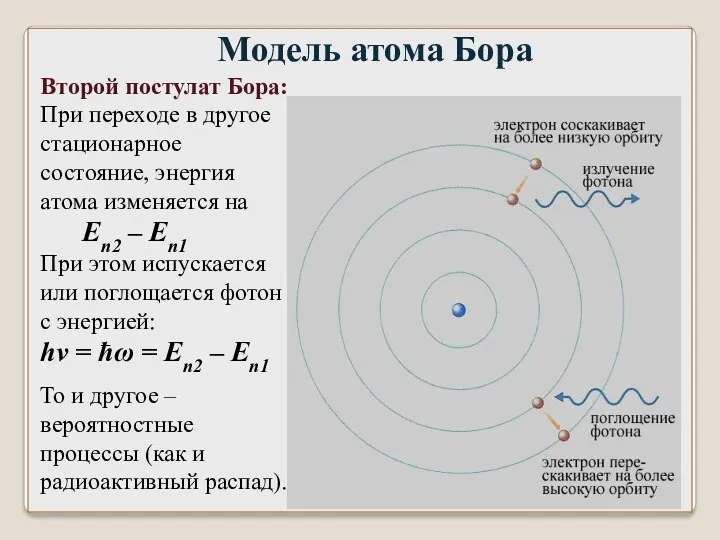
- 44. Модель атома Бора Второй постулат Бора: При переходе в другое стационарное состояние, энергия атома изменяется на
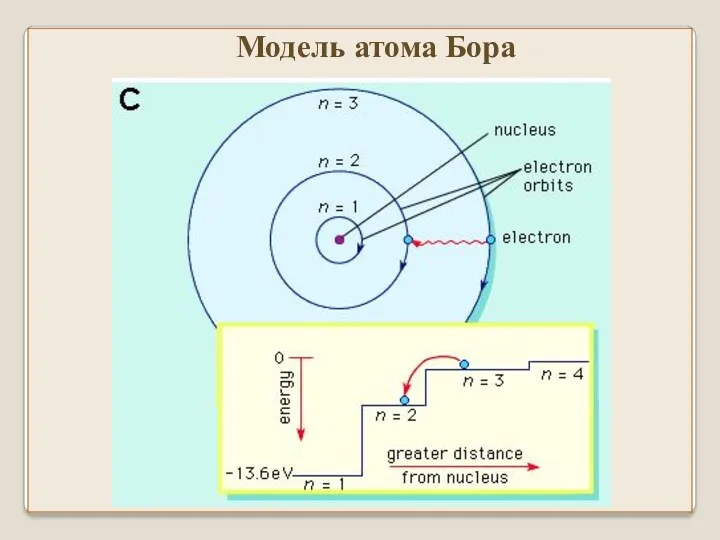
- 45. Модель атома Бора
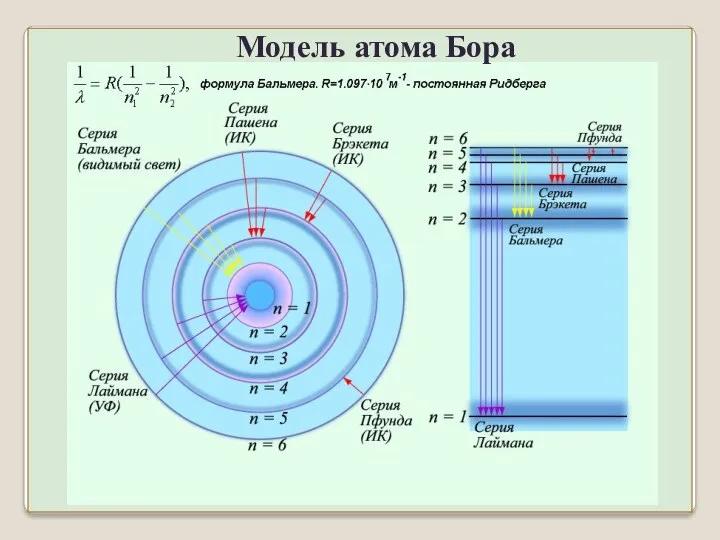
- 46. Модель атома Бора
- 47. При переходе атома водорода из состояния n в состояние m испускается фотон с энергией: ħω =
- 48. Потенциал ионизации водорода. ϕион = 13.6 В Попытки построения теории атома гелия оказались неудачными. В настоящее
- 50. Скачать презентацию




















 Экологическое образование в процессе обучения физике
Экологическое образование в процессе обучения физике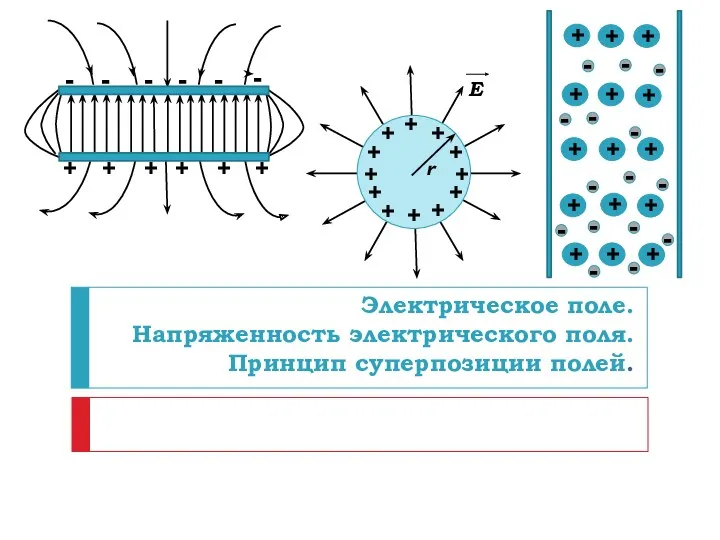 Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей
Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей Динамика твердого тела. Лекция 5: Плоское движение твердого тела
Динамика твердого тела. Лекция 5: Плоское движение твердого тела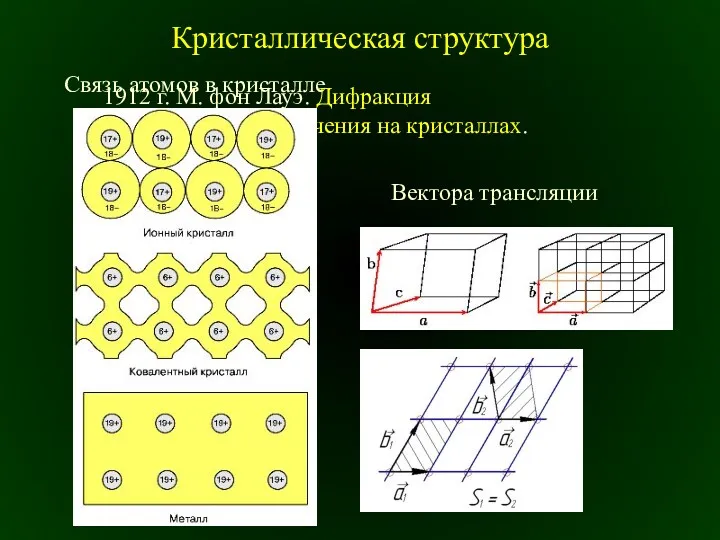 Кристаллическая структура
Кристаллическая структура Фізика в житті сучасної людини
Фізика в житті сучасної людини Mass spectrometry
Mass spectrometry Урок- игра по теме Масса вещества.Плотность
Урок- игра по теме Масса вещества.Плотность Сила упругости 7 класс, презентация
Сила упругости 7 класс, презентация Физико–химические свойства нефти, нефтепродуктов. Качество нефти и нефтепродуктов. Методы их анализа
Физико–химические свойства нефти, нефтепродуктов. Качество нефти и нефтепродуктов. Методы их анализа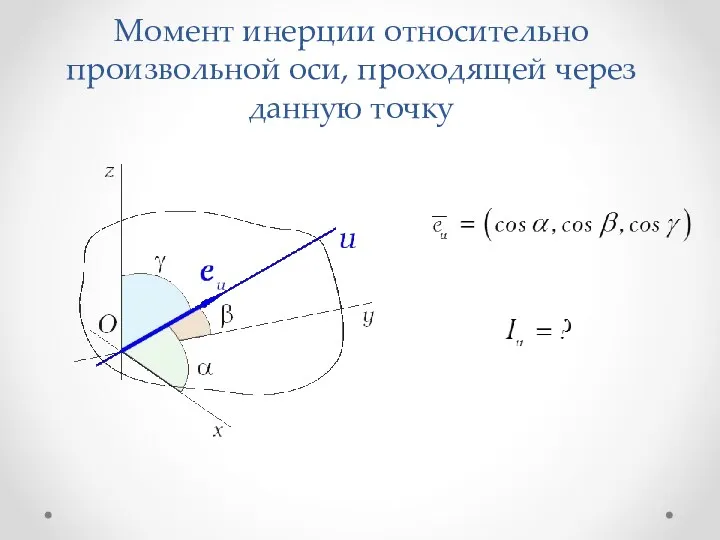 Момент инерции относительно произвольной оси, проходящей через данную точку. (Лекция 5)
Момент инерции относительно произвольной оси, проходящей через данную точку. (Лекция 5) Репортаж с фестиваля наук. Экспериментальная площадка Метеорологическая лаборатория
Репортаж с фестиваля наук. Экспериментальная площадка Метеорологическая лаборатория Формирование исследовательских умений школьников
Формирование исследовательских умений школьников Реактивное движение
Реактивное движение Излучение и спектры
Излучение и спектры Energy and power, solar astronomy. (Lecture 4)
Energy and power, solar astronomy. (Lecture 4) Физика в белом халате
Физика в белом халате Механическое движение
Механическое движение Unusual modes pf transport
Unusual modes pf transport Структура пограничного слоя при продольном обтекании сотовой поверхности
Структура пограничного слоя при продольном обтекании сотовой поверхности Металлический водород
Металлический водород Основные узлы станка
Основные узлы станка Закон радиоактивного распада
Закон радиоактивного распада Озоновый слой атмосферы. Ультрафиолетовое излучение
Озоновый слой атмосферы. Ультрафиолетовое излучение Механическое оборудование и система вентиляции
Механическое оборудование и система вентиляции Спектры и спектральные аппараты. Виды спектров. Спектральный анализ
Спектры и спектральные аппараты. Виды спектров. Спектральный анализ Радиолокация
Радиолокация Паровая машина Ползунова
Паровая машина Ползунова Скорость света
Скорость света