Слайд 2

Распределения молекул.
Распределение Максвелла. Средняя, средняя квадратичная и наиболее вероятная скорости
молекул.
Распределение молекул в поле внешних сил (распределение Больцмана). Барометрическая формула.
Распределение Максвелла-Больцмана.
Средняя длина свободного пробега молекулы.
Слайд 3

1. Распределение Максвелла. Средняя, средняя квадратичная и наиболее вероятная скорости молекул.
Согласно
молекулярно-кинетической теории, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой m0 в газе, находящемся в состоянии равновесия при Т = const, остается постоянной и равной:
Это означает, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону.
Слайд 4

Исходные положения Максвелла при выводе распределения:
- Газ состоит из большого числа
N одинаковых молекул.
- Температура газа постоянна.
- Молекулы газа совершают тепловое хаотическое движение.
- Из-за хаотического движения молекул все направления движения равновероятны, т. е. в любом направлении в среднем движется одинаковое число молекул.
- На газ не действуют силовые поля.
Слайд 5

Если разбить диапазон скоростей молекул на малые интервалы dυ, то на
каждый интервал скорости будет приходиться некоторое число молекул, имеющих скорость, заключенную в этом интервале. Функция f(υ) определяет относительное число молекул скорости которых лежат в интервале от υ до υ+dυ, т. е.:
, тогда
- вероятность того, что скорости молекулы заключены в интервале от υ до υ+dυ.
Условие нормировки для функции f(υ):
Слайд 6

Функция распределения:
особенности зависимости f(υ) от υ:
- В показателе экспоненциальной функции имеем
взятое с минусом отношение кинетической энергии молекулы к kT (средняя энергия молекулы).
- График функции f(υ), начинаясь в нуле, достигает максимума, а затем асимптотически стремится к нулю; она несимметрична относительно υ.
- Относительное число молекул dNυ/N, скорости которых лежат в интервале от υ до υ+dυ, находится как площадь закрашенной полоски.
Слайд 7

Из условия нормировки:
находим:
Закон Максвелла о распределении молекул по скоростям:
Слайд 8

Наиболее вероятная скорость - скорость, при которой функция распределения молекул идеального
газа по скоростям максимальна.
Продифференцируем f(υ) по υ, результат приравняем 0:
Это равенство выполняется при значении скорости:
Слайд 9
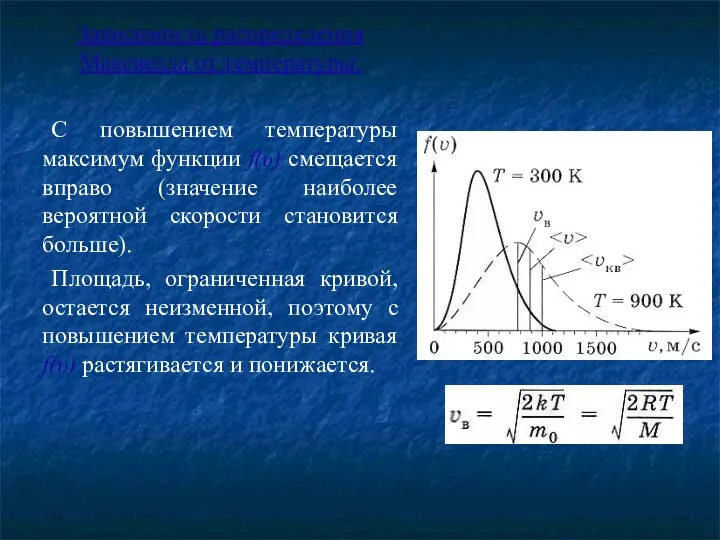
Зависимость распределения Максвелла от температуры:
С повышением температуры максимум функции f(υ) смещается
вправо (значение наиболее вероятной скорости становится больше).
Площадь, ограниченная кривой, остается неизменной, поэтому с повышением температуры кривая f(υ) растягивается и понижается.
Слайд 10

Слайд 11

Средняя квадратичная скорость молекулы:
Слайд 12
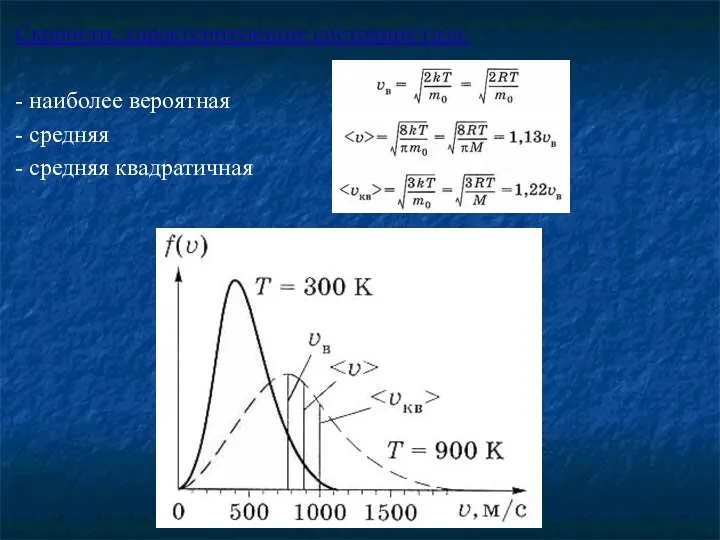
Скорости, характеризующие состояние газа:
- наиболее вероятная
- средняя
- средняя квадратичная
Слайд 13

Функция распределения молекул по энергиям теплового движения:
Вероятность того, что энергии молекул
заключены в интервале от ε до ε+dε:
Закон Максвелла о распределении молекул идеального газа по энергиям теплового движения:
Слайд 14

Число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от
ε до dε:
Функция распределения молекул по энергиям теплового движения:
Средняя кинетическая энергия молекулы идеального газа:
Наиболее вероятное значение энергии молекул идеального газа:
Слайд 15

2. Распределение молекул в поле внешних сил (распределение Больцмана). Барометрическая формула.
Барометрическая
формула - зависимость атмосферного давления р от высоты h.
Исходные положения при выводе формулы:
Поле тяготения однородно.
Температура постоянна.
Масса всех молекул одинакова.
Ускорение свободного падения постоянно
Слайд 16

Если атмосферное давление на высоте h равно р, то на высоте
h+dh оно равно p+dp
Разность давлений р и р+dp равна весу газа, заключенного в объеме цилиндра высотой dh, площадь основания которого равна единице площади:
С изменением высоты от h1 до h2 давление изменяется от р1 до р2:
Слайд 17

Барометрическая формула:
Распределение Больцмана:
При постоянной температуре плотность газа больше там, где меньше
потенциальная энергия его молекул. Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
Слайд 18

3. Распределение Максвелла-Больцмана..
САМОСТОЯТЕЛЬНО
Слайд 19
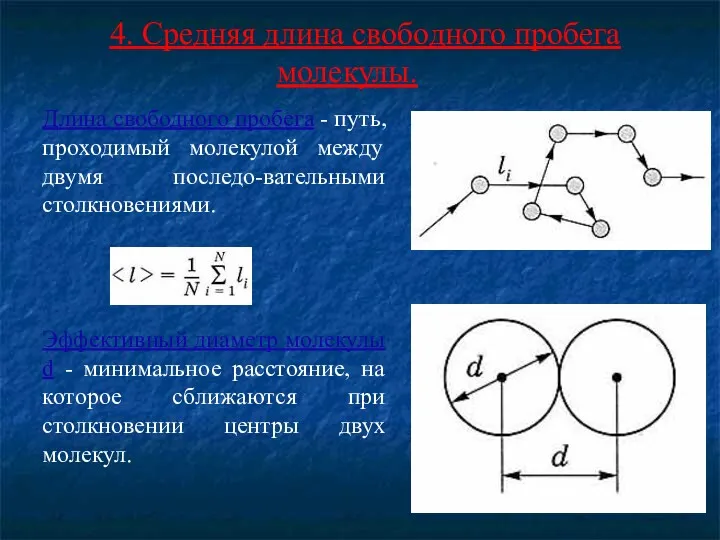
4. Средняя длина свободного пробега молекулы.
Длина свободного пробега - путь,
проходимый молекулой между двумя последо-вательными столкновениями.
Эффективный диаметр молекулы d - минимальное расстояние, на которое сближаются при столкновении центры двух молекул.
Слайд 20

Среднее число столкновений молекулы за 1 с:
Модель: молекула в виде шарика
диаметром d движется среди «застывших» молекул. Среднее число столкновений равно числу молекул в объеме «ломаного» цилиндра:
при учете движения других молекул:



















 Виникнення автобуса
Виникнення автобуса Полусинусоидальный импульс ударного воздействия
Полусинусоидальный импульс ударного воздействия Архимед күші
Архимед күші Рентгеновское излучение. Открытие рентгеновских лучей
Рентгеновское излучение. Открытие рентгеновских лучей Применение сообщающихся сосудов
Применение сообщающихся сосудов Уравнение состояния реального газа Ван-Дер-Ваальса. (Лекция 11)
Уравнение состояния реального газа Ван-Дер-Ваальса. (Лекция 11) Колебания и волны
Колебания и волны Фундаментальные концепции физического описания природы
Фундаментальные концепции физического описания природы Кинематика движения материальной точки. Тема 2
Кинематика движения материальной точки. Тема 2 Лазерный дальномер
Лазерный дальномер ЭМИ
ЭМИ Давление и Архимедова сила. Физика. 7 класс
Давление и Архимедова сила. Физика. 7 класс Свободный электронный газ
Свободный электронный газ Гидродинамика идеальной жидкости
Гидродинамика идеальной жидкости Экскаваторы непрерывного действия
Экскаваторы непрерывного действия Электромагнитные волны. основные понятия
Электромагнитные волны. основные понятия Экспериментальные методы исследования частиц
Экспериментальные методы исследования частиц Теплофизика. Теория теплообмена
Теплофизика. Теория теплообмена Изучение действия силы Кориолиса в движении маятника Фуко
Изучение действия силы Кориолиса в движении маятника Фуко Действия электрического тока
Действия электрического тока Сценарий внеклассного мероприятия Посвящение в электрики
Сценарий внеклассного мероприятия Посвящение в электрики кейс-технологии на уроках математике
кейс-технологии на уроках математике Роторный двигатель
Роторный двигатель Формирование учебно-познавательной компетенции учащихся второй ступени обучения на уроках физики
Формирование учебно-познавательной компетенции учащихся второй ступени обучения на уроках физики Презентация Формирование учебно-познавательной компетенции учащихся второй ступени обучения через создание проблемных ситуаций на уроках физики.
Презентация Формирование учебно-познавательной компетенции учащихся второй ступени обучения через создание проблемных ситуаций на уроках физики. Системы крепления концевого инструмента на станках с ЧПУ. Редимные средства
Системы крепления концевого инструмента на станках с ЧПУ. Редимные средства Техническая механика. Внутренние силы. Напряжения и деформации
Техническая механика. Внутренние силы. Напряжения и деформации презентация к уроку физики Законы сохранения
презентация к уроку физики Законы сохранения