Содержание
- 2. Реальные газы В реальных газах молекулы представляют собой упругие тела, имеют собственный объем и взаимодействуют между
- 3. К выводу уравнения Ван-Дер-Ваальса Обозначим собственный объем молекул реального газа буквой b, тогда: v-b=RT/p, то есть
- 4. Константа Ван-Дер-Ваальса Давление – это результат ударов молекул о ● ● стенки сосуда. ● Притяжение других
- 5. Уравнение Ван-Дер-Ваальса Итак, уравнение состояния реальных газов Ван-Дер-Ваальса: . Ван-Дер-Ваальс учел только два фактора, отличающих реальные
- 6. Уравнение состояния реальных газов Более точным является уравнение Вукаловича-Новикова, в котором учтены дополнительно ассоциация (объединение в
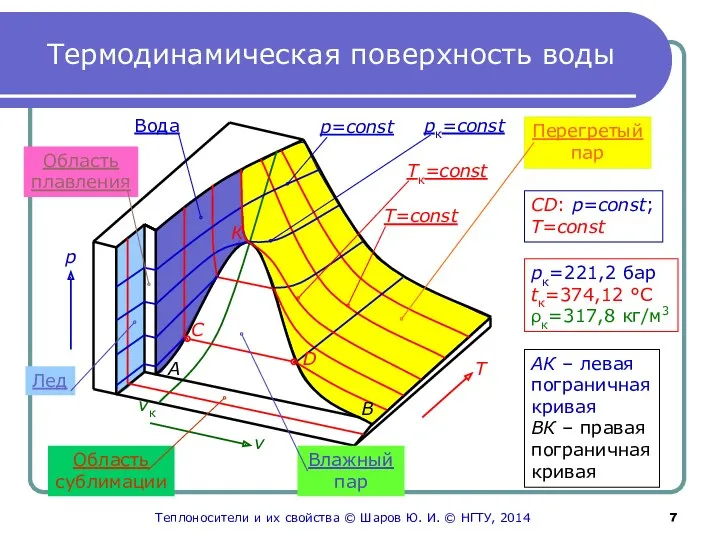
- 7. Термодинамическая поверхность воды Область сублимации v Влажный пар Т р Перегретый пар Лед Область плавления Вода
- 8. Парообразование на поверхности воды (испарение) Испарение – это парообразование на поверхностиводы, которое происходит при любой температуре.
- 9. Воздушно-испарительное охлаждение При вылете из воды самых быстрых молекул уменьшается средняя кинетическая энергия движения молекул воды,
- 10. Парообразование во всем объеме воды (кипение) Когда вода нагрета до температуры кипения (насыщения), начинается парообразование во
- 11. Конденсация пара. Насыщенный пар При охлаждении пара происходит его конденсация, то есть превращение пара в воду.
- 12. Влажный насыщенный пар При неполном испарении воды пар называется влажным насыщенным. Массовая доля пара во влажном
- 13. Водяной пар Водяной пар является рабочим телом паротурбинных установок (ПТУ). Водяной пар – это реальный газ,
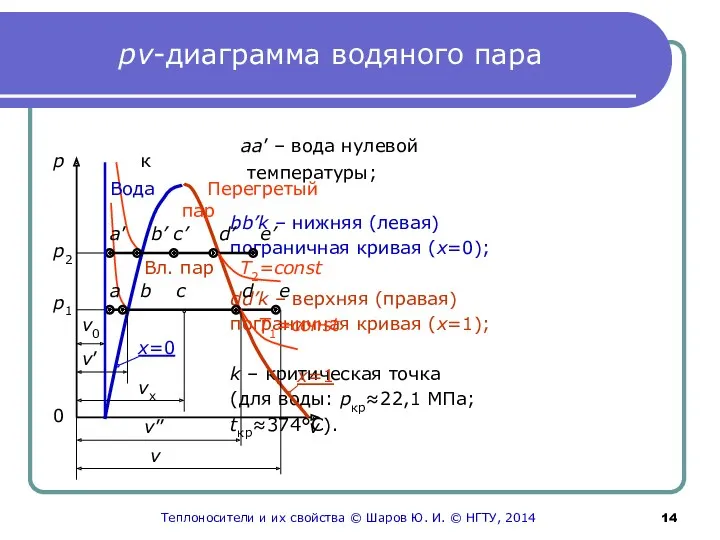
- 14. рv-диаграмма водяного пара aa’ – вода нулевой температуры; bb’k – нижняя (левая) пограничная кривая (х=0); dd’k
- 15. К pv-диаграмме Слева от пограничной кривой – вода; между пограничными кривыми – влажный пар; правее верхней
- 16. Процессы и состояния воды и пара точка b (v’; х=0) – вода на линии насыщения (закипающая);
- 17. pt-диаграмма В pt -диаграмме процессы изменения агрегатного состояния (2-фазные состояния при t=const) изображаются точками («b» –
- 18. Тройная точка воды Линия АВ – зависимость температуры плавления льда от давления; она является границей твердой
- 19. Возгонка или сублимация. Параметры состояния Если лед нагревать при p минуя жидкое состояние (воду). Такой процесс
- 20. Теплота нагрева воды до температуры насыщения Для изобарного нагрева bc 1 кг воды от t0=0 °C
- 21. Изменение энтропии Увеличение энтропии воды в изобарном процессе в интервале температур t=0…tн (Т=273…Тн) можно найти по
- 22. Парообразование Изобарно-изотермическое парообразование происходит в точке «b», при этом теплота, затраченная на преобразование 1 кг воды
- 23. Энтальпия и энтропия воды и пара В изобарном процессе r=h”-h’; значения энтальпий сухого насыщенного пара h”
- 24. Влажный пар Удельный объем влажного пара находится как для смеси воды и сухого насыщенного пара, м3/кг:
- 25. Перегрев пара Теплота перегрева пара до температуры Т, Дж/кг: , (13) где срп – средняя теплоемкость
- 26. Энтропия перегретого пара Изменение энтропии при перегреве пара, Дж/(кг·К): , (16) откуда энтропия перегретого пара: .
- 27. К Ts-диаграмме Начало отсчета параметров состояния: внутренней энергии u0=0; энтальпии h0=0; и энтропии s0=0 принимаем при
- 28. Ts-диаграмма водяного пара В тепловой Ts-диаграмме площади под процессами: аb – теплота нагрева воды от 0
- 29. hs-диаграмма водяного пара При температуре 0 °С h0=0, s0=0. Поэтому точка а для воды нулевой температуры
- 30. Расчеты процессов водяного пара В практических расчетах обычно используются области перегретого пара и влажного с высокими
- 31. Таблицы термодинамических свойств воды и водяного пара Бывают таблицы термодинамических свойств воды на линии насыщения и
- 32. Внутренняя энергия В таблицах и диаграммах нет внутренней энергии воды и пара. Она находится через энтальпию,
- 33. Влажный пар Параметры состояния влажного пара находятся по смесевым формулам: vx=v’(1-x)+v”x; hx=h’(1-x)+h”x; sx=s’(1-x)+s”x. Теплоносители и их
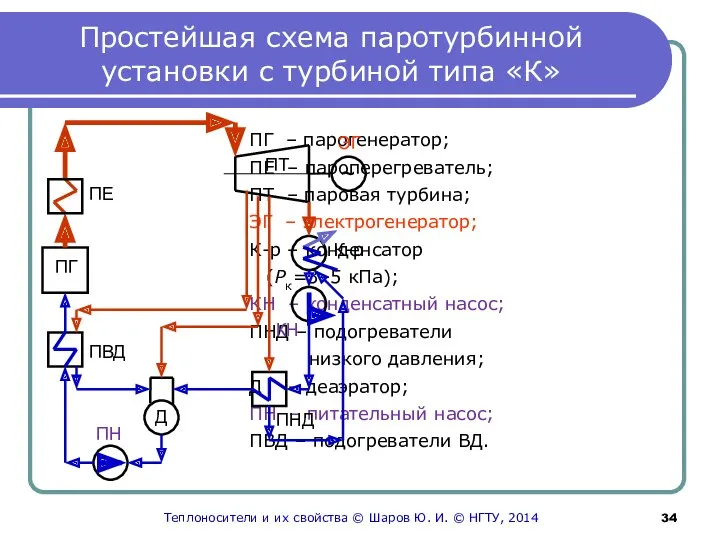
- 34. Простейшая схема паротурбинной установки с турбиной типа «К» ПГ – парогенератор; ПЕ – пароперегреватель; ПТ –
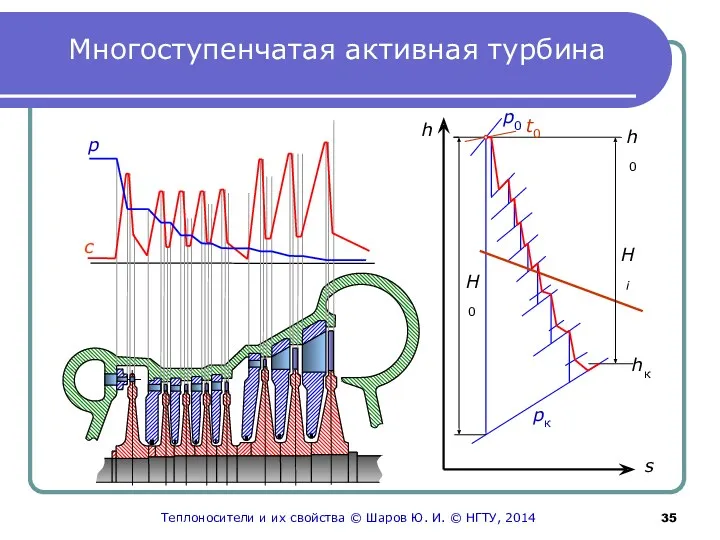
- 35. Многоступенчатая активная турбина p с s t0 Теплоносители и их свойства © Шаров Ю. И. ©
- 37. Скачать презентацию






























 Законы Кирхгофа
Законы Кирхгофа Электродинамика, обобщение темы
Электродинамика, обобщение темы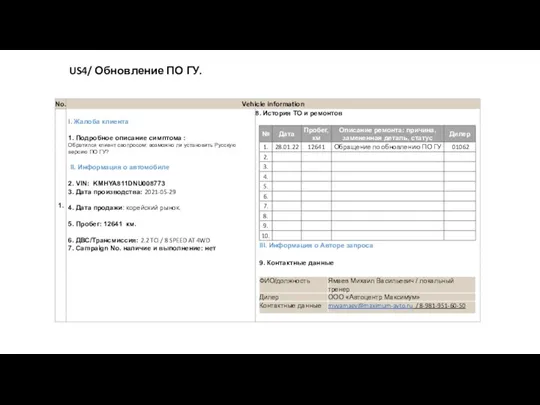 US4/ Обновление ПО ГУ
US4/ Обновление ПО ГУ Плавание тел. Урок в физики в 7 классе с применением когнитивной технологии
Плавание тел. Урок в физики в 7 классе с применением когнитивной технологии Численный расчёт температурных полей на поверхности макета моноблока дивертора ИТЭР при высоких тепловых нагрузках
Численный расчёт температурных полей на поверхности макета моноблока дивертора ИТЭР при высоких тепловых нагрузках Подшипники качения
Подшипники качения Элементы трансмиссии в автомобилях
Элементы трансмиссии в автомобилях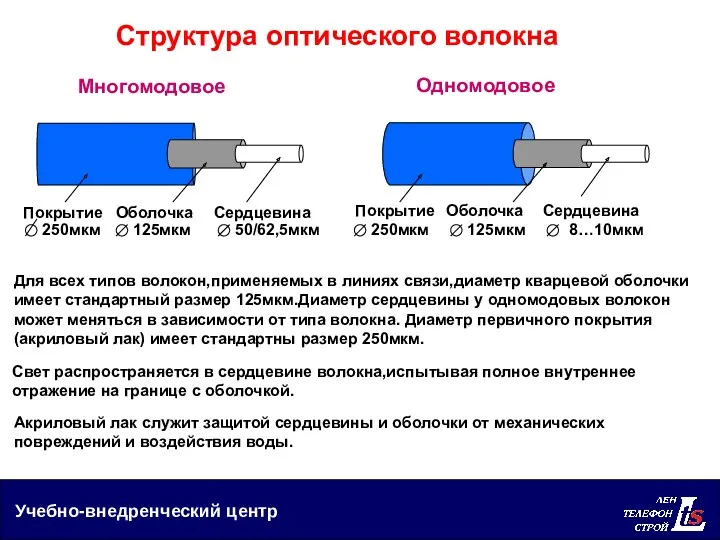 Структура оптического волокна
Структура оптического волокна Електрика: промислова, статична і атмосферна
Електрика: промислова, статична і атмосферна Презентация по Физики 7 класс На тему Механическая работа и мощность.
Презентация по Физики 7 класс На тему Механическая работа и мощность. Магнитные свойства аморфных микропроводов с положительной магнитострикцией
Магнитные свойства аморфных микропроводов с положительной магнитострикцией Требования к элементам дороги в продольном и поперечном профилях. Нормирование продольных уклонов
Требования к элементам дороги в продольном и поперечном профилях. Нормирование продольных уклонов Холодильні машини
Холодильні машини Сила. Явление тяготения. Сила тяжести
Сила. Явление тяготения. Сила тяжести Айналмалы бірқалыпты қозғалыс
Айналмалы бірқалыпты қозғалыс Тепловозные дизели
Тепловозные дизели Швидкість руху тіла
Швидкість руху тіла Схемы электрических соединений на стороне 6-10 кВ. (Лекция 12)
Схемы электрических соединений на стороне 6-10 кВ. (Лекция 12)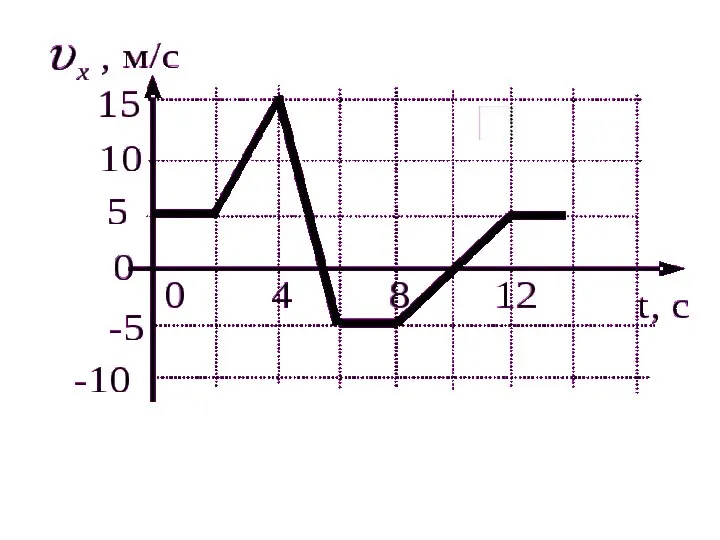 Сложение скоростей
Сложение скоростей Геометрическая оптика. Законы распространения света
Геометрическая оптика. Законы распространения света Експлуатація навчального вертольота. Експлуатація трансмісії
Експлуатація навчального вертольота. Експлуатація трансмісії Тема урока. Индукция магнитного поля.8 класс
Тема урока. Индукция магнитного поля.8 класс Конспект урока. Сила упругости. Закон Гука
Конспект урока. Сила упругости. Закон Гука Ядерная и термоядерная энергетика
Ядерная и термоядерная энергетика Поляризация света
Поляризация света презентация Векторы.Действия над векторами.Проекция вектора
презентация Векторы.Действия над векторами.Проекция вектора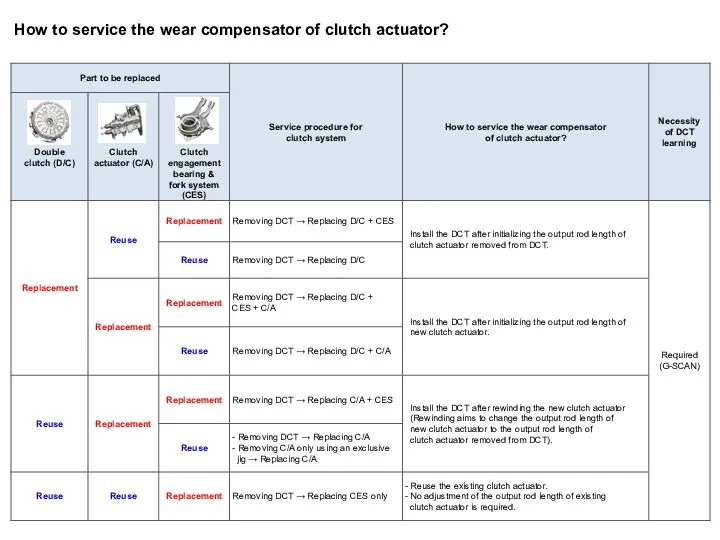 How to service the wear compensator of clutch actuator
How to service the wear compensator of clutch actuator Изменение энергии нейтронов при рассеянии. Замедляющая способность вещества
Изменение энергии нейтронов при рассеянии. Замедляющая способность вещества