Содержание
- 2. Эрвин Шредингер австрийский физик - теоретик
- 3. Электрон в кулоновском поле ядра (водородоподобный атом) Протон закреплен в центре атома и движение электрона можно
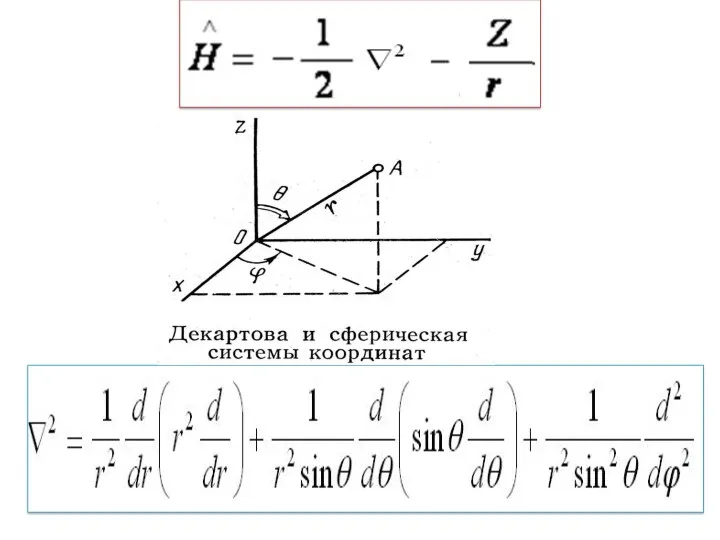
- 4. Операторы T и U Кинетическая энергия. Приближение Борна – Оппенгеймера Т = Σ Ti = Te
- 5. Атомные единицы Переход к единицам СИ - * 1/4πε0 : квант действия: = 1 масса
- 7. Алгоритм решения
- 8. Для простоты вывода Ψ = R*Θ*Φ. 1/r2*∂ /∂r*(r2∂R/∂r) ΘΦ + + 1/(r2sinϑ)*∂/∂ϑ( sinϑ*∂Θ/∂ϑ)*RΦ + +1/(r2sin2ϑ)*∂2Φ/∂ϕ2)*RΘ +
- 9. Алгоритм решения /∂r*(r2∂ R/∂r)/R + r2*(2 /r + 2E) =l(l+1) Первое уравнение /∂r*(r2∂ R /∂r)/R +
- 10. Алгоритм решения Второе уравнение 1/(sinϑ)*∂/∂ϑ( sinϑ*∂Θ/∂ϑ)/Θ - 1/(sin2ϑ)*∂2Φ/∂ϕ2)/Φ = l(l+1) Домножим на sin2ϑ и снова разделим
- 11. Алгоритм решения Получим окончательно три уравнения 1/(sin2ϑ)*∂2Φ/∂ϕ2)/Φ = m2; /∂r*(r2∂ R/∂r)/R +r2*(2 /r + 2E) =l(l+1)
- 12. Результат решения Ф(ϕ) = f(m) ≡ Фm(ϕ) Θ(ϑ) = f(l,m) ≡ Θl,m(ϑ) Y(ϑ, ϕ) =Θl,m(ϑ) *Фm(ϕ)
- 13. Окончательное решение ψ(r, ϑ, ϕ) = Rn,l(r)* Yl,m(ϑ, ϕ)=f(n,l,m) Энергия электрона в атоме водорода Волновая функция
- 14. Физический смысл квантовых чисел Главное квантовое число (n) – описывает наиболее вероятное расстояние от ядра до
- 15. Физический смысл квантовых чисел Побочное или азимутальное квантовое число (l). Меняется от l = 0,1,..(n-1) В
- 16. Атомная орбиталь Одноцентровая волновая функция описывающая состояние электрона в атоме и зависящая от трех квантовых чисел
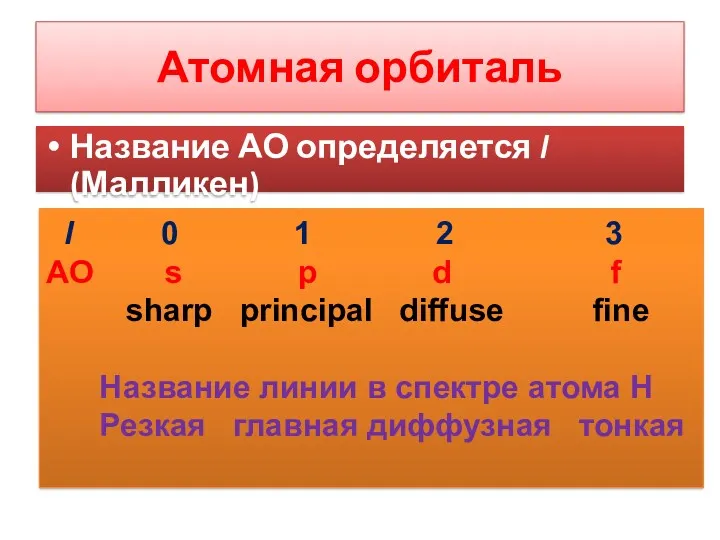
- 17. Название АО определяется l (Малликен) Атомная орбиталь l 0 1 2 3 АО s p d
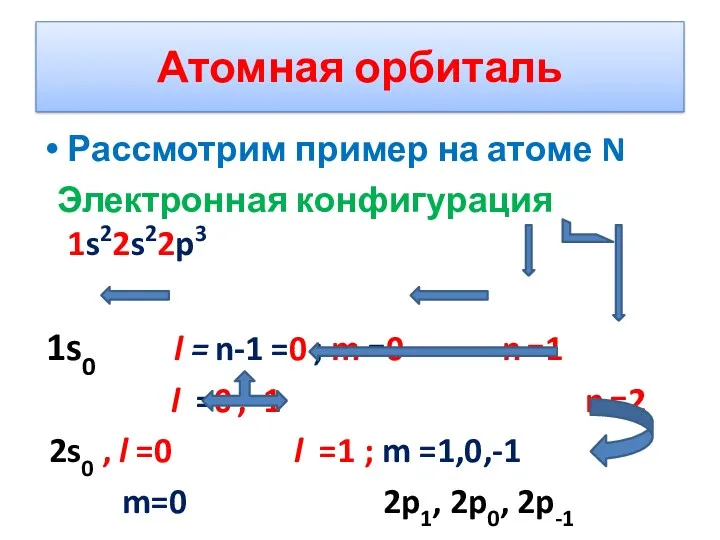
- 18. Атомная орбиталь Рассмотрим пример на атоме N Электронная конфигурация 1s22s22p3 1s0 l = n-1 =0 ;
- 19. Способы представления АО. 1. Трехмерное представление или Граничные поверхности (90-95 % электронной плотности) 2. Контурные диаграммы.
- 20. Способы представления АО. 3. Для удобства изображения приводят сечение этих орбиталей в плоскости, проходящих через ядро.
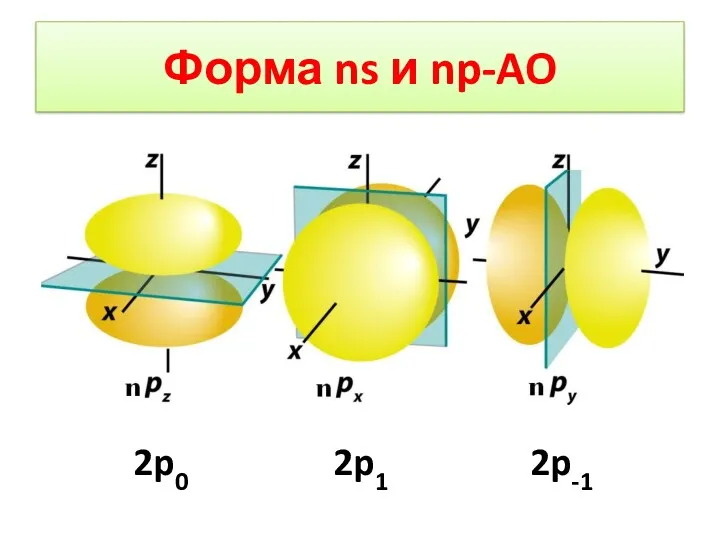
- 21. Форма ns и np-AO 2p0 2p1 2p-1
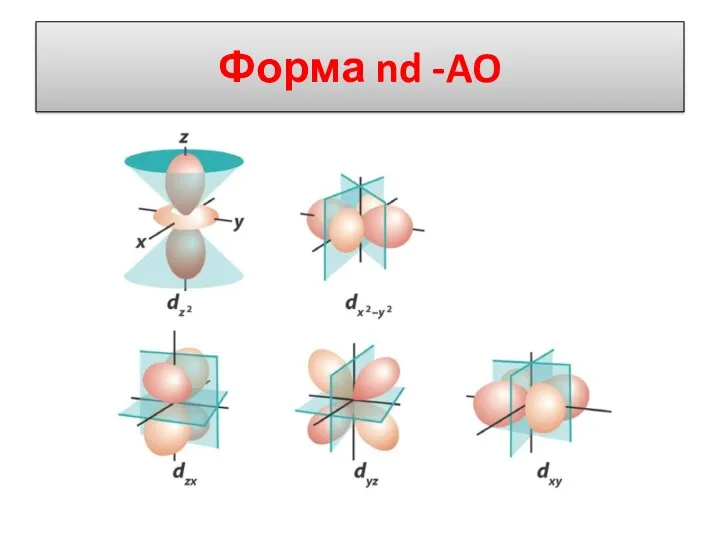
- 22. Форма nd -AO
- 23. Анализ угловой части ψ Функцию Yl,m(ϑ,ϕ) = Θl,m(ϑ)Φm(ϕ) – называют угловой частью волновой функции. В этом
- 24. Вывод Угловая часть волновой функции не зависит от типа атома, а зависит только от значений квантовых
- 25. Типовая задача Атом водорода в квантовой механике. Этапы решения уравнения Шредингера для атома водорода. Волновая функция
- 26. Радиальная часть волновой функции Полином Лягера
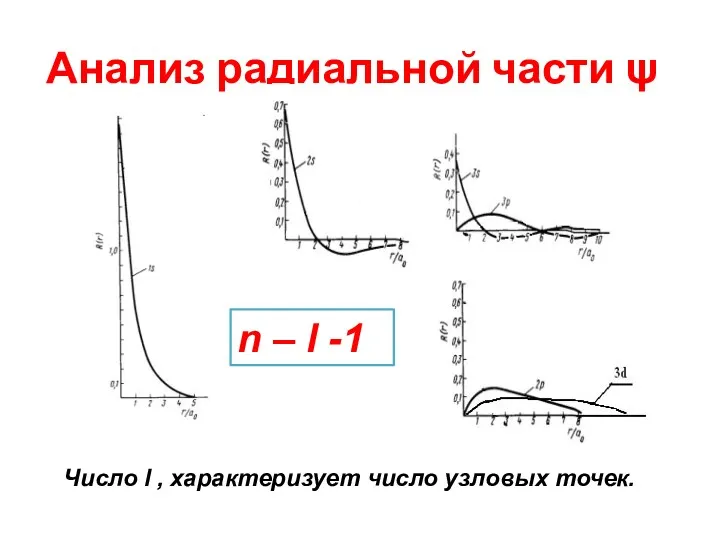
- 27. Анализ радиальной части ψ Число l , характеризует число узловых точек. n – l -1
- 28. Анализ радиальной части ψ ρ = Zr/a0 n l m 1 0 0 Ψ(1s0) = 1/√π
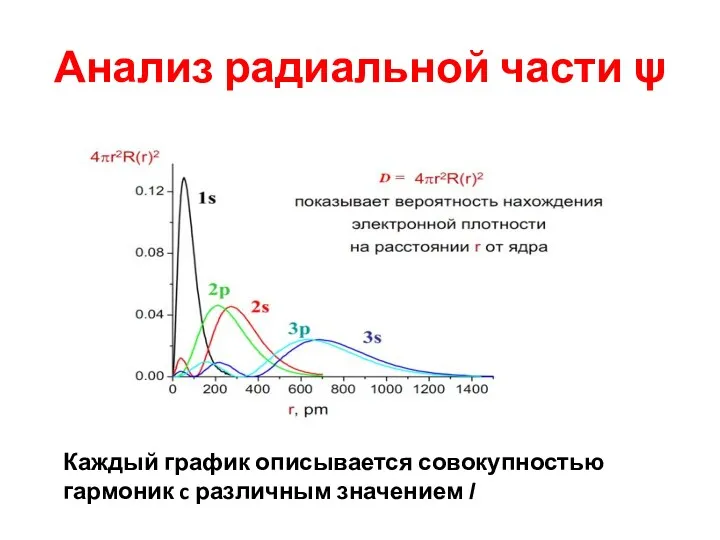
- 29. Анализ радиальной части ψ Каждый график описывается совокупностью гармоник c различным значением l
- 30. Вывод Радиальная часть волновой функции является индивидуальной характеристикой каждого атома и распределение электронной плотности реализуется совокупностью
- 32. Скачать презентацию






















 Электронное пособие к обобщающему уроку физики в 8 классе по теме Магнитное поле.
Электронное пособие к обобщающему уроку физики в 8 классе по теме Магнитное поле. Презентация к уроку в 8 классе по теме ТЕПЛОВЫЕ ДВИГАТЕЛИ
Презентация к уроку в 8 классе по теме ТЕПЛОВЫЕ ДВИГАТЕЛИ Разработка модели сборки Пневмоцилиндра
Разработка модели сборки Пневмоцилиндра Жидкостная система охлаждения. Урок № 32
Жидкостная система охлаждения. Урок № 32 Управление нефтегазовыми технологическими процессами
Управление нефтегазовыми технологическими процессами Технологическое проектирование участка агрегатного ремонта в условиях ГАПОУ СО КМТ
Технологическое проектирование участка агрегатного ремонта в условиях ГАПОУ СО КМТ Реактивное движение
Реактивное движение Устройство увеличительных приборов и правила работы с ними
Устройство увеличительных приборов и правила работы с ними Пневмотранспорт, виды и применение. Достоинства и недостатки. Тема 14
Пневмотранспорт, виды и применение. Достоинства и недостатки. Тема 14 Взаимодействие быстрых электронов с веществом (часть 1)
Взаимодействие быстрых электронов с веществом (часть 1) КПД теплового двигателя
КПД теплового двигателя Спектры и спектральные аппараты
Спектры и спектральные аппараты Гидравлический подъемник. Выбор насоса
Гидравлический подъемник. Выбор насоса Физическое явление: электромагнитная индукция
Физическое явление: электромагнитная индукция Презентация к уроку Естественная радиоактивность
Презентация к уроку Естественная радиоактивность Колебания. Колебательные движения
Колебания. Колебательные движения Ремонт и обслуживание торгового оборудования
Ремонт и обслуживание торгового оборудования Регуляторы швейной машины
Регуляторы швейной машины Сұйықтық және газ механикасы пәні. Негізгі мәселелер мен болжаулар
Сұйықтық және газ механикасы пәні. Негізгі мәселелер мен болжаулар Презентация Технологическая карта урока
Презентация Технологическая карта урока Полное внутреннее отражение
Полное внутреннее отражение Опиливание металла. Размерная слесарная обработка
Опиливание металла. Размерная слесарная обработка Перспективы развития и использования электроэнергетики в современном мире
Перспективы развития и использования электроэнергетики в современном мире Расчет статически неопределимых балок на изгиб
Расчет статически неопределимых балок на изгиб Внеклассное мероприятие по физике Физика руками
Внеклассное мероприятие по физике Физика руками Оптические методы и приборы контроля качества продукции
Оптические методы и приборы контроля качества продукции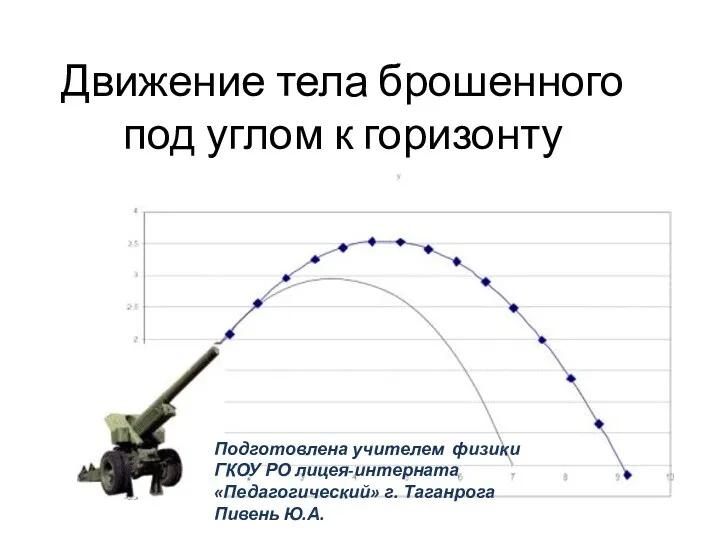 Презентация по физике 10 класс Уравнение движения тела брошенного под углом к горизонту
Презентация по физике 10 класс Уравнение движения тела брошенного под углом к горизонту Прямозуба зубчаста передача
Прямозуба зубчаста передача