Содержание
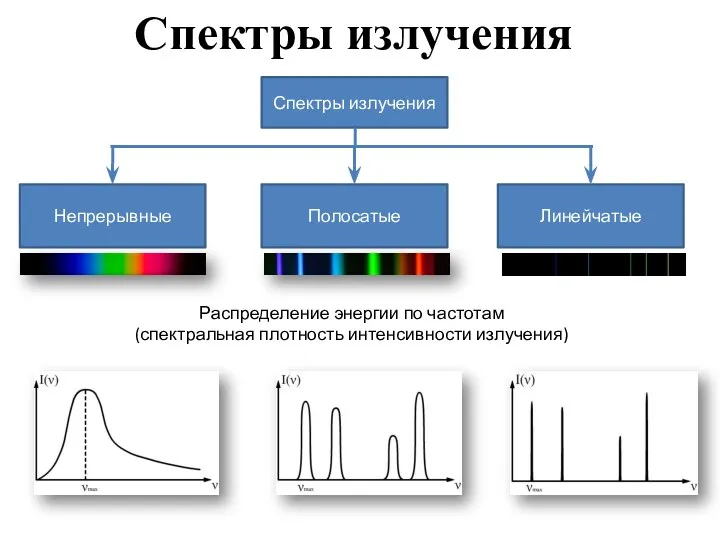
- 2. Спектры излучения Распределение энергии по частотам (спектральная плотность интенсивности излучения)
- 3. Непрерывный спектр Дают тела, находящиеся в твердом, жидком состоянии, а также плотные газы. Чтобы получить, надо
- 4. Линейчатый спектр Дают все вещества в газообразном атомарном (но не молекулярном) состоянии (атомы практически не взаимодействуют
- 5. Полосатый спектр Спектр состоит из отдельных полос, разделенных темными промежутками. Каждая полоса представляет собой совокупность большого
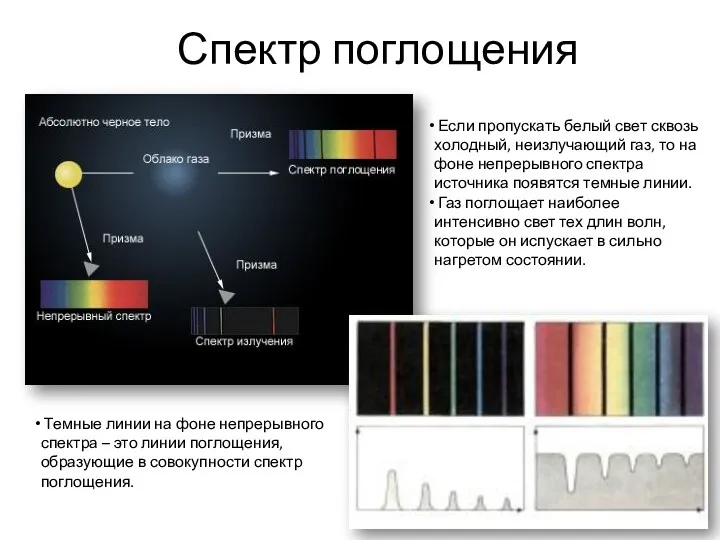
- 6. Спектр поглощения Темные линии на фоне непрерывного спектра – это линии поглощения, образующие в совокупности спектр
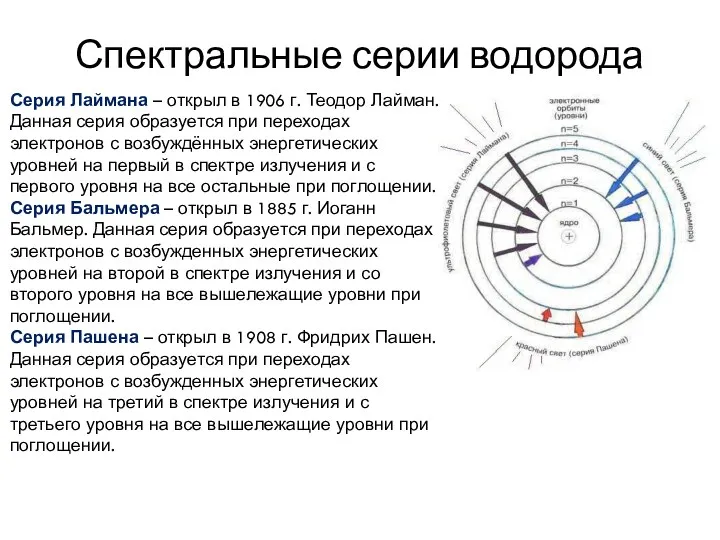
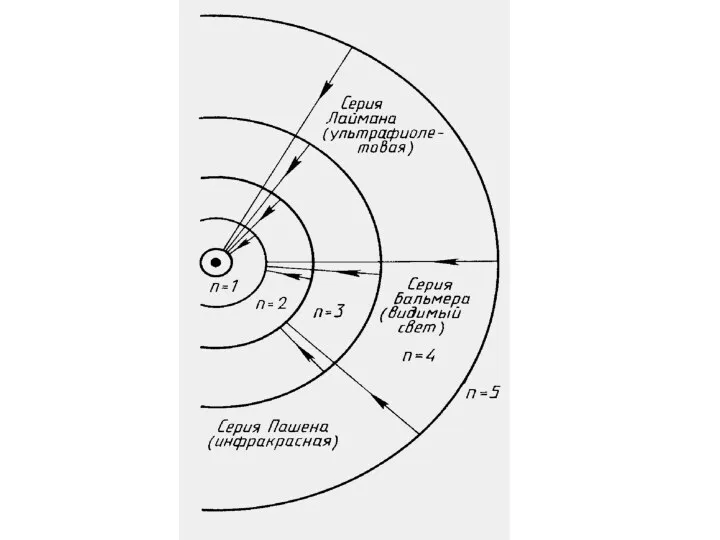
- 7. Спектральные серии водорода Серия Лаймана – открыл в 1906 г. Теодор Лайман. Данная серия образуется при
- 8. Строение атома Из истории: Демокрит: существует предел деления атома. Аристотель: делимость вещества бесконечна. Париж, 1626 г.:
- 9. Толчком к подробному изучению строения атома послужили: открытие рентгеновского излучения (1895 г., В.К. Рентген); открытие радиоактивности
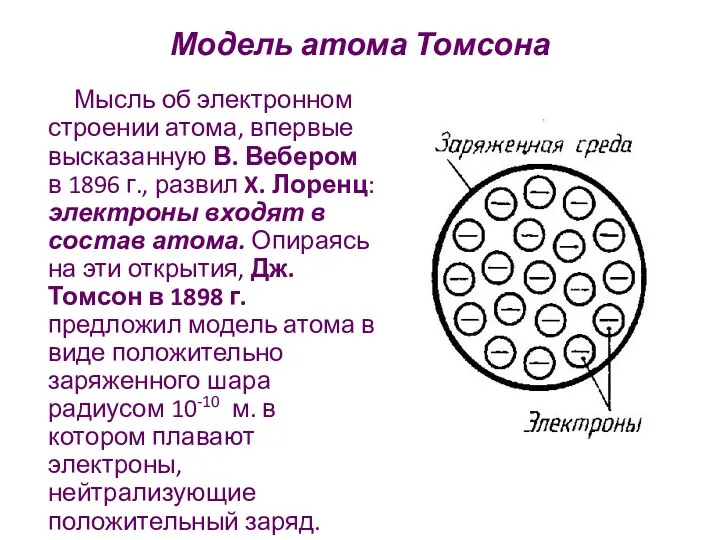
- 10. Модель атома Томсона Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил
- 11. Ядерная модель атома Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом.
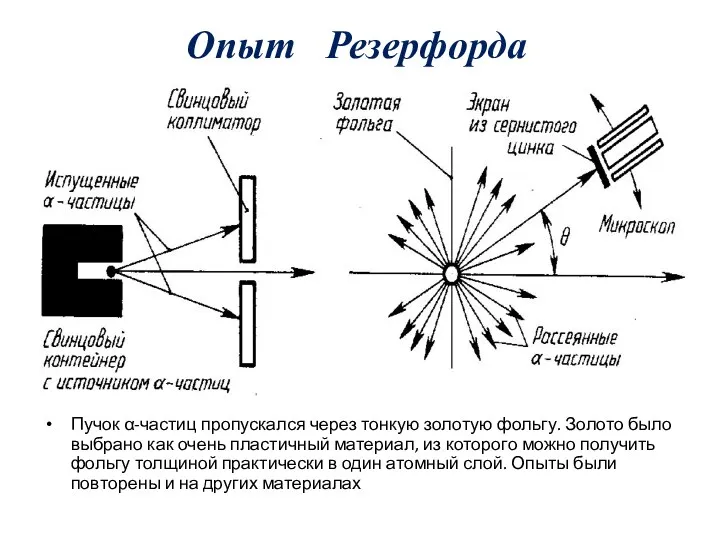
- 12. Опыт Резерфорда Пучок α-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал,
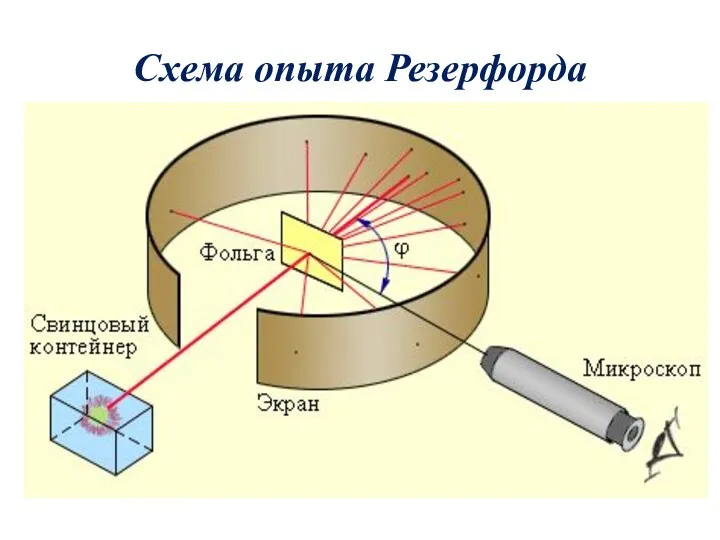
- 13. Схема опыта Резерфорда
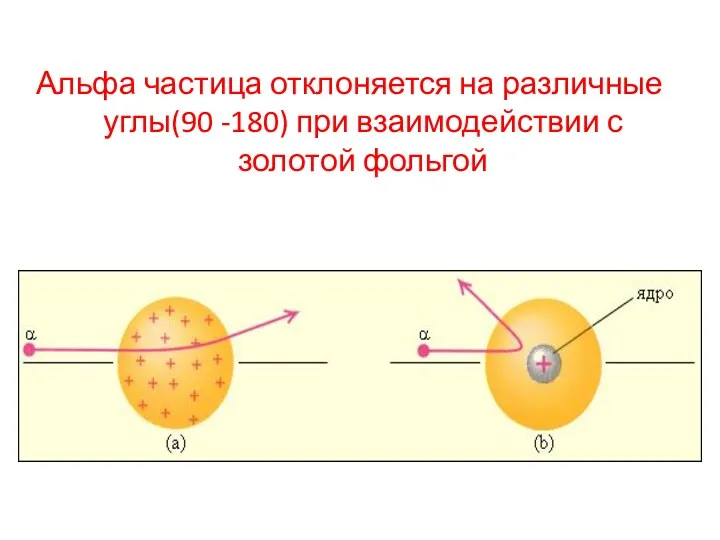
- 14. Альфа частица отклоняется на различные углы(90 -180) при взаимодействии с золотой фольгой
- 15. Выводы из опыта Резерфорда Э. Резерфорд и его помощники обнаружили, что какая-то часть α-частиц отклоняется на
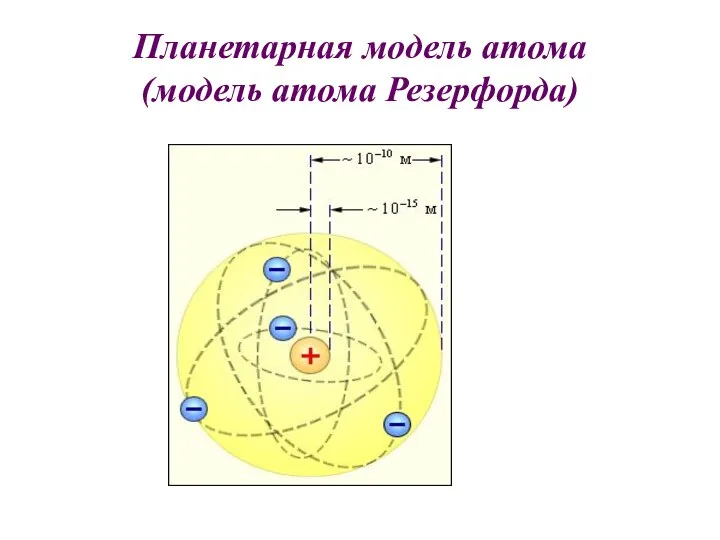
- 16. Планетарная модель атома (модель атома Резерфорда)
- 17. Недостатки планетарной модели Предложенная модель строения атома не позволила объяснить устойчивость атома: ускоренное движение электрона согласно
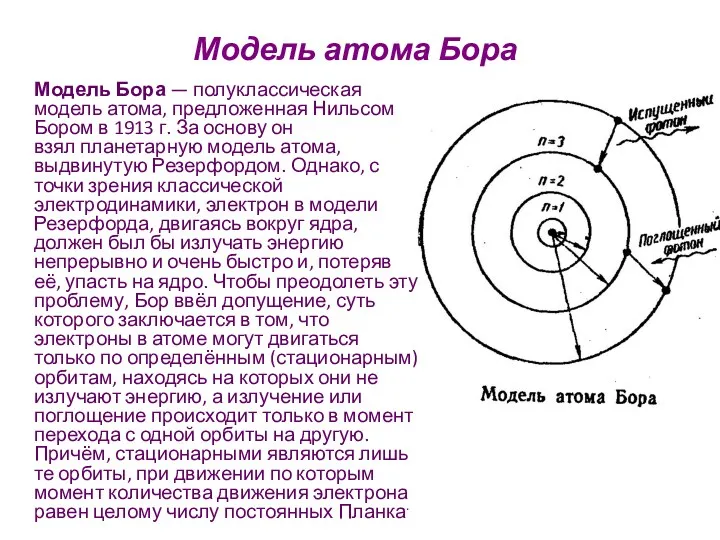
- 18. Модель атома Бора Модель Бора — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За
- 20. Модель атома водорода по Бору Бор рассматривал простейшие круговые орбиты. - потенциальная энергия взаимодействия электрона с
- 22. ПОСТУЛАТЫ БОРА 1. Атомная система может находиться только в особых стационарных квантовых состояниях, каждому из которых
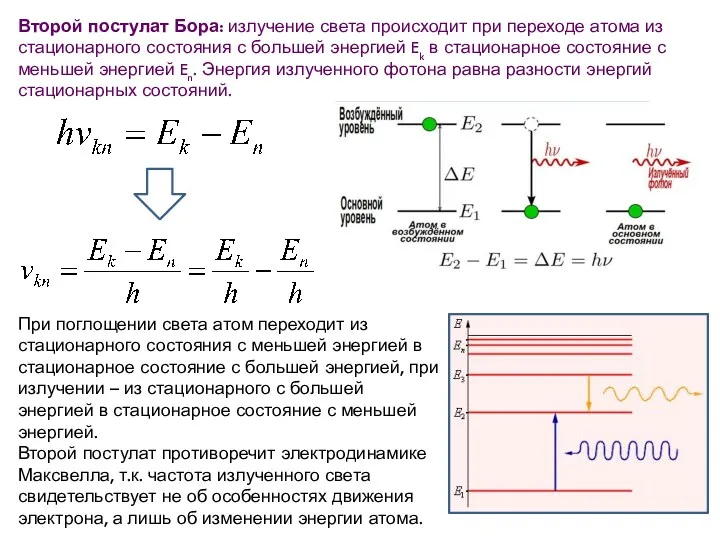
- 24. Второй постулат Бора: излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek
- 25. Правило квантования Из первого постулата Бора энергия может принимать только определенное значение En. Электрон движется по
- 26. Правило квантования орбит: Электроны могут двигаться в атоме только по определённым орбитам, которые определяются условием: где
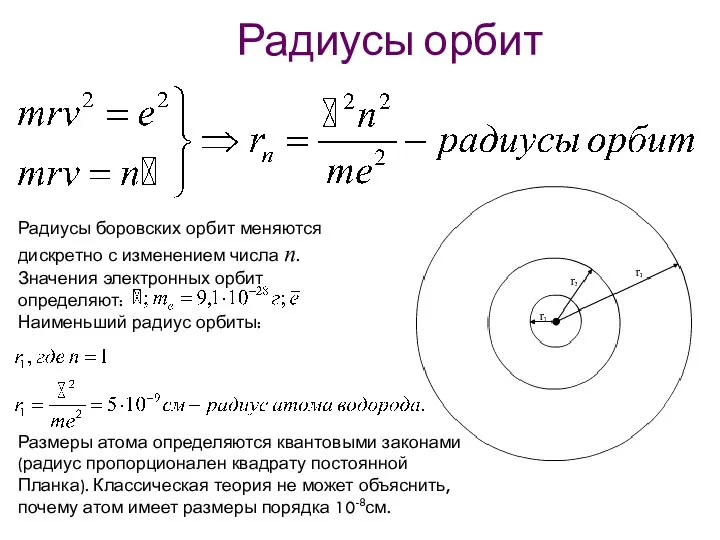
- 27. Радиусы орбит Радиусы боровских орбит меняются дискретно с изменением числа n. Значения электронных орбит определяют: Наименьший
- 28. Квантованные значения радиусов орбит:
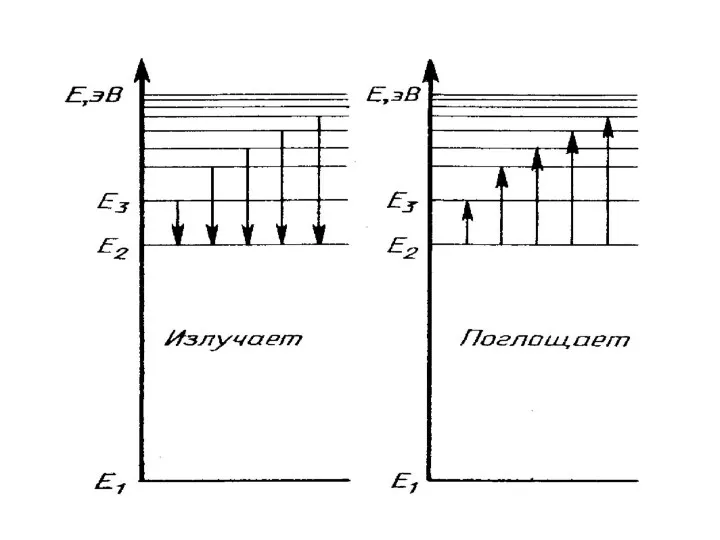
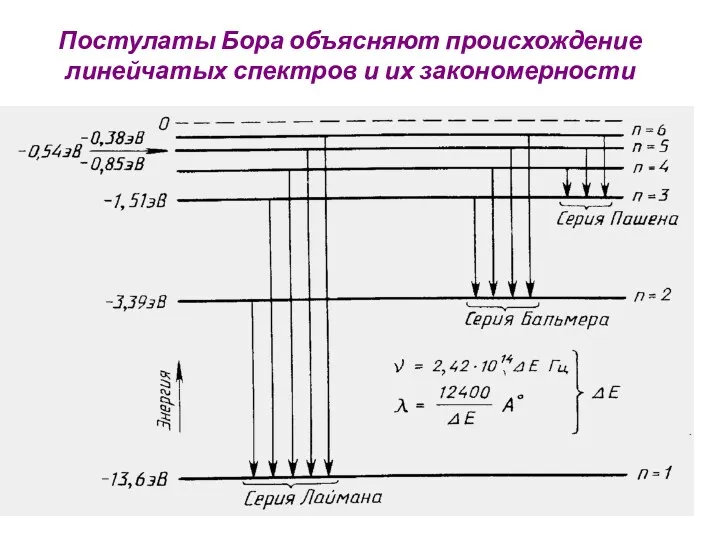
- 29. Постулаты Бора объясняют происхождение линейчатых спектров и их закономерности
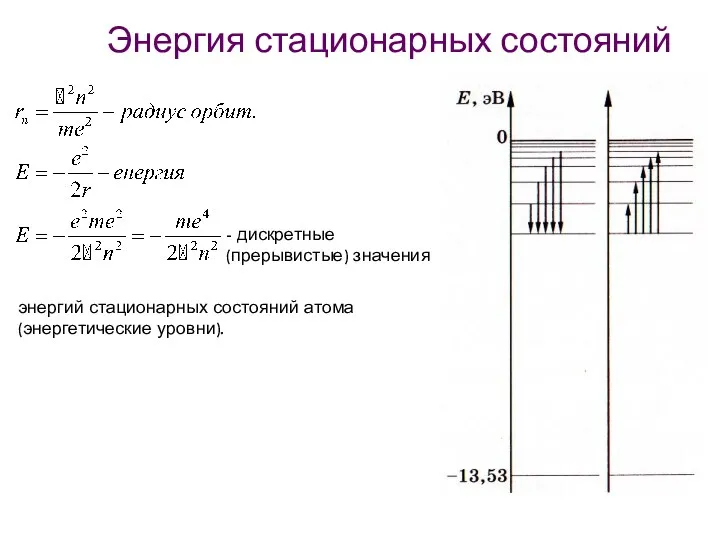
- 31. Энергия стационарных состояний - дискретные (прерывистые) значения энергий стационарных состояний атома (энергетические уровни).
- 32. Низшее энергетическое состояние Атом может находится сколь угодно долго. Чтобы ионизировать атом водорода, ему нужно сообщить
- 33. Излучение света Возможные частоты излучения атома водорода: где - постоянная Ридберга R = 109737,316 см-1. Теория
- 34. По второму постулату Бора возможные частоты излучения водорода равны: где R – постоянная Ридберга, равна 3,2*1015
- 35. П = 3, 4, 5 и т.д., R= 3,2*1015 Гц Видимый свет И. Бальмер (1885г.)
- 36. Ультрафиолетовая серия Т. Лайман п= 2, 3, 4, 5 и т.д.
- 37. Инфракрасная серия Ф. Пашен п= 4, 5 и т.д.
- 39. Скачать презентацию










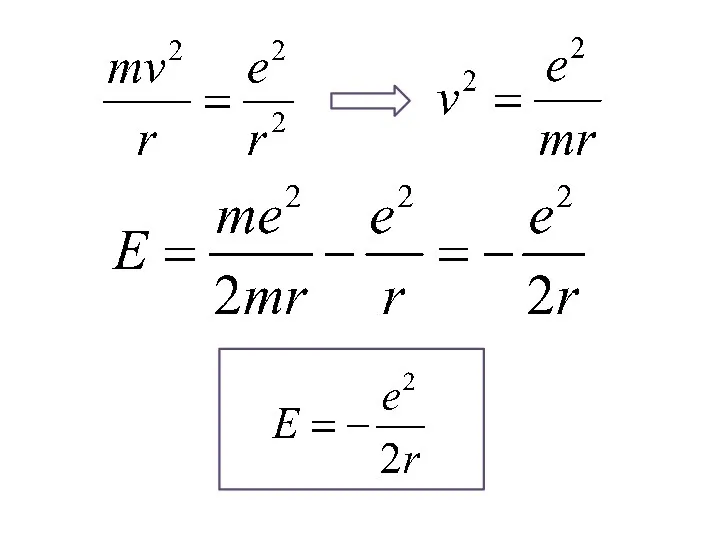










 Электрооборудование автомобилей. Сигнальное оборудование. (Урок 8)
Электрооборудование автомобилей. Сигнальное оборудование. (Урок 8) Система учета расхода природного газа на основе волоконно-оптических датчиков
Система учета расхода природного газа на основе волоконно-оптических датчиков Механические колебания. Гармонические колебания. Дифференциальное уравнение гармонических колебаний материальной точки
Механические колебания. Гармонические колебания. Дифференциальное уравнение гармонических колебаний материальной точки Навье-Стокс теңдеулерінің шешімдері
Навье-Стокс теңдеулерінің шешімдері Техническая термодинамика. Теплопроводность при стационарном режиме. (Лекция 9)
Техническая термодинамика. Теплопроводность при стационарном режиме. (Лекция 9) Виды газовых разрядов и их применение
Виды газовых разрядов и их применение Модернизация электропривода швейной машины челночной строчки
Модернизация электропривода швейной машины челночной строчки Механизация и автоматизация в строительстве. (Тема 1.1)
Механизация и автоматизация в строительстве. (Тема 1.1) Презентация урока Теплота сгорания топлива. Удельная теплота сгорания 8 класс.
Презентация урока Теплота сгорания топлива. Удельная теплота сгорания 8 класс. Магнитостатическое поле в веществе
Магнитостатическое поле в веществе Перемещение при прямолинейном равномерном движении
Перемещение при прямолинейном равномерном движении КРИСТАЛЛИЧЕСКИЕ ТЕЛА
КРИСТАЛЛИЧЕСКИЕ ТЕЛА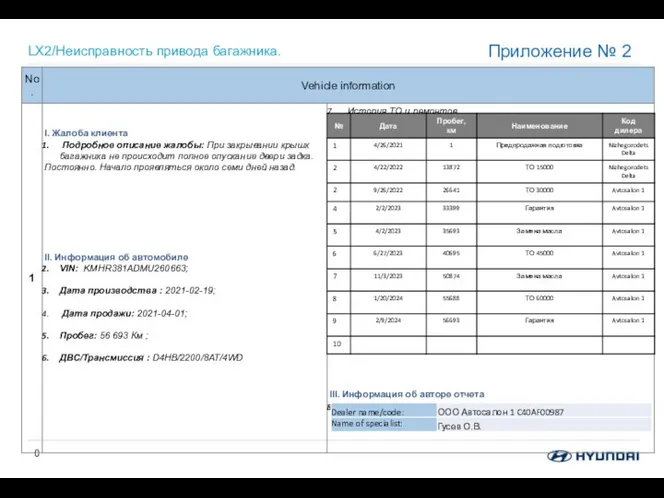 XWER381ADM0000903
XWER381ADM0000903 Справочник автослесаря
Справочник автослесаря Давление. Атмосфернео давление. Закон паскаля. Закон архимеда
Давление. Атмосфернео давление. Закон паскаля. Закон архимеда Электромагнитные излучения радиочастот
Электромагнитные излучения радиочастот Нелинейные электрические цепи постоянного тока
Нелинейные электрические цепи постоянного тока Нефть, газ, их состав и физические свойства. Основные гипотезы происхождения нефти и газа
Нефть, газ, их состав и физические свойства. Основные гипотезы происхождения нефти и газа Презентация Созвездия
Презентация Созвездия Диэлектрики и проводники в электрическом поле
Диэлектрики и проводники в электрическом поле Основы термодинамики. Первое начало термодинамики. Работа газа при изменении объема. Теплоемкость идеального газа
Основы термодинамики. Первое начало термодинамики. Работа газа при изменении объема. Теплоемкость идеального газа Материалдардың құрылымы,құрамы,қасиеттері және пайдалануы
Материалдардың құрылымы,құрамы,қасиеттері және пайдалануы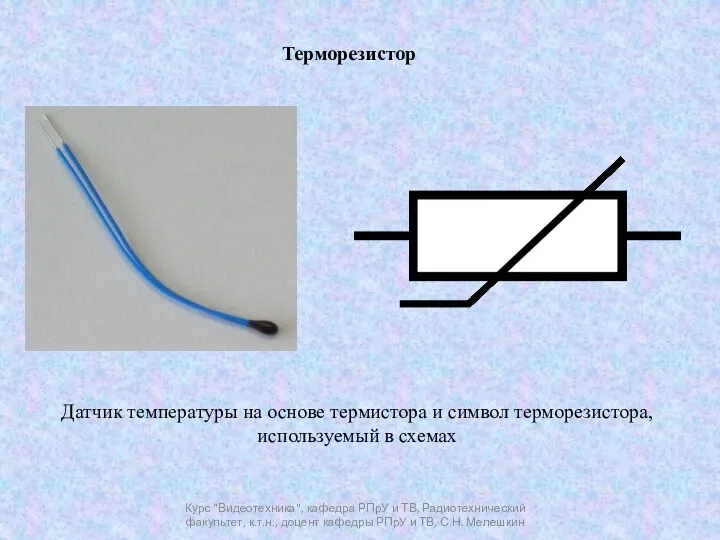 Терморезистор
Терморезистор Динамика. Лекция 1-2
Динамика. Лекция 1-2 Опиливание металла
Опиливание металла Механика жидкости
Механика жидкости R,C,L в цепи переменного тока
R,C,L в цепи переменного тока Внутренняя энергия. Работа. 1 начало термодинамики
Внутренняя энергия. Работа. 1 начало термодинамики