Содержание
- 2. Тема занятия: Строение атома: планетарная модель и модель Бора. Испускание и поглощение света атомом. 2
- 3. Цель занятия: Образовательная: познакомить учащихся с планетарной моделью атома; изучить постулаты Бора , раскрывающие основные свойства
- 4. Воспитательная: воспитывать стремление учащихся демонстрировать собственные достижения, объективно оценивать свои умения применять знания; формирование активности и
- 5. План урока: Организационно-мотивационная часть (5 мин.) Объяснение нового материала. (30 минут) Проверка первичного понимания учащимися материала
- 6. Изучение нового материала Строение атома: планетарная модель. 6
- 7. Первая попытка создания модели атома на основе накопленных экспериментальных данных была предложена английским физиком Дж. Томсоном,
- 8. Простейший атом водорода представляет собой заряженный шар радиусом 10-8 см, внутри которого находится электрон. У более
- 9. Окончательный выбор между гипотезами вправе сделать только опыт. Такой опыт поставил в 1909 году Эрнест Резерфорд.
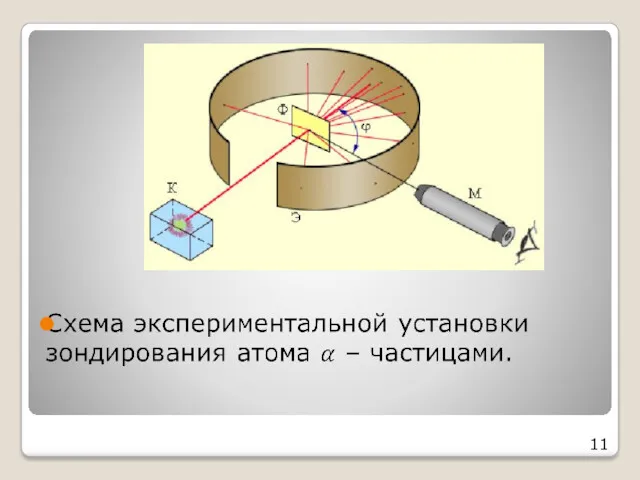
- 10. Опыт Резерфорда (1906 г.) Резерфорд «бомбардировал» α-частицами золотую фольгу и наблюдал за свечением экрана При попадании
- 11. 11
- 12. Наблюдения из опыта: большинство α - частиц пролетает сквозь фольгу не отклоняясь небольшое кол-во α -
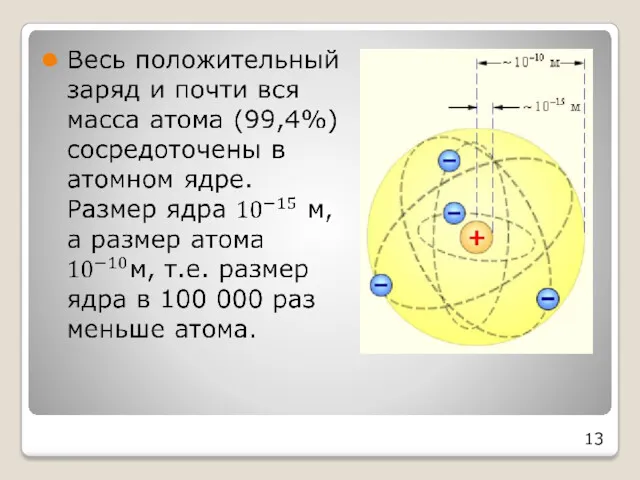
- 13. 13
- 14. Созданная Резерфордом планетарная модель проста, но не позволяет объяснить устойчивость атома. Предложенная Резерфордом модель строения атома
- 15. Изучение нового материала Испускание и поглощение света атомом. Модель атома водорода по Бору. 15
- 16. Выход из этого затруднительного положения был предложен в 1913 великим физиком Нильсом Бором. 16
- 17. Квантовые постулаты Бора. Первый постулат – постулат стационарных состояний. 1. Существуют такие стационарные состояния атома, находясь
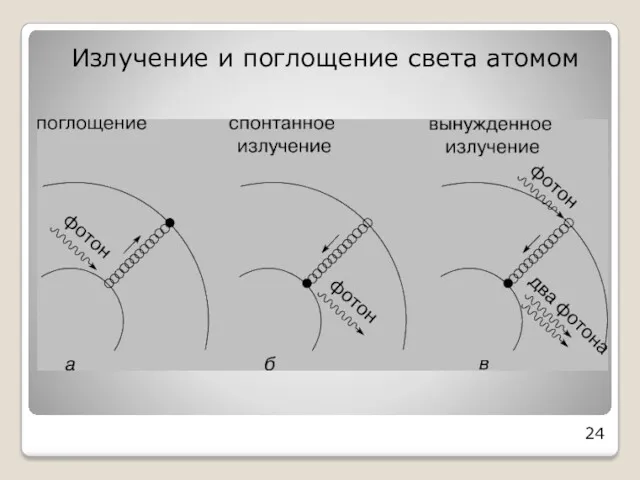
- 18. Излучение атома происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с
- 19. Атом поглощает фотон, когда переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей
- 20. 20
- 21. Свои постулаты Бор применил для построения теории строения простейшего атома (атома водорода) 21
- 22. Согласно этой теории Бор смог вычислить для атома водорода: - возможные радиусы орбит электрона и размеры
- 23. Распределение энергетических уровней при излучении и поглощении атомом водорода электромагнитных волн 23
- 24. Излучение и поглощение света атомом 24
- 25. 25
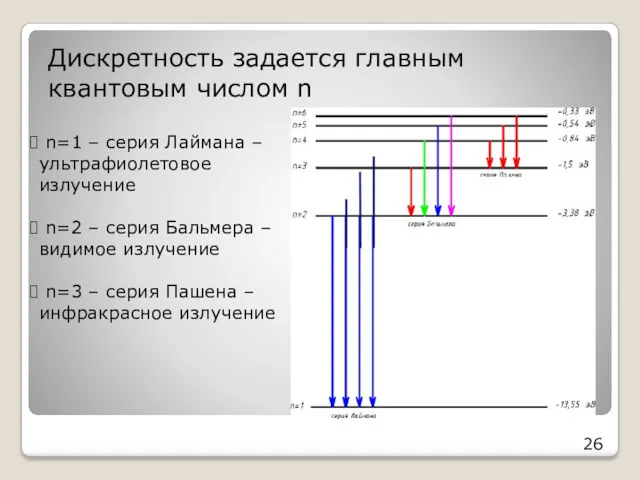
- 26. Дискретность задается главным квантовым числом n 26 n=1 – серия Лаймана – ультрафиолетовое излучение n=2 –
- 27. 27
- 28. Движение электрона в атоме мало похоже на движение планет по орбитам. Точнее, электрон на орбите можно
- 29. Энергия в атомной физике измеряется в электронвольтах. 1эВ – это энергия электрона, проходящего разность потенциалов в
- 30. ГРУППОВАЯ РЕФЛЕКСИЯ – по кругу высказываемся одним предложением, используя начало фразы из рефлексивного экрана: сегодня я
- 32. Скачать презентацию

























 Принцип работы тепловых машин
Принцип работы тепловых машин Архимедова сила
Архимедова сила Магнитное поле и причины его возникновения
Магнитное поле и причины его возникновения Скорость. Единицы измерения скорости
Скорость. Единицы измерения скорости Электрооборудование автомобилей. Система зажигания. (Урок 5)
Электрооборудование автомобилей. Система зажигания. (Урок 5) Цепные передачи
Цепные передачи Испарение и конденсация. Кипение жидкости. 8 класс
Испарение и конденсация. Кипение жидкости. 8 класс Механические колебания
Механические колебания Ядерная физика
Ядерная физика Сила тяжести. Вес тела. Невесомость
Сила тяжести. Вес тела. Невесомость Технологиялық үрдісті автоматтандыру жүйесін жобалу принциптері
Технологиялық үрдісті автоматтандыру жүйесін жобалу принциптері Наблюдение сплошного и линейчатых спектров
Наблюдение сплошного и линейчатых спектров Основные положения спектроскопии
Основные положения спектроскопии Определение плотности твердых тел и жидкостей. Лабораторная работа № 3
Определение плотности твердых тел и жидкостей. Лабораторная работа № 3 Кинематические элементы процесса точения
Кинематические элементы процесса точения Лазерное сканирование в строительстве (ЛС)
Лазерное сканирование в строительстве (ЛС) Щелочные аккумуляторы
Щелочные аккумуляторы Измерение атмосферного давления
Измерение атмосферного давления Работа. Механическая Энергия. Кинетическая и потенциальная энергии. Закон сохранения механической энергии
Работа. Механическая Энергия. Кинетическая и потенциальная энергии. Закон сохранения механической энергии Вращение звезд. (Тема 17)
Вращение звезд. (Тема 17) Кинематика периодического движения
Кинематика периодического движения Законы Ньютона
Законы Ньютона Закон Ома для участка цепи
Закон Ома для участка цепи Улаштування та технічне обслуговування кривошипно-шатунного механізму. Влаштування та ТО газорозподільного механізму (1)
Улаштування та технічне обслуговування кривошипно-шатунного механізму. Влаштування та ТО газорозподільного механізму (1) Получение вакуума
Получение вакуума Разборка и сборка тормозных колодок автобуса ЛИАЗ-5256
Разборка и сборка тормозных колодок автобуса ЛИАЗ-5256 Газовая хроматография
Газовая хроматография Выбор оборудования для участка ремонта и заряда АКБ легкового автотранспорта
Выбор оборудования для участка ремонта и заряда АКБ легкового автотранспорта