Содержание
- 2. Лекция 2 Основные положения спектроскопии
- 3. Постулаты Бора Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых
- 4. Уровни энергии и переходы между ними Диаграмма уровней энергии Каждому возможному переходу между дискретными уровнями энергии
- 5. Комбинационный принцип При переходах между уровнями i, j и уровнями k l m, …, согласно комбинационному
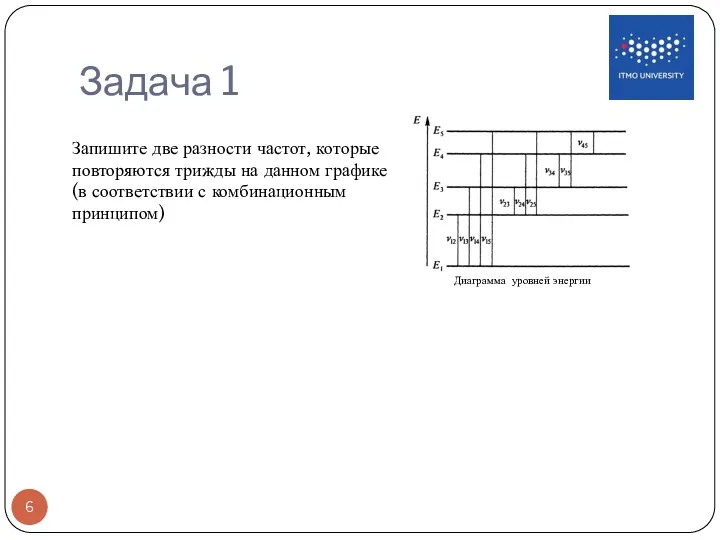
- 6. Задача 1 Диаграмма уровней энергии Запишите две разности частот, которые повторяются трижды на данном графике (в
- 7. Одноэлектронная система Изоэлектронный ряд – ряд атомов с одинаковым числом электронов Спектр атома водорода - простейший
- 8. Квантовые числа одноэлектронного атома Состояние одноэлектронного атома характеризуется (без учета магнитного взаимодействия орбитального и спинового моментов
- 9. Вырождение уровней одноэлектронного атома Заданному значению энергии может соответствовать одно, вполне определенное стационарное состояние или ряд
- 10. Зависимость спектров одноэлектронных атомов от заряда и массы ядра Постоянная Ридберга Уровни энергии и спектральные линии
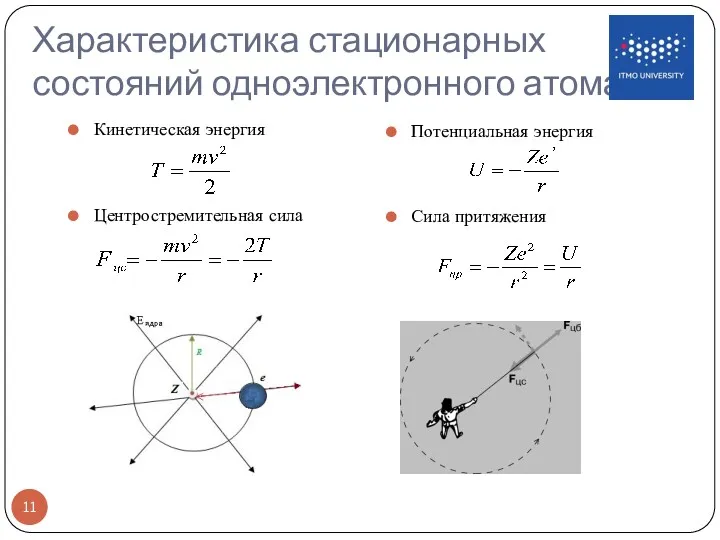
- 11. Характеристика стационарных состояний одноэлектронного атома Кинетическая энергия Потенциальная энергия Центростремительная сила Сила притяжения
- 12. Характеристика стационарных состояний одноэлектронного атома Центростремительная сила равна силе притяжения Механический момент электрона при движении по
- 13. Характеристика стационарных состояний одноэлектронного атома Полная энергия атома Условие квантования механического момента Радиус круговой орбиты эрг
- 14. Задача 2 Вычислить радиус первой боровской орбиты
- 15. Характеристика стационарных состояний одноэлектронного атома Радиус первой боровской орбиты n=1 см
- 16. Движение электрона по эллиптическим орбитам Полная характеристика системы с N степенями свободы дается заданием значений N
- 17. Движение электрона по эллиптическим орбитам Ядро атома находится в фокусе, а угол наклона орбиты определяется формулой
- 19. Скачать презентацию














 Курс Основы физики и техники ядерных реакторов. Лекция 8. Формирование импульса мощности ИБР-2
Курс Основы физики и техники ядерных реакторов. Лекция 8. Формирование импульса мощности ИБР-2 Средства технологических измерений плотности жидкостей (плотномеры)
Средства технологических измерений плотности жидкостей (плотномеры) Элементы квантовой механики
Элементы квантовой механики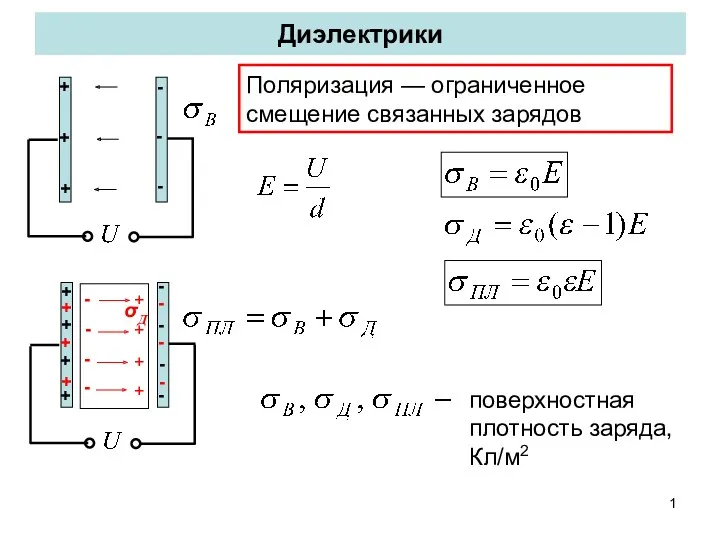 Диэлектрики
Диэлектрики Урок физики Закон Архимеда
Урок физики Закон Архимеда Энергия связи ядра и дефект масс
Энергия связи ядра и дефект масс Atomic Structure
Atomic Structure Radiation
Radiation Дослід Торрічеллі. Вимірювання тиску стовпа рідини
Дослід Торрічеллі. Вимірювання тиску стовпа рідини Лекция № 1. Ядерный топливный цикл и обращение с радиоактивными отходами. Вводная лекция по курсу
Лекция № 1. Ядерный топливный цикл и обращение с радиоактивными отходами. Вводная лекция по курсу Измерение параметров лазерного излучения
Измерение параметров лазерного излучения Современные попытки создания вечного двигателя
Современные попытки создания вечного двигателя Моторизованный микроскоп. Съемка живых клеток
Моторизованный микроскоп. Съемка живых клеток Emission spectrum of H
Emission spectrum of H Нагревание проводников электрическим током. Закон Джоуля – Ленца
Нагревание проводников электрическим током. Закон Джоуля – Ленца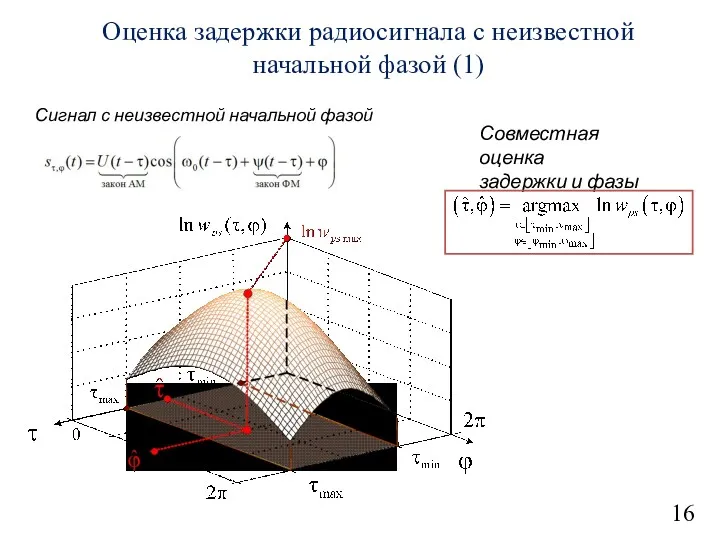 Оценка задержки радиосигнала с неизвестной начальной фазой
Оценка задержки радиосигнала с неизвестной начальной фазой Карданная передача
Карданная передача Трансмиссия, ее обслуживание и ремонт. Назначение, общее устройство трасмиссии танка, БМП. (Тема 8.1)
Трансмиссия, ее обслуживание и ремонт. Назначение, общее устройство трасмиссии танка, БМП. (Тема 8.1) Презентация к уроку Импульс
Презентация к уроку Импульс Электромагнитная индукция
Электромагнитная индукция Построение изображений в тонких линзах
Построение изображений в тонких линзах Гравитационное поле. Законы Кеплера
Гравитационное поле. Законы Кеплера Техногенные опасности. Статическое электричество. Лазерное излучение
Техногенные опасности. Статическое электричество. Лазерное излучение Метод проектов на уроках физики
Метод проектов на уроках физики Технический проекты Леонардо да Винчи
Технический проекты Леонардо да Винчи Интерференция света
Интерференция света Сообщающие сосуды
Сообщающие сосуды Олимпийские игры и физика
Олимпийские игры и физика