Содержание
- 2. Гипотеза де Бройля В 1924 г. Луи де Бройль выдвинул гипотезу об универсальности корпускулярно-волнового дуализма: не
- 3. Связь величин, описывающих корпускулярные и волновые свойства частиц та же, что и для фотонов:
- 4. Групповая и фазовая скорости волн де Бройля Условно представим каждую частицу в виде волнового пакета, центр
- 5. Фазовая: Фазовая скорость волн де Бройля больше скорости света. Групповая: Групповая скорость волны де Бройля равна
- 6. Длина волны де Бройля тем меньше, чем больше масса частицы и ее скорость. Пусть m =
- 7. Для электрона с энергиями от 10 эВ до 104 эВ длины волн де Бройля лежат в
- 8. Первое экспериментальное подтверждение гипотезы де Бройля было получено в 1927 году в опытах К. Дэвиссона и
- 9. Опыт В.А. Фабриканта (1949 г.)
- 10. Дифракция электронов при прохождении через очень тонкий слой серебра
- 11. Дифракция нейтронов
- 12. Природа волн де Бройля Это не электромагнитные волны. Природа волн де Бройля вероятностная. Частицы с большей
- 13. Соотношение неопределенностей Гейзенберга
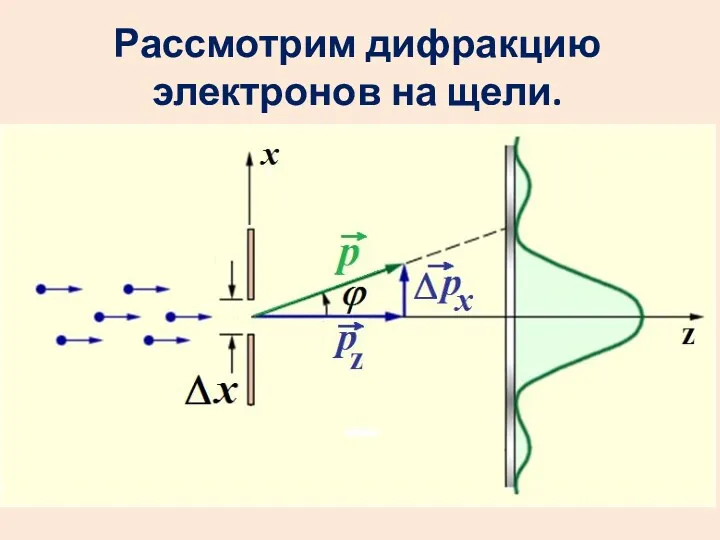
- 14. Рассмотрим дифракцию электронов на щели.
- 15. Пусть условно все электроны летят в центральный максимум. Координата х каждого электрона точно не известна. Неопределенность
- 16. Запишем условие первого минимума:
- 17. Получим: С учетом других максимумов произведение будет больше.
- 18. Соотношения неопределенностей Гейзенберга:
- 19. Для квантовой частицы неправомерно говорить об одновременных значениях ее координаты и импульса. Чем точнее определена какая-либо
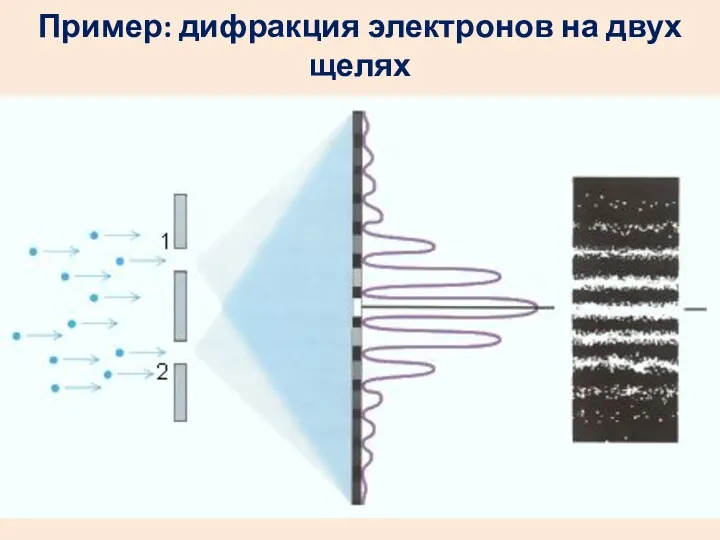
- 20. Пример: дифракция электронов на двух щелях
- 21. В привычном мире все тела движутся по траек-ториям. Траекторию летящего электрона указать невозможно: он не только
- 22. Для энергии частицы W и времени: Эта неопределенность приводит к размыванию уровней энергии электронов в атомах,
- 23. Волновая функция
- 24. Положение частицы в пространстве в данный момент времени определяют с помощью волновой функции Это комплексная величина.
- 25. Вероятность dP того, что частица находится в некоторм объеме dV: комплексно сопряженная функция
- 26. Квадрат модуля пси-функции дает плотность вероятности положения частицы в пространстве и изменяется по волновому закону.
- 27. Уравнение плоской волны де Бройля, распространяющейся вдоль оси х: р и Е – импульс и энергия
- 28. Квадрат амплитуды волны де Бройля в данной точке является мерой вероятности обнаружить частицу в этой точке.
- 30. Скачать презентацию

























 Электрисеский ток. Сила тока.
Электрисеский ток. Сила тока. Программа элективного курса Методы и приёмы решения задач по физике
Программа элективного курса Методы и приёмы решения задач по физике Динамика негіздері
Динамика негіздері Общее устройство автомобиля
Общее устройство автомобиля Ядерный реактор. Атомная энергетика
Ядерный реактор. Атомная энергетика Закон всемирного тяготения
Закон всемирного тяготения Системно-деятельностный подход в обучении физики как основа ФГОС
Системно-деятельностный подход в обучении физики как основа ФГОС Электричество. Работа электрического тока
Электричество. Работа электрического тока Сопротивление материалов
Сопротивление материалов Механика. Механическое движение
Механика. Механическое движение Силовое поле. Работа. Энергия. Мощность
Силовое поле. Работа. Энергия. Мощность Презентация Кислород
Презентация Кислород Выяснение условия равновесия рычага
Выяснение условия равновесия рычага Физические и геологические основы сейсморазведки
Физические и геологические основы сейсморазведки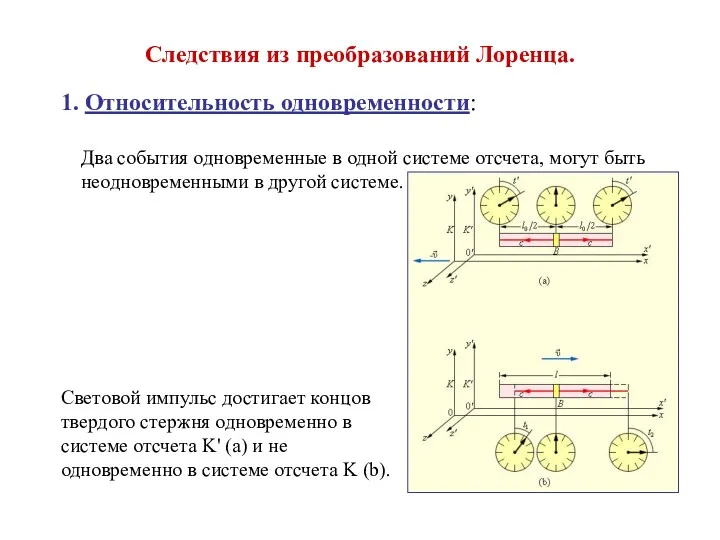 Следствия из преобразований Лоренца
Следствия из преобразований Лоренца Ерітінділердің коллигативті қасиеттері. Ерітінділер буының қысымы. Осмос қысымы
Ерітінділердің коллигативті қасиеттері. Ерітінділер буының қысымы. Осмос қысымы Thermal Energy, Chemical Energy
Thermal Energy, Chemical Energy Design and mechanical stability analysis of the interaction region for the inverse compton scattering gamma-ray source
Design and mechanical stability analysis of the interaction region for the inverse compton scattering gamma-ray source Історичні моделі будови атому
Історичні моделі будови атому Бұрандалы конвейерлер. Түрлері және қолдану аймағы
Бұрандалы конвейерлер. Түрлері және қолдану аймағы Электрооборудование автомобилей. Электростартеры. (Урок 4)
Электрооборудование автомобилей. Электростартеры. (Урок 4) Электростатика. Поле в диэлектриках
Электростатика. Поле в диэлектриках Механізація водопостачання
Механізація водопостачання Движение тела вокруг неподвижной точки. Случай Эйлера
Движение тела вокруг неподвижной точки. Случай Эйлера Экспериментальные методы исследования частиц
Экспериментальные методы исследования частиц Физические основы прочности. Кристаллогеометрия деформационных процессов. (Лекция 2-3)
Физические основы прочности. Кристаллогеометрия деформационных процессов. (Лекция 2-3) Спектроскопия ядерного магнитного резонанса
Спектроскопия ядерного магнитного резонанса Реактивные двигатели
Реактивные двигатели