Содержание
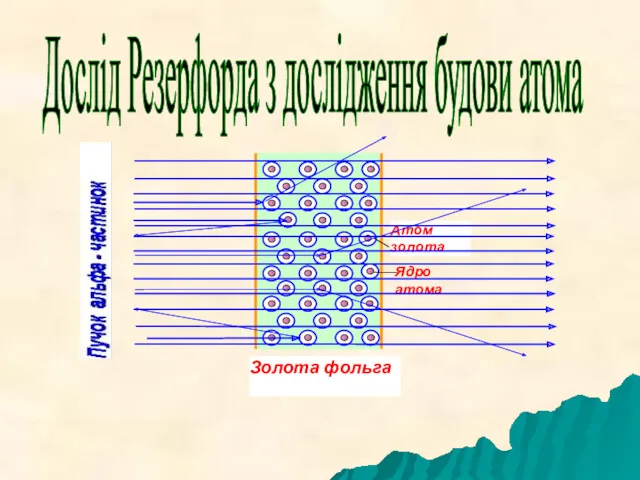
- 2. Дослід Резерфорда з дослідження будови атома
- 3. досліди Резерфорда
- 4. Ернест РЕЗЕРФОРД, Барон Резерфорд Нельсонський I 1871-1937 університет, де під його керівництвом Ганс Гейгер винайшов свій
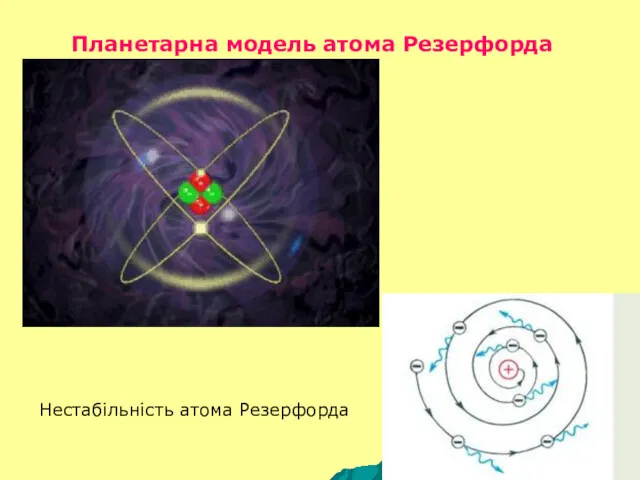
- 5. Планетарна модель атома Резерфорда Нестабільність атома Резерфорда
- 6. Нільс Бор, один з основоположників сучасних уявлень про субатомний світ, творець першої квантово-механічної моделі будови атома.
- 7. існують стаціонарні стани атома, знаходячись у яких він не випромінює і не поглинає енергію. Цим стаціонарним
- 8. при переході атома з одного стаціонарного стану в інший випромінюється або поглинається один фотон (квант енергії).
- 9. Атом водню в теорії Бора
- 10. Атом водню в теорії Бора
- 11. Виведення формули Бальмера з постулатів Бора Електрон в атомі водню утримується силою Кулона: F=ke2 /r2 Ця
- 12. Виведення формули Бальмера з постулатів Бора З цих рівнянь знайдемо швидкість електрона на стаціонарному рівні V
- 13. Енергія електрона в атомі водню дорівнює сумі кінетичної енергії і потенціальної енергії його взаємодії з ядром
- 14. Згідно до другого постулату Бора: ħv = - Wі (1/n2 - 1/m2). Таким чином, ми отримали
- 15. Усі лінії спектра випромінювання атомів, які випромінюються при переході електронів з будь-якої орбіти на певну, називають
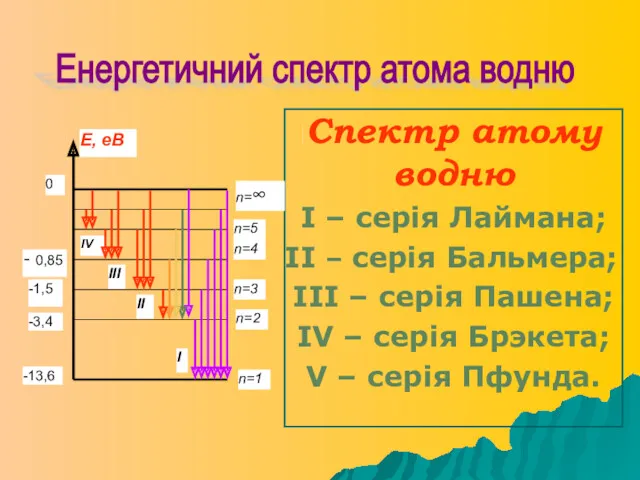
- 16. Спектр атому водню І – серія Лаймана; ІІ – серія Бальмера; ІІІ – серія Пашена; ІV
- 17. Спектр ( лат. ( лат. spectrum від лат. Spectare дивитися) - сукупність значень та їх розподіл
- 18. Лінійчасті спектри дають речовини в атомарному стані Інфрачервона область спектру Видиме світло Ультра фіолет Спектр поглинання
- 19. Смугасті спектри дають речовини в молекулярному стані СМУГАСТИЙ СПЕКТР Інфрачервона область спектру Видиме світло Ультра фіолет
- 20. Суцільні спектри дають речовини в твердому стані або в стані високотемпературної плазми (зірки, Сонце – зірка)
- 21. АТОМ ВОДНЮ В КВАНТОВІЙ МЕХАНІЦІ Потенціальна енергія електрона в цьому атомі дорівнює:
- 22. Ервін Шредінгер - австрійський фізик, один з творців квантової механіки. Найважливішою заслугою Шредінгера є створення їм
- 23. Вирішення рівняння Шредінгера дозволяє отримати важливі результати. Виявляється, що стан атому можна визначити за допомогою набору
- 26. 4. Спін. У 1921р. Штерном і Герлахом були проведені досліди по вимірюванню магнітних моментів атомів різних
- 27. Із загальних висновків квантової механіки випливає, що власний момент імпульсу електрона квантується: де s - спінове
- 28. Отто Штерн (1888 – 1969) Німецько-американський фізик. В 1920 доцент, потім професор університету у Франкфурті-на-Майні, з
- 29. Дослід Штерна – Герлаха Магнітне поле створюється між двома магнітними полюсами, один з яких плоский, а
- 30. АТОМ ВОДНЮ В КВАНТОВІЙ МЕХАНІЦІ Стан електрону, який має різні значення орбітального квантового числа, в атомній
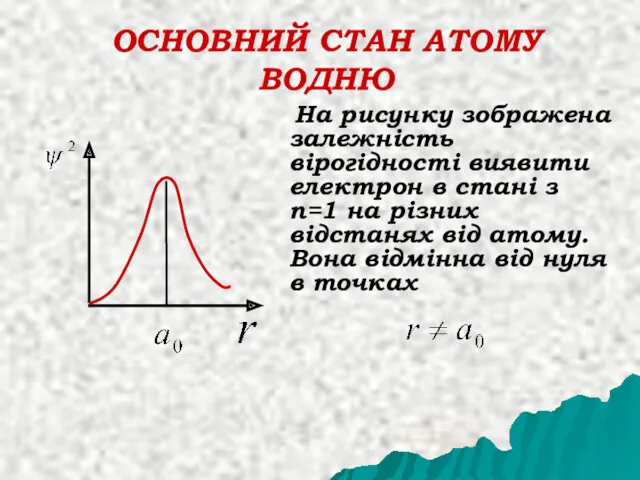
- 31. ОСНОВНИЙ СТАН АТОМУ ВОДНЮ Розглянемо більш детально s - стан електрону в атомі водню при n=1.
- 32. ОСНОВНИЙ СТАН АТОМУ ВОДНЮ На рисунку зображена залежність вірогідності виявити електрон в стані з n=1 на
- 33. Вольфганг Ернст Паулі Австрійсько – швейцарський фізик – теоретик. Його наукові роботи відносяться до численних розділів
- 34. ПРИНЦИП ПАУЛІ (принцип виключення) У 1925 р. Паулі встановив квантово-механічний закон – принцип Паулі (принцип виключення):
- 35. ПРИНЦИП ПАУЛІ (принцип виключення) Тепер визначимо максимальне число електронів, що знаходяться у станах, які відповідають двом
- 36. ПРИНЦИП ПАУЛІ
- 37. Періодична система хімічних елементів Д.І.Менделєєва
- 39. Скачать презентацию
































 Вакуумные установки
Вакуумные установки Допуски и посадки. Взаимозаменяемость
Допуски и посадки. Взаимозаменяемость Рубка металла
Рубка металла Электрический ток в жидкостях
Электрический ток в жидкостях Резьбовые соединения (РС)
Резьбовые соединения (РС) Схематичное устройство автомобиля
Схематичное устройство автомобиля Первое начало термодинамики применительно к атмосфере. (Лекция 11)
Первое начало термодинамики применительно к атмосфере. (Лекция 11) Проводники и диэлектрики в электростатическом поле
Проводники и диэлектрики в электростатическом поле Типы двигателей
Типы двигателей Электромагнитные волны
Электромагнитные волны Рекуррентные оптимальные алгоритмы фильтрации случайных процессов. Фильтр Калмана-Бьюси
Рекуррентные оптимальные алгоритмы фильтрации случайных процессов. Фильтр Калмана-Бьюси Якорное устройство. Тема 8
Якорное устройство. Тема 8 Люминесцентные лампы
Люминесцентные лампы Ультрафиолетовое излучение
Ультрафиолетовое излучение Нанотехнология және наноматериалдар. Қазіргі нанотехнология мәселелері
Нанотехнология және наноматериалдар. Қазіргі нанотехнология мәселелері Внеклассные мероприятия по физике.
Внеклассные мероприятия по физике. Физические явления языком литературы (в рамках общешкольного проекта Слово в итегрированом пространстве изучаемых наук)
Физические явления языком литературы (в рамках общешкольного проекта Слово в итегрированом пространстве изучаемых наук) Сложение сил. Равнодействующая сил.
Сложение сил. Равнодействующая сил. Детали Машин. Виды механизмов
Детали Машин. Виды механизмов Контур с током в магнитном поле
Контур с током в магнитном поле Молекулярная физика и термодинамика
Молекулярная физика и термодинамика Анализ сложной линейной электрической цепи постоянного тока
Анализ сложной линейной электрической цепи постоянного тока Инжекторная система впрыска топлива
Инжекторная система впрыска топлива Получение и передача переменного электрического тока. Трансформатор
Получение и передача переменного электрического тока. Трансформатор Автоматическая коробка передач
Автоматическая коробка передач Зубчатые передачи
Зубчатые передачи Lektsia_16_Fotoeffekt
Lektsia_16_Fotoeffekt Трансмиссии ВКМ
Трансмиссии ВКМ