Содержание
- 2. Возникновение понятия «атом» Понятие «атом» впервые появилось в работах древнегреческих философов Демокрита и Левкипта. Под атомом
- 3. Экспериментальные данные, свидетельствующие о делимости атома Открытие электрона 1891г. Открытие явления радиоактивности 1896г. Опыт Эрнеста Резерфорда
- 4. Открытие электрона Занимаясь изучением газового разряда Д.Д.Томсон, совместно с сотрудниками выполнил серию классических работ, приведших к
- 5. Радиоактивность В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности - самопроизвольного распада ядер
- 6. Радиоактивность
- 7. Модель атома Томсона Одну из первых моделей атома предложил английский физик Дж. Томсон в 1903 г.
- 8. Опыт Э.Резерфорда Э. Резерфорд с учениками проверил состоятельность модели атома Томсона. Эрнест РЕЗЕРФОРД (1871 - 1937)
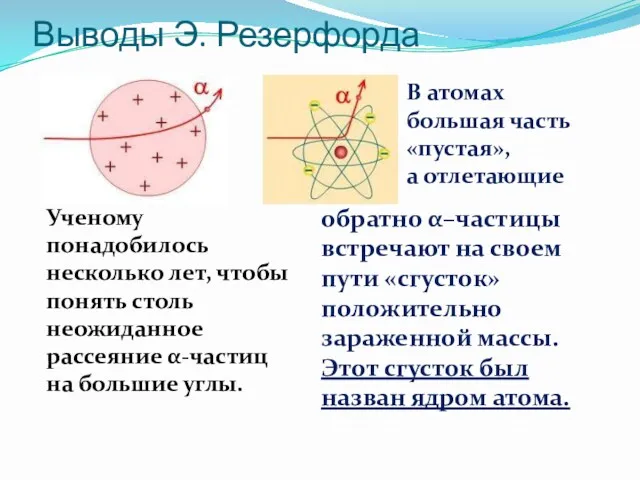
- 9. Выводы Э. Резерфорда Ученому понадобилось несколько лет, чтобы понять столь неожиданное рассеяние α-частиц на большие углы.
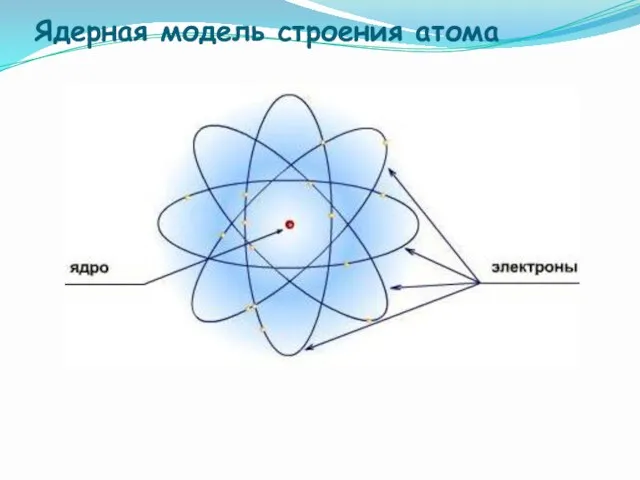
- 10. Ядерная модель строения атома
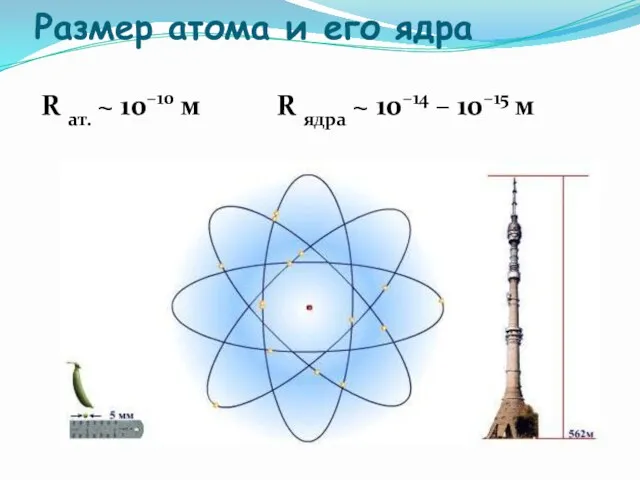
- 11. Размер атома и его ядра R ат. ~ 10–10 м R ядра ~ 10–14 – 10–15
- 12. Открытие протона 1913 г. Э.Резерфорд выдвинул гипотезу о том, что одной из частиц, входящих в состав
- 13. Открытие нейтрона 1920 г. Э.Резерфорд предположил существование электрически нейтральной частицы с массой, приблизительно равной массе протона.
- 14. Протонно-нейтронная модель ядра 1932 г. советские ученые Е.Н. Гапон, Д.Д.Иваненко и немецкий физик Гейзенберг Все ядра
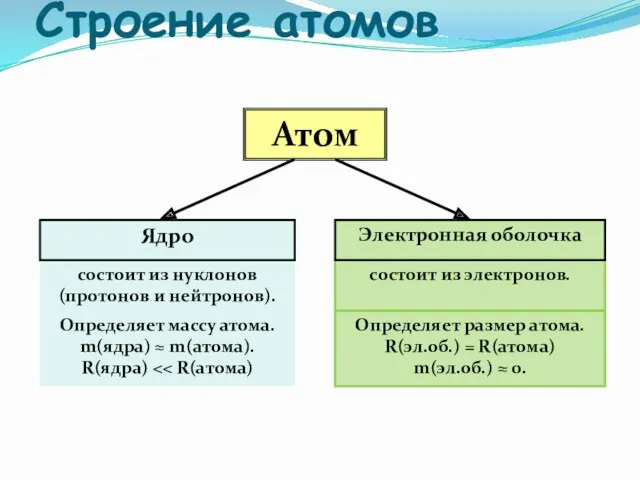
- 15. Строение атомов Атом Ядро состоит из нуклонов (протонов и нейтронов). состоит из электронов. Электронная оболочка Определяет
- 16. Состав атома Атомы химических элементов состоят из трех частиц: протоны или р+ нейтроны или n0 электроны
- 17. Атом – наименьшая частица химического элемента, носитель его свойств.
- 19. Скачать презентацию












 Электромагнитная индукция
Электромагнитная индукция Сила Архимеда. Формула
Сила Архимеда. Формула Электротехника. Классический метод анализа переходных процессов. (Лекция 12)
Электротехника. Классический метод анализа переходных процессов. (Лекция 12) Закон Ома для ділянки кола
Закон Ома для ділянки кола Характеристики датчиков
Характеристики датчиков Электр тізбектерінің пассивтік бөліктерін эквивалентті түрлендіру. Тұрақты токтың қарапайым тізбектерін есептеу әдістері
Электр тізбектерінің пассивтік бөліктерін эквивалентті түрлендіру. Тұрақты токтың қарапайым тізбектерін есептеу әдістері Водородная бомба
Водородная бомба Энергия связи, дефект массы, ядерные силы
Энергия связи, дефект массы, ядерные силы Элементы физической кинетики
Элементы физической кинетики Mechanics of Material
Mechanics of Material Радиационные эффекты и уровни радиации
Радиационные эффекты и уровни радиации Электростатика
Электростатика Учёные России
Учёные России Золотое правило механики. 7 класс
Золотое правило механики. 7 класс Физико - математическая игра Эрудит
Физико - математическая игра Эрудит Кинематика поступательного и вращательного движения
Кинематика поступательного и вращательного движения Презентация урока - зачета
Презентация урока - зачета Погрузочные работы на судах
Погрузочные работы на судах Волновое уравнение для электромагнитных волн. Электричество и магнетизм
Волновое уравнение для электромагнитных волн. Электричество и магнетизм Решение задач на гидравлические машины
Решение задач на гидравлические машины Магнитное поле катушки с током
Магнитное поле катушки с током Motronic
Motronic Молекулярно-кинетическая теория газов. (Лекция 2)
Молекулярно-кинетическая теория газов. (Лекция 2) Давление газов. Закон Паскаля
Давление газов. Закон Паскаля Механические передачи
Механические передачи Мультимедийное сопровождение урока Скорость 7 класс
Мультимедийное сопровождение урока Скорость 7 класс Как изобретали велосипед
Как изобретали велосипед Техническое обучение по харвестерной головке Лог Макс 6000
Техническое обучение по харвестерной головке Лог Макс 6000