Содержание
- 2. Внутренняя энергия и теплоемкость идеального газа Средняя энергия одной молекулы Т.к. молекулы идеального газа на расстоянии
- 3. Теплоемкость Теплоёмкость тела величина, равная количеству теплоты, которую надо сообщить телу, чтобы повысить его температуру на
- 4. Для газов удобно пользоваться молярной теплоемкостью Сμ − количество теплоты, необходимое для нагревания 1 моля газа
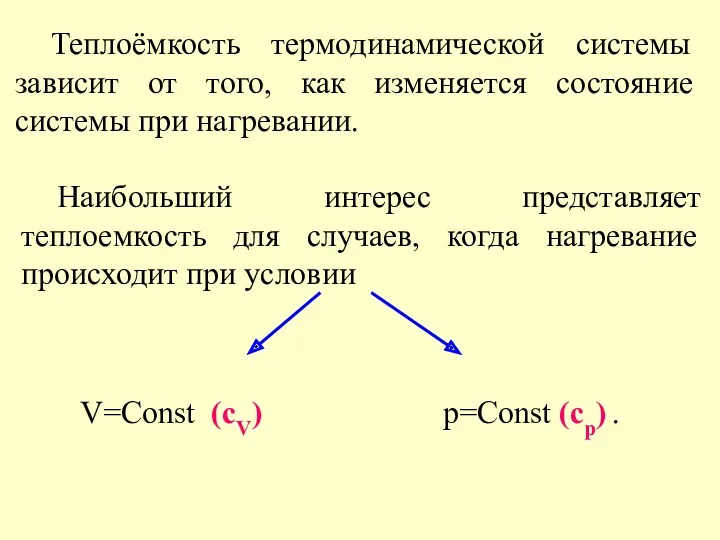
- 5. Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Наибольший интерес представляет теплоемкость
- 6. Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть
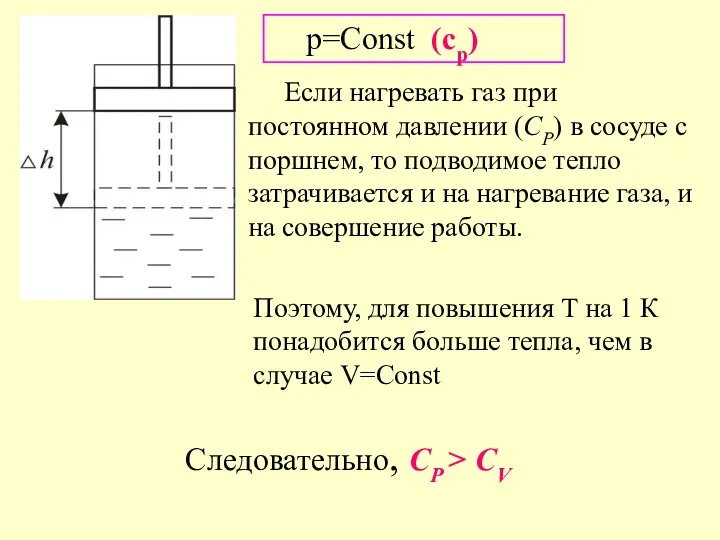
- 7. Если нагревать газ при постоянном давлении (СР) в сосуде с поршнем, то подводимое тепло затрачивается и
- 8. Запишем I начало ТД для 1 моля газа разделим на dT CV pVμ=RT Vμ=RT/p Т.о. работа,
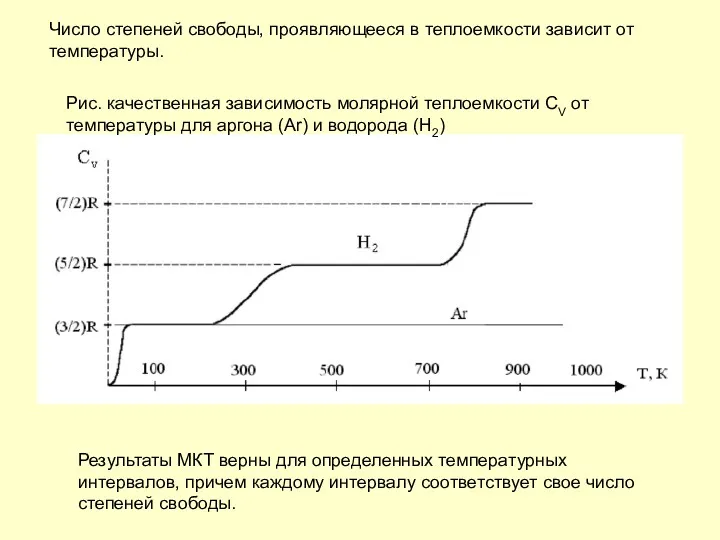
- 9. Число степеней свободы, проявляющееся в теплоемкости зависит от температуры. Результаты МКТ верны для определенных температурных интервалов,
- 10. Применение первого начала термодинамики к изопроцессам Изопроцесс – процесс, проходящий при постоянном значении одного из основных
- 11. ► Изотермический процесс – процесс, происходящий в физической системе при постоянной температуре (T = const). В
- 12. Используя формулу U = νсVT , получаем dU = νсV dT = 0 Следовательно, внутренняя энергия
- 13. ► Изохорический процесс – процесс, происходящий в физической системе при постоянном объеме (V = const). -
- 14. Изохорический процесс: V = const Из уравнения состояния идеального газа для двух температур T1 и T2
- 15. Пусть начальное состояние газа отвечает состоянию при нормальных условиях Т0 = 0°С = 273.15 °К, р0
- 16. ► Изобарический процесс – процесс, происходящий в физической системе при постоянном давлении (P = const). -
- 17. 2) Изобарический процесс: p = const В изобарическом процессе газ совершает работу Работа равна площади под
- 18. Перепишем последнее соотношение в виде Это равенство раскрывает физический смысл газовой постоянной R - она равна
- 19. ► Адиабатный процесс – процесс, происходящий в физической системе без теплообмена с окружающей средой (Q =
- 20. 4) Адиабатический процесс : dQ = 0 При адиабатическом процессе теплообмен между газом и окружающей средой
- 21. Исключая dT , получаем рdV = - сV (pdV + vdp)/R Откуда Интегрируя, находим
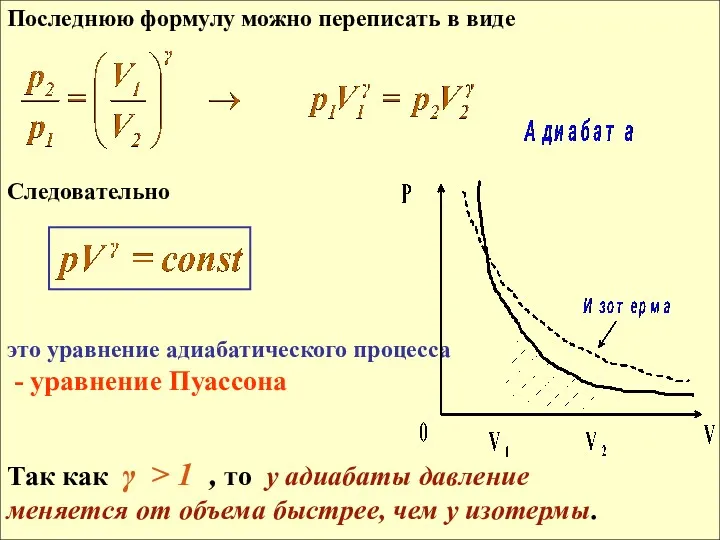
- 22. Последнюю формулу можно переписать в виде Следовательно это уравнение адиабатического процесса - уравнение Пуассона Так как
- 23. Используя уравнение состояния идеального газа, преобразуем уравнение Пуассона к виду Значит или При адиабатическом расширении идеальный
- 24. Политропический процесс Политропический процесс – процесс, протекающий при постоянной теплоёмкости, cm = const. где n -
- 25. Найдем уравнение политропы для идеального газа. Из первого начала термодинамики следует откуда получаем
- 26. С другой стороны, из уравнения состояния идеального газа Поэтому можно записать Поскольку cP = cV +
- 27. Обозначим , получим Интегрируем Следовательно - уравнение политропы, n - показатель политропы.
- 28. Все изопроцессы являются частным случаем политропического процесса:
- 29. Энтропия Адиабатические процессы в термодинамических системах могут быть равновесными и неравновесными. Для характеристики равновесного адиабатического процесса
- 32. Следовательно, S = const, адиабатный процесс по другому называют – изоэнтропийным процессом. Энтропия системы пропорциональна массе
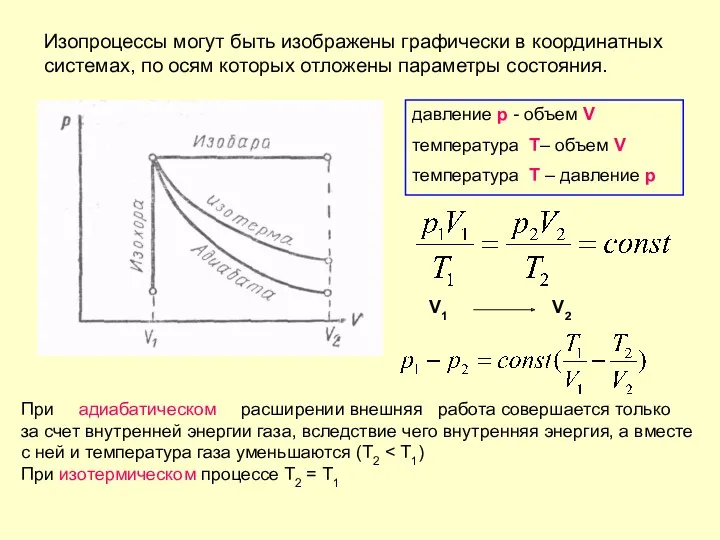
- 33. Изопроцессы могут быть изображены графически в координатных системах, по осям которых отложены параметры состояния. давление p
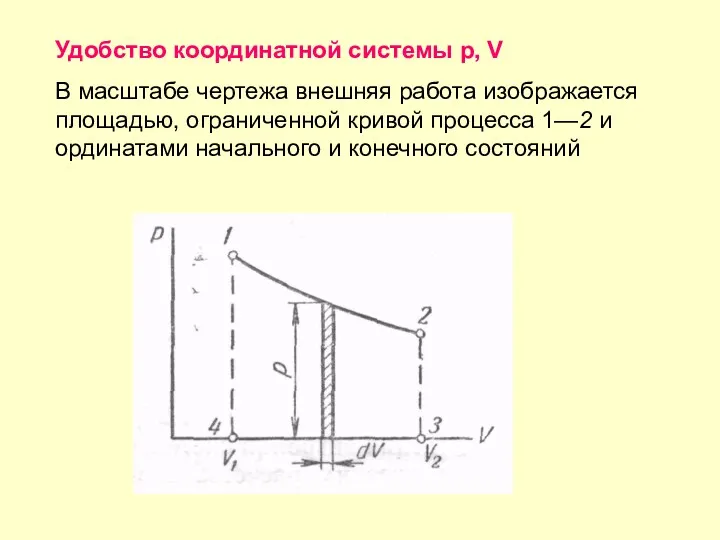
- 34. Удобство координатной системы р, V В масштабе чертежа внешняя работа изображается площадью, ограниченной кривой процесса 1—2
- 35. Круговые (замкнутые) процессы Совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние, называется круговым
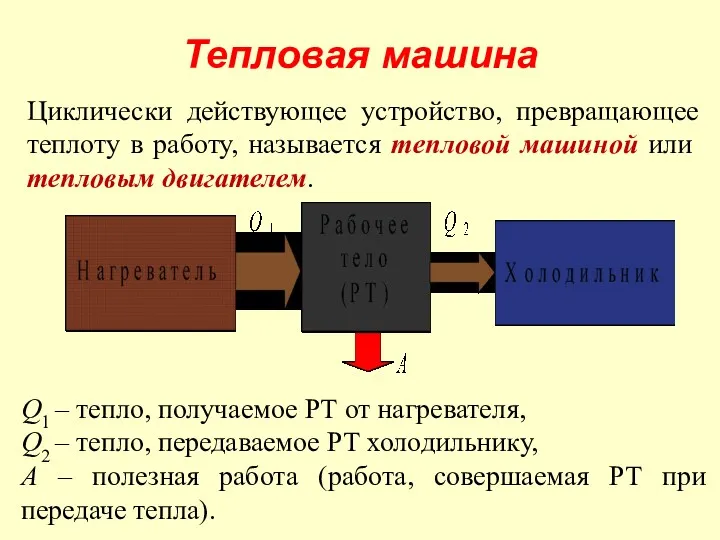
- 36. Тепловая машина Циклически действующее устройство, превращающее теплоту в работу, называется тепловой машиной или тепловым двигателем. Q1
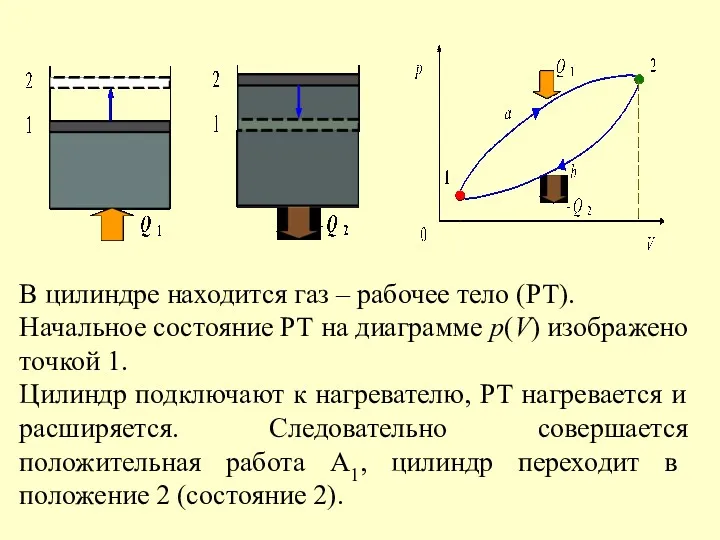
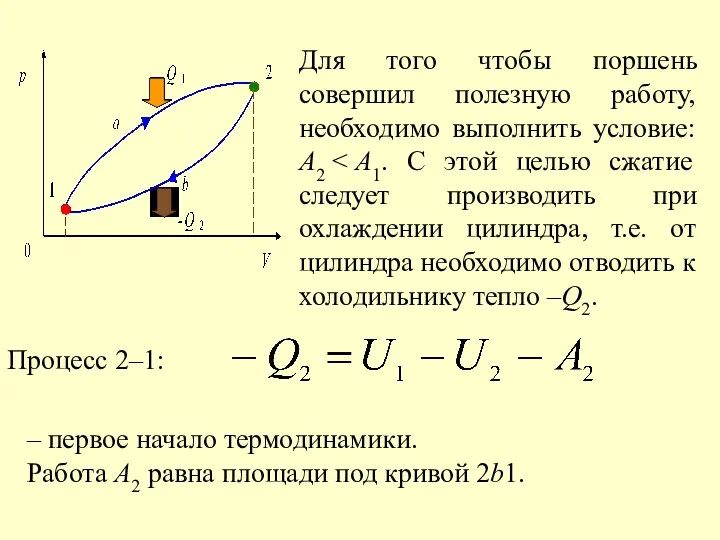
- 39. Для того чтобы поршень совершил полезную работу, необходимо выполнить условие: А2 Процесс 2–1: – первое начало
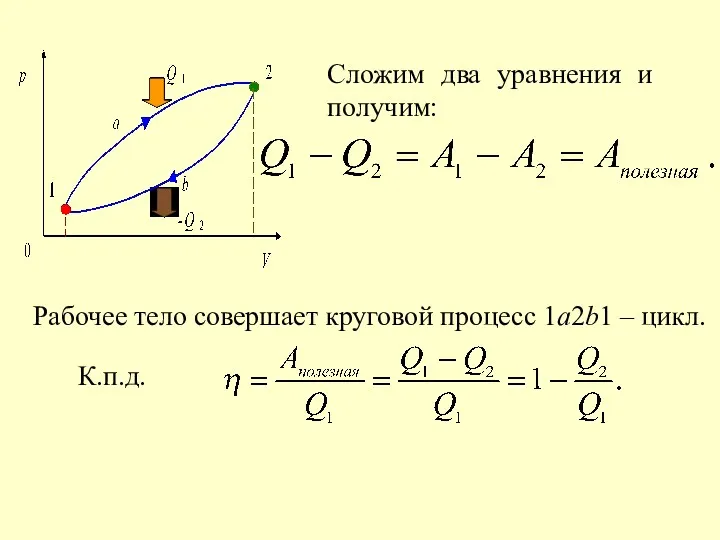
- 40. Сложим два уравнения и получим: Рабочее тело совершает круговой процесс 1a2b1 – цикл. К.п.д.
- 41. Процесс возвращения рабочего тела в исходное состояние происходит при более низкой температуре. Следовательно, для работы тепловой
- 42. Цикл Карно Никола Леонард Сади КАРНО – блестящий французский офицер инженерных войск, в 1824 г. опубликовал
- 43. из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей и холодильников, наибольшим КПД обладают обратимые
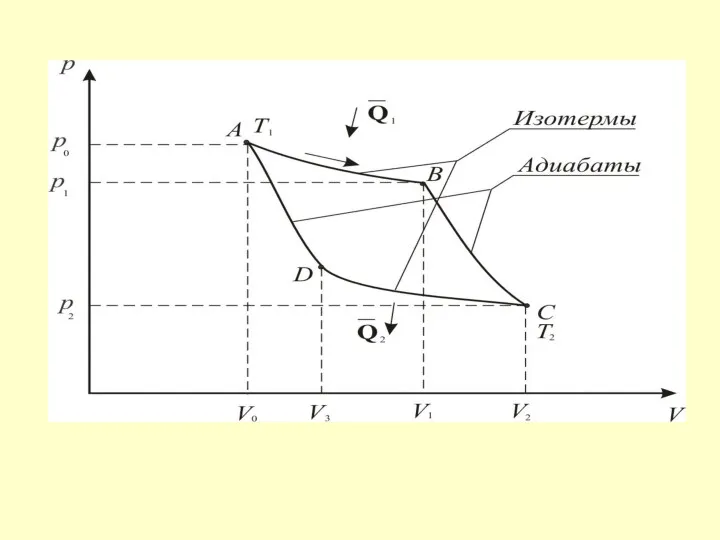
- 45. Процесс А-В – изотермическое расширение Процесс В-С – адиабатическое расширение. γ – коэффициент Пуассона.
- 46. Процесс С-D – изотермическое сжатие Процесс D-A – адиабатическое сжатие.
- 48. КПД цикла Карно η Если Т2 = 0, то η = 1, что невозможно, т.к. абсолютный
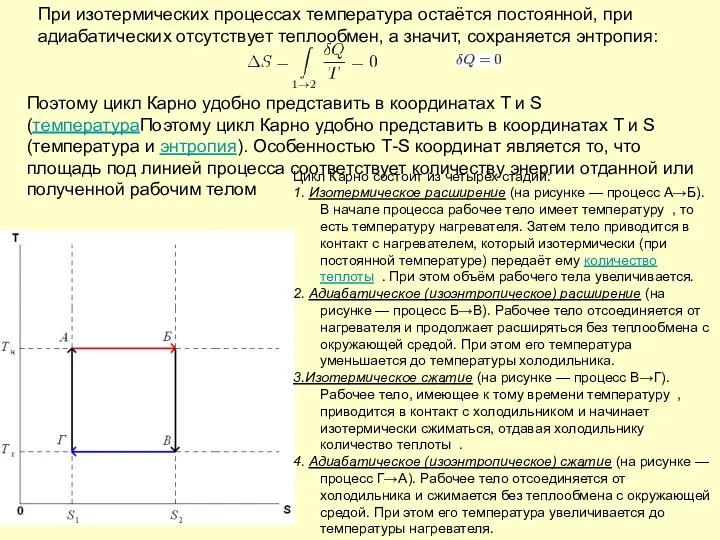
- 49. При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия: Поэтому цикл
- 51. Скачать презентацию


































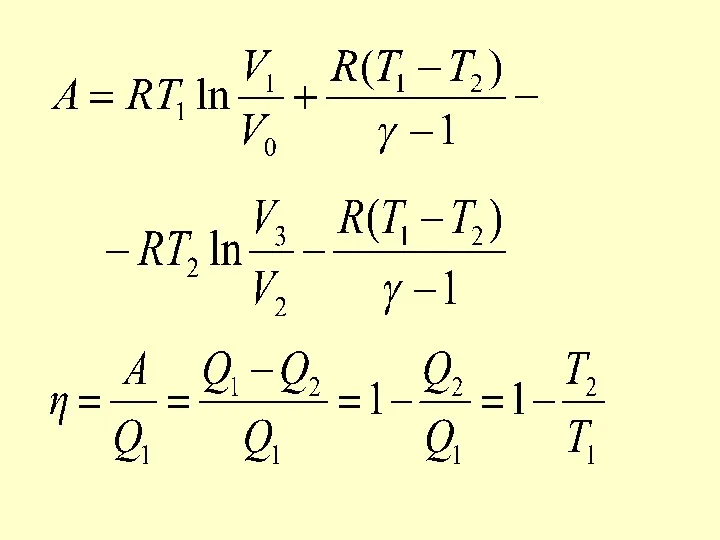

 Лампочка. История изобретения
Лампочка. История изобретения Удельная теплота плавления
Удельная теплота плавления Силова установка бронетранспортера БТР-80 та системи, що забезпечують її роботу в машині
Силова установка бронетранспортера БТР-80 та системи, що забезпечують її роботу в машині Потенциальная энергия заряженного тела
Потенциальная энергия заряженного тела Методическая разработка по методике В.Ф. Шаталова для организации учебной деятельности учащихся по физике. На примере темы Электрический ток. 8 класс
Методическая разработка по методике В.Ф. Шаталова для организации учебной деятельности учащихся по физике. На примере темы Электрический ток. 8 класс Движение электронов в электрическом, магнитном и скрещенных полях
Движение электронов в электрическом, магнитном и скрещенных полях Сообщающиеся сосуды и их применение
Сообщающиеся сосуды и их применение Размерная слесарная обработка деталей: шлифование ,опиливание. Зенкование, зенкерование, развертка
Размерная слесарная обработка деталей: шлифование ,опиливание. Зенкование, зенкерование, развертка Жұдырықшалы механизмдерді жіктеу
Жұдырықшалы механизмдерді жіктеу Проектирование узла измерения тока саморазряда электрохимического источника питания
Проектирование узла измерения тока саморазряда электрохимического источника питания Небесная механика. Лекции 3 - 4
Небесная механика. Лекции 3 - 4 Физическая и коллоидная химия
Физическая и коллоидная химия Атмосферные явления
Атмосферные явления Природа света. Линзы
Природа света. Линзы Электромагнитная индукция. Лекция 7
Электромагнитная индукция. Лекция 7 Индивидуальный проект на тему: Modern cars
Индивидуальный проект на тему: Modern cars Значение освоения космоса
Значение освоения космоса Теория решения изобретательских задач
Теория решения изобретательских задач Зубчатые передачи
Зубчатые передачи Гидравлический привод
Гидравлический привод Интерференция света
Интерференция света Магнитное поле
Магнитное поле Ремонт двигателя
Ремонт двигателя Інтерференція та дифракція світла
Інтерференція та дифракція світла ур 5..Работа. Мощность
ур 5..Работа. Мощность электромагнитная природа света
электромагнитная природа света Электростатика. Электростатическое поле
Электростатика. Электростатическое поле Електроємність. Конденсатори та їх використання в техніці. Енергія електричного поля
Електроємність. Конденсатори та їх використання в техніці. Енергія електричного поля