Содержание
- 2. Обратимые процессы Процесс называется обратимым, если по его завершению система может вернуться в исходное состояние через
- 3. Необратимые процессы 1) Необратимыми называются процессы, которые в природе самопроизвольно протекают только в одном направлении. В
- 4. N молекул? В литре воздуха N = 3⋅1022 молекул Микросостояние Состояние системы, определяемое тем, сколько частиц
- 5. Система, предоставленная самой себе, стремится перейти в состояние с большей термодинамической вероятностью! Энтропия (Больцман, 1872) Энтропией
- 6. Второе начало термодинамики Энтропия замкнутой, а также теплоизолированной термодинамической системы возрастает, если в системе происходит необратимый
- 7. Связь энтропии и приведенного тепла Пусть 1 моль идеального газа изотермически (т.е. обратимо) расширяется от объема
- 8. Третье начало термодинамики (теорема Нернста) При стремлении абсолютной температуры к нулю энтропия любого тела также стремится
- 9. При изохорическом нагревании энтропия идеального газа увеличивается, при охлаждении – уменьшается. 1) Определение процесса 2) Первое
- 10. При изобарическом нагревании энтропия идеального газа увеличивается, при охлаждении – уменьшается. 1) Определение процесса 2) Первое
- 11. При изотермическом расширении энтропия идеального газа увеличивается, при сжатии – уменьшается. 1) Определение процесса 2) Первое
- 12. При адиабатическом процессе изменение энтропии идеального газа равно нулю – изоэнтропийный процесс. 1) Определение процесса 2)
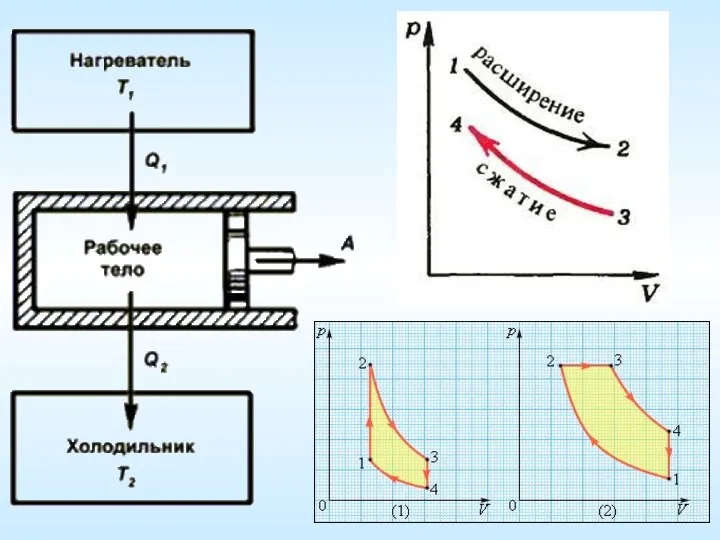
- 13. Второе начало термодинамики Невозможен периодический процесс (цикл), единственным и конечным результатом которого является превращение всей внутренней
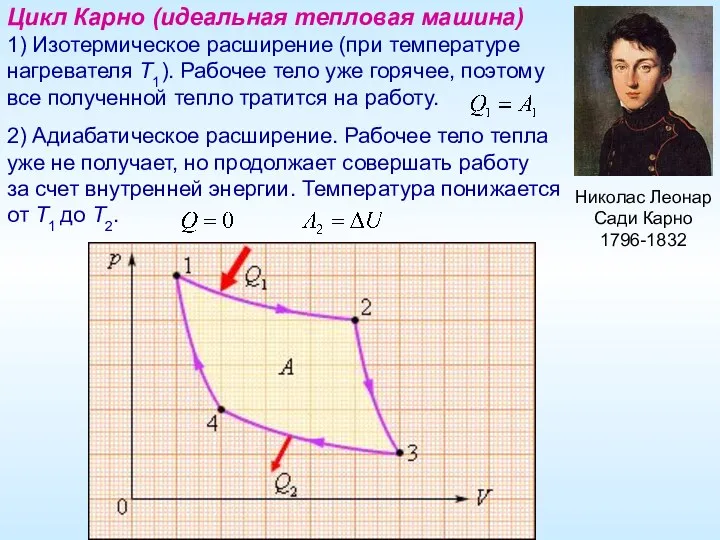
- 15. Николас Леонар Сади Карно 1796-1832 Цикл Карно (идеальная тепловая машина) 1) Изотермическое расширение (при температуре нагревателя
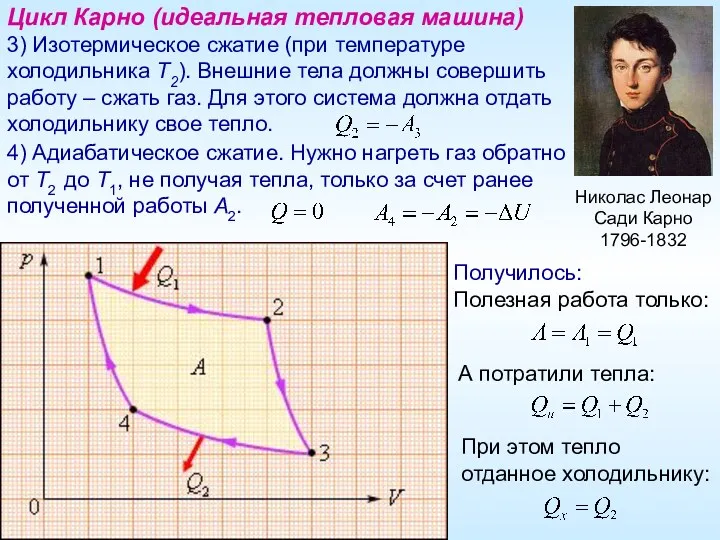
- 16. Николас Леонар Сади Карно 1796-1832 Цикл Карно (идеальная тепловая машина) 3) Изотермическое сжатие (при температуре холодильника
- 17. Коэффициент полезного действия Коэффициентом полезного действия теплового двигателя называют отношение полезной работы, совершенной двигателем, к количеству
- 18. Реальные: паровая машина Ползунова КПД 0,1%, Уатта КПД 1%. КПД паровозов, теперь уже практически не использующихся,
- 20. Скачать презентацию














 Реактивное движение
Реактивное движение Однофазная цепь с параллельным соединением электроприемников
Однофазная цепь с параллельным соединением электроприемников Решение задач Динамика
Решение задач Динамика Элементы механики газа
Элементы механики газа Элементарные частицы - лектоны
Элементарные частицы - лектоны Методика проведения урока-исследования по теме Термодинамика
Методика проведения урока-исследования по теме Термодинамика Редукторы
Редукторы История освоения электричества
История освоения электричества Применение энергии атома
Применение энергии атома Model de elaborare a raportului
Model de elaborare a raportului Электромагнитные явления. Лекция 3
Электромагнитные явления. Лекция 3 Стандартная модель. Космогония современного мира
Стандартная модель. Космогония современного мира Математика в профессии автомеханик
Математика в профессии автомеханик Урок по теме Ускорение свободного падения на Земле и других планетах 10 класс
Урок по теме Ускорение свободного падения на Земле и других планетах 10 класс Построение фазовых портретов динамических систем
Построение фазовых портретов динамических систем Применение ЭОР в образовательном процессе
Применение ЭОР в образовательном процессе Конденсатор в цепи переменного тока
Конденсатор в цепи переменного тока Механические передачи. Виды передач. Расчет передаточных отношений
Механические передачи. Виды передач. Расчет передаточных отношений Ультразвук
Ультразвук Механическая работа. Мощность. Рычаги
Механическая работа. Мощность. Рычаги teoriya_avtomaticheskogo_upravleniya_Polulah_parth3
teoriya_avtomaticheskogo_upravleniya_Polulah_parth3 Ремонт червячного редуктора
Ремонт червячного редуктора Ядерные реакции
Ядерные реакции Решение задач а фотоэффект
Решение задач а фотоэффект Постоянный электрический ток
Постоянный электрический ток Техническая механика. Внутренние силы. Напряжения и деформации
Техническая механика. Внутренние силы. Напряжения и деформации Тема 1. Електромобілі та основні етапи їх розвитку. Частина 1
Тема 1. Електромобілі та основні етапи їх розвитку. Частина 1 Презентация к уроку :Трансформатор
Презентация к уроку :Трансформатор