Содержание
- 2. Классификация дефектов по их размерности Классификацию дефектов решетки удобно проводить по чисто геометрическому признаку - по
- 3. Дефект в жизни
- 4. Точечные дефекты: вакансии и межузельные атомы вольт Дефекты в кристаллах - устойчивые нарушения правильного расположения атомов
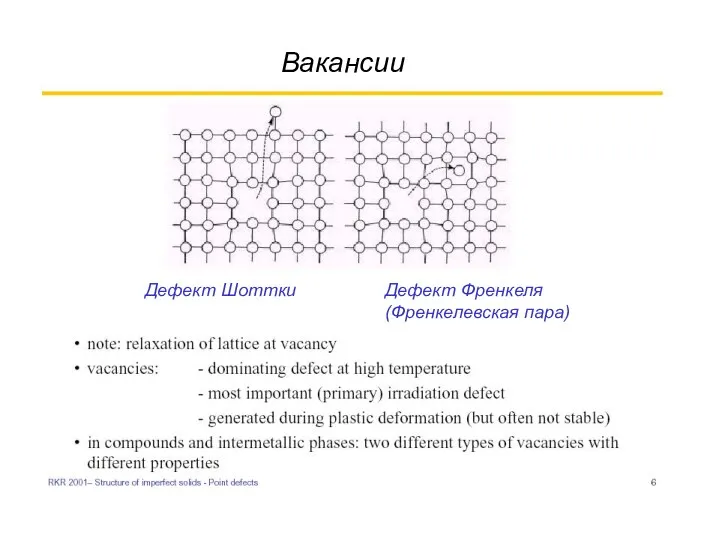
- 5. Вакансии Дефект Шоттки Дефект Френкеля (Френкелевская пара)
- 7. Плоские скопления точечных дефектов
- 8. Механизм образования точечных дефектов
- 9. Образование френкелевской пары
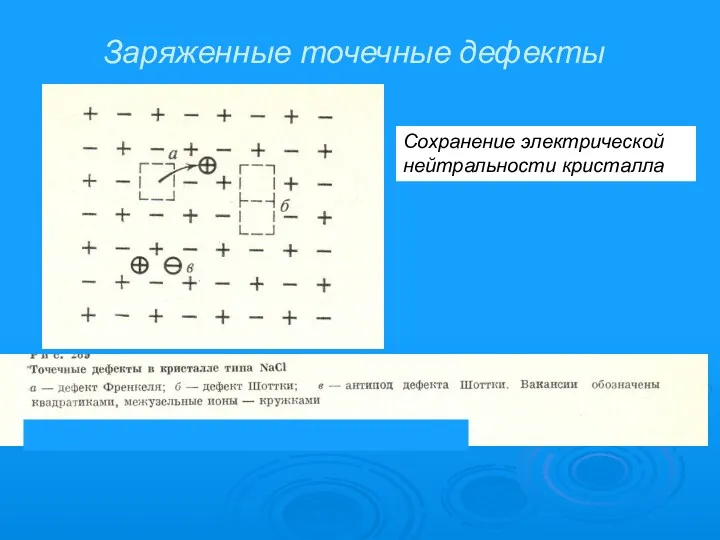
- 10. Заряженные точечные дефекты Сохранение электрической нейтральности кристалла
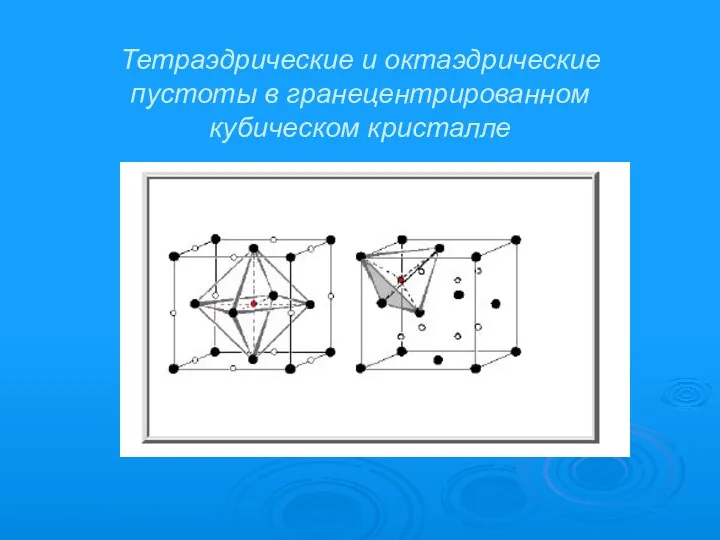
- 11. Тетраэдрические и октаэдрические пустоты в гранецентрированном кубическом кристалле
- 12. Плотнейшая упаковка в гранецентрированной кубической решетке
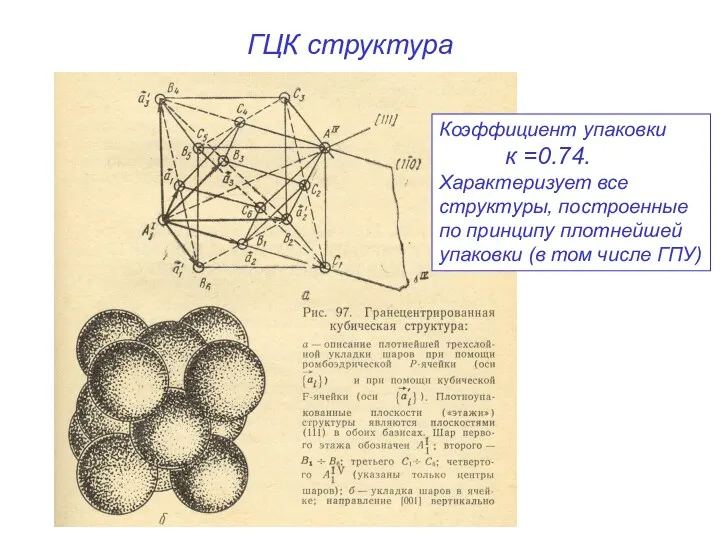
- 13. ГЦК структура Коэффициент упаковки к =0.74. Характеризует все структуры, построенные по принципу плотнейшей упаковки (в том
- 14. Тетраэдрические поры в ячейке ГЦК структуры r = 0.225R, 8 пустот на ячейку
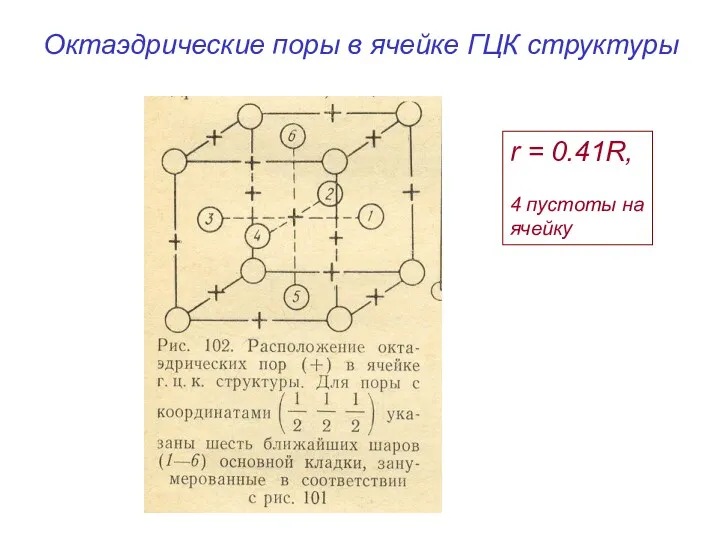
- 15. Октаэдрические поры в ячейке ГЦК структуры r = 0.41R, 4 пустоты на ячейку
- 16. Межузельные атомы в объемноцентрированном кубическом кристалле Упрочнение стали
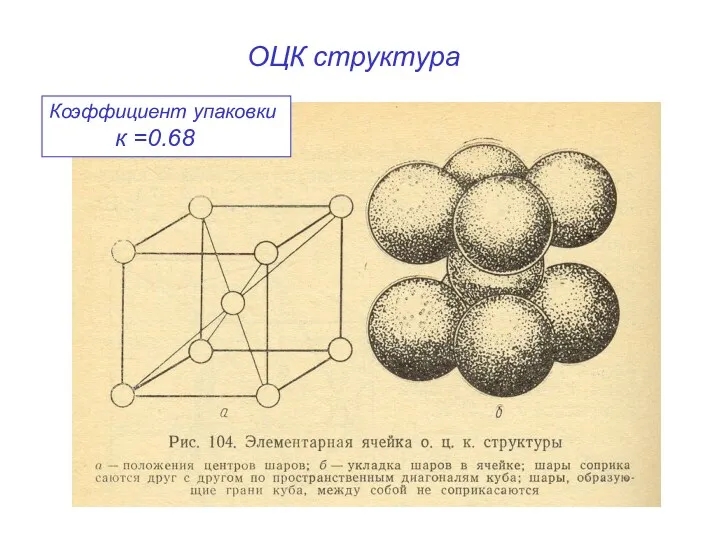
- 17. ОЦК структура Коэффициент упаковки к =0.68
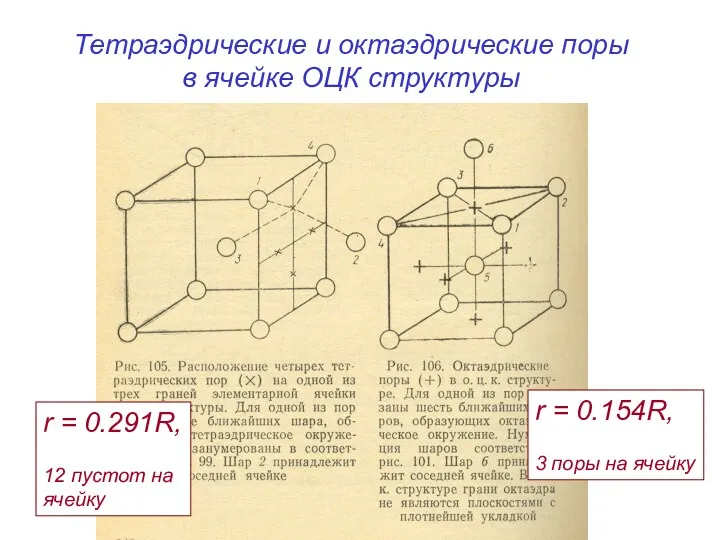
- 18. Тетраэдрические и октаэдрические поры в ячейке ОЦК структуры r = 0.291R, 12 пустот на ячейку r
- 19. Коэффициенты упаковки различных кубических ячеек Z = Ni + (1/8)Nc + (1/2) Nf , где Z
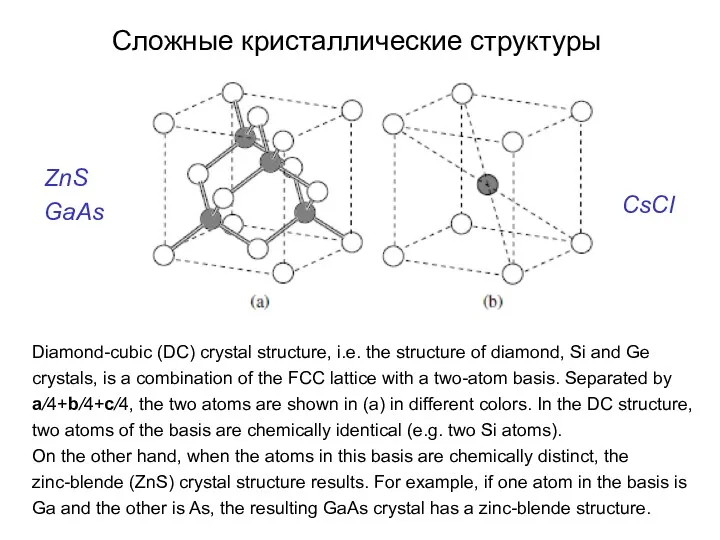
- 20. Diamond-cubic (DC) crystal structure, i.e. the structure of diamond, Si and Ge crystals, is a combination
- 21. Межузельные атомы (1) гантель краудион
- 22. Межузельные атомы (2)
- 23. Межузельные атомы (3)
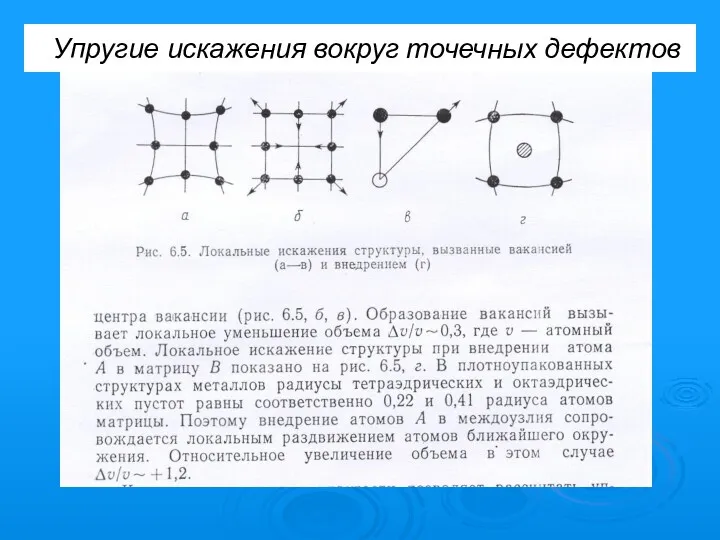
- 25. Упругие искажения вокруг точечных дефектов
- 26. Упругие поля искажений вокруг точечных дефектов
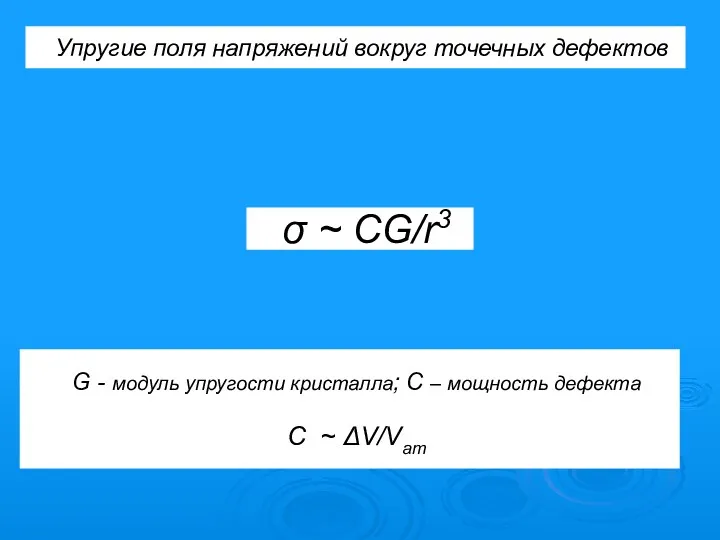
- 27. Упругие поля напряжений вокруг точечных дефектов σ ~ CG/r3 G - модуль упругости кристалла; C –
- 28. Равновесная концентрация точечных дефектов c = n/N ≈ e− E/ kT kB T = 1.4 10-16
- 29. Термодинамика кристаллов
- 30. Термодинамические потенциалы Первое начало термодинамики: dU = δQ - dR ; δQ = TdS dU =
- 32. !! Химический потенциал
- 33. Свободная энергия Гельмгольца F = U - TS dF = dU -TdS - SdT dU =
- 34. Энтропия (статистическое истолкование) Выражение S = kB lnΩ связывающее энтропию с логарифмом статистического веса данного состояния
- 35. Статистическое истолкование второго начала термодинамики: природные процессы стремятся перевести термодинамическую систему из состояний менее вероятных в
- 36. Природа необратимости Статистическое истолкование второго начала термодинамики: природные процессы стремятся перевести термодинамическую систему из состояний менее
- 37. Расширение газа в пустоту (и обратно ?) ? Подсчет вероятности нахождения молекул в левой половине сосуда
- 38. H – теорема Больцмана, ….. … и ее критика
- 39. Термодинамические неравенства (1) Объединение первого и второго начала термодинамики приводит к следующему неравенству: TdS > dU
- 40. Термодинамические неравенства (2) Будем рассматривать систему, находящуюся в контакте с термостатом (T =const), объем которой неизменен
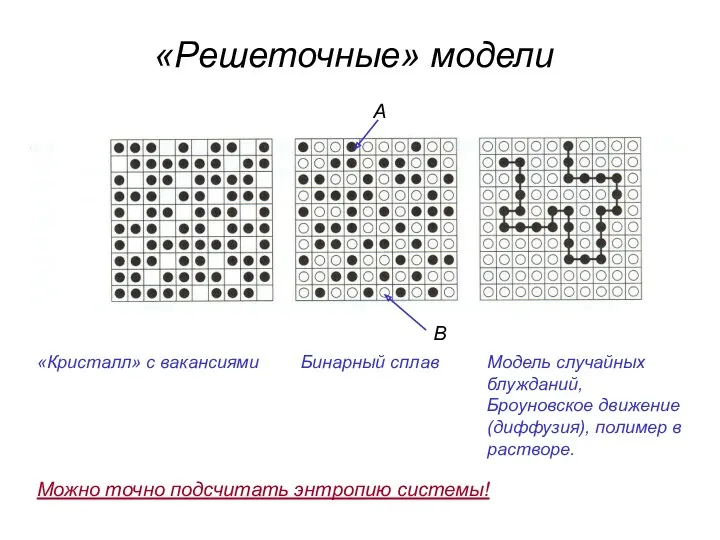
- 41. «Решеточные» модели «Кристалл» с вакансиями Бинарный сплав Модель случайных блужданий, Броуновское движение (диффузия), полимер в растворе.
- 42. Немного комбинаторики 1. Найти вероятность вытащить подряд две бубновые карты при последовательном вытаскивании двух карт из
- 43. Сколькими способами можно разложить n шаров по N лузам? N n n молекул можно распределить по
- 44. Решеточная модель кристалла с вакансиями Рассмотрим сосуд, разделенный на большое число, скажем N ячеек, объем каждой
- 45. Используя одно из термодинамических соотношений Максвелла можно написать: (dP/dT)V = (dS/dV)T = (1/ Vc)(dS/dN)T = =
- 46. Система из N молекул, обладающих двумя уровнями энергии; соотношение Больцмана Ω S = kBlnΩ По формуле
- 47. Понятие о тепловой энергии nε /n0 = e− ε / kBT kB T = 1.4 10-16
- 48. Обобщение на квантовую теорию
- 49. Использование выражения w ∝ exp (− F/kBT) для определения равновесных конфигураций термодинамических систем и вычисления средних
- 50. Физика упорядочения F = U - TS = Fmin минимум свободной энергии - равновесная конфигурация: w
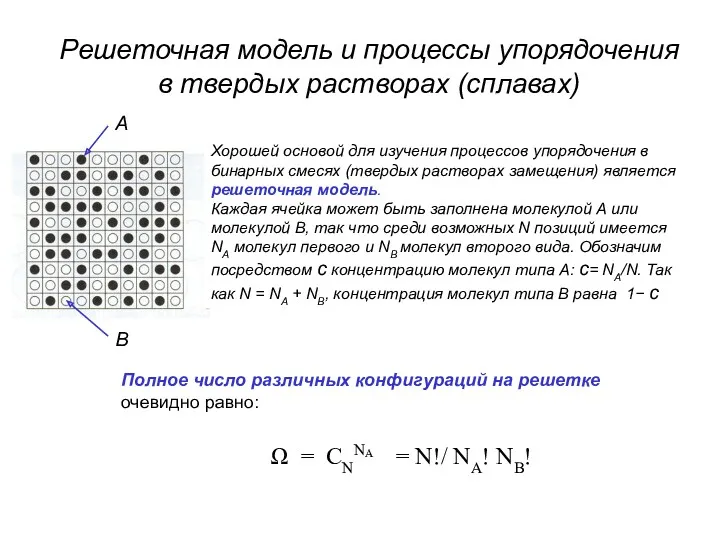
- 51. Решеточная модель и процессы упорядочения в твердых растворах (сплавах) Хорошей основой для изучения процессов упорядочения в
- 52. Энтропия системы ("энтропия смешения") может быть записана в виде S = kBlnΩ ≈ kB(N lnN −
- 53. С точки зрения энтропии компонентам выгодно перемешиваться! !!!
- 54. Для свободной энергии системы имеем: F = U − TS = U + kBT N [clnc
- 55. В случае, когда ε отрицательны и при всех температурах дают вогнутую функцию с единственным минимумом при
- 56. Свободная энергия твердого раствора
- 57. Упорядочение в сплаве β-латуни Im3m Pm3m
- 58. Термодинамика образования точечных дефектов
- 59. Равновесная концентрация точечных дефектов Ω = CNn = N!/n!(N-n)! Формула Стирлинга: lnN! ≈ N lnN
- 60. ΔS = kBlnΩ = kB {lnN! − lnn! − ln (N-n)!} ≈ ≈ kB{N lnN −
- 61. c = n/N ≈ e− E/ kT kB T = 1.4 10-16 эрг/К x 1200 К
- 63. Скачать презентацию
















































 Преобразователь I рода. Режим разрывного тока
Преобразователь I рода. Режим разрывного тока Катушка Теслы
Катушка Теслы Аэродинамика и летно-технические данные вертолёта. Тема №1. Физическая сущность необходимости постановки шарниров. ГЗ №3
Аэродинамика и летно-технические данные вертолёта. Тема №1. Физическая сущность необходимости постановки шарниров. ГЗ №3 Синергетика – новое междисциплинарное научное направление
Синергетика – новое междисциплинарное научное направление Электростатика. Электрические заряды. Конденсаторы
Электростатика. Электрические заряды. Конденсаторы Электромагнитное излучение. Свойства излучения Электромагнитное излучение, исследуемое в астрофизике
Электромагнитное излучение. Свойства излучения Электромагнитное излучение, исследуемое в астрофизике Что называют радиоактивностью?
Что называют радиоактивностью? Аэродинамика и летно-технические данные вертолёта. Тема №1. Основные летно-технические характеристики. Семинар №1
Аэродинамика и летно-технические данные вертолёта. Тема №1. Основные летно-технические характеристики. Семинар №1 Устойчивость оболочек
Устойчивость оболочек Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Магнитные цепи при постоянном магнитном потоке
Магнитные цепи при постоянном магнитном потоке Тест для 7 класса по теме Давление твердых тел, жидкостей и газов
Тест для 7 класса по теме Давление твердых тел, жидкостей и газов Напряжение шага
Напряжение шага Конкурс по физике. Исследования в области энергосбережения
Конкурс по физике. Исследования в области энергосбережения Расчет параметров объемных резонаторов волноводного типа
Расчет параметров объемных резонаторов волноводного типа Задачи обнаружения и оценивания параметров сигналов
Задачи обнаружения и оценивания параметров сигналов Атомная и ядерная физика. Лекция 1
Атомная и ядерная физика. Лекция 1 Атмосферное давление 7
Атмосферное давление 7 Поляризация света. (Тема 32)
Поляризация света. (Тема 32) Физические основы механики
Физические основы механики Основное неравенство и основное уравнение термодинамики. Понятие о термодинамических потенциалах
Основное неравенство и основное уравнение термодинамики. Понятие о термодинамических потенциалах Урок: Параллельное соединение проводников
Урок: Параллельное соединение проводников Формирование познавательных интересов у учащихся на уроках физики
Формирование познавательных интересов у учащихся на уроках физики Химия окружающей среды. Радиоактивные элементы в окружающей среде
Химия окружающей среды. Радиоактивные элементы в окружающей среде Загальні закономірності горіння рідин. Температурні межі поширення полум'я (ТМПП). Лекція 9
Загальні закономірності горіння рідин. Температурні межі поширення полум'я (ТМПП). Лекція 9 Метрология, стандартизация и сертификация. Обзорная лекция
Метрология, стандартизация и сертификация. Обзорная лекция Нанотехнологии и их применение
Нанотехнологии и их применение Решение задач по теме Электромагнитное поле
Решение задач по теме Электромагнитное поле