Содержание
- 2. Электрический Ток в металлах. Электрический ток в металлах – это упорядоченное движение электронов под действием электрического
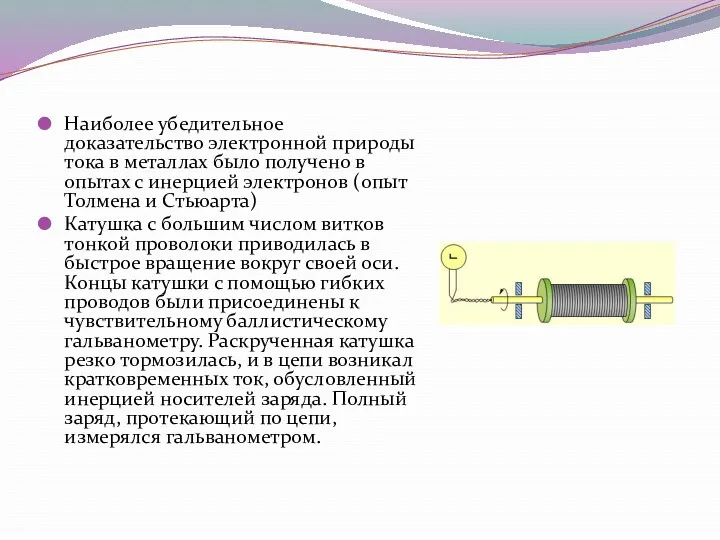
- 3. Наиболее убедительное доказательство электронной природы тока в металлах было получено в опытах с инерцией электронов (опыт
- 4. Основные законы тока в электрических проводниках ω = j • E = ϭ E² Закон Джоуля
- 5. Электрический ток в электролитах Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом
- 6. Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся
- 7. Основные Закноы электролиза Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Первый
- 8. Второй закон Фарадея электрохимические эквиваленты различных веществ относятся их химические эквиваленты : Объединенный закон Фарадея для
- 9. Электрический Ток в Газовой среде Молекулы газа в обычных условиях не проводят электрический ток. Они являются
- 10. Типы Зарядов Несамостоятельный разряд в газе, ионизованном каким-либо ионизатором, возникает в постоянном поле и существует до
- 12. Скачать презентацию








 Система работы учителя по подготовке учащихся к итоговой аттестации по физике
Система работы учителя по подготовке учащихся к итоговой аттестации по физике Установка сайлентблоков с наружной металлической обоймой
Установка сайлентблоков с наружной металлической обоймой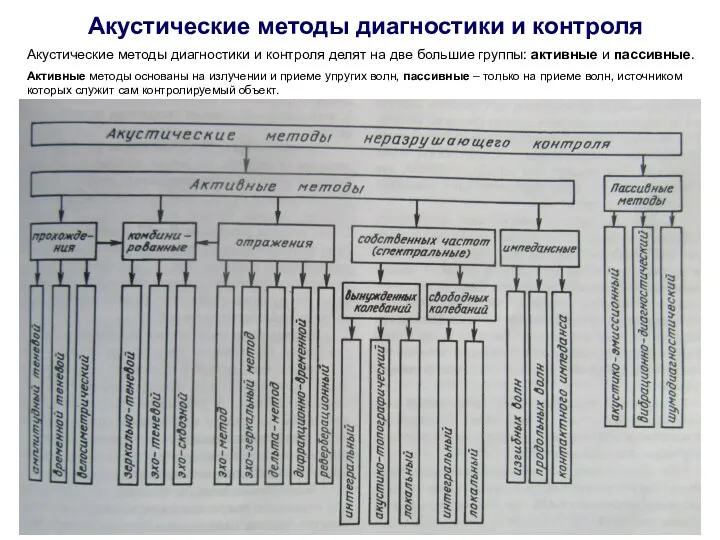 Акустические методы диагностики и контроля
Акустические методы диагностики и контроля Пневматический привод в строительных машинах
Пневматический привод в строительных машинах Оптические приборы
Оптические приборы Пространство и время в теории относительности. Космология. (Лекция 3)
Пространство и время в теории относительности. Космология. (Лекция 3) Презентация к уроку Закон Джоуля-Ленца
Презентация к уроку Закон Джоуля-Ленца Мастер-класс по теме: Плотность вещества. Определение плотности вещества
Мастер-класс по теме: Плотность вещества. Определение плотности вещества Презентация к уроку Физические величины и их измерение (7 класс)
Презентация к уроку Физические величины и их измерение (7 класс) Катушки индуктивности
Катушки индуктивности Электромагнитные волны
Электромагнитные волны Вакуумные винтовые сухие безмасляные насосы LGB
Вакуумные винтовые сухие безмасляные насосы LGB Естественное и искусственное освещение
Естественное и искусственное освещение Прогнозирование отбраковки авиационных пар трения
Прогнозирование отбраковки авиационных пар трения Презентация к уроку Реактивное движение
Презентация к уроку Реактивное движение Арнайы салыстырмалылық теориясының элементтері
Арнайы салыстырмалылық теориясының элементтері Дифракция света
Дифракция света Явление тяготения. Сила тяжести
Явление тяготения. Сила тяжести Сила давления атмосферного воздуха, опыт бургомистра Магдебурга Отто фон Герике
Сила давления атмосферного воздуха, опыт бургомистра Магдебурга Отто фон Герике Двигатели внутреннего сгорания. История и классификация
Двигатели внутреннего сгорания. История и классификация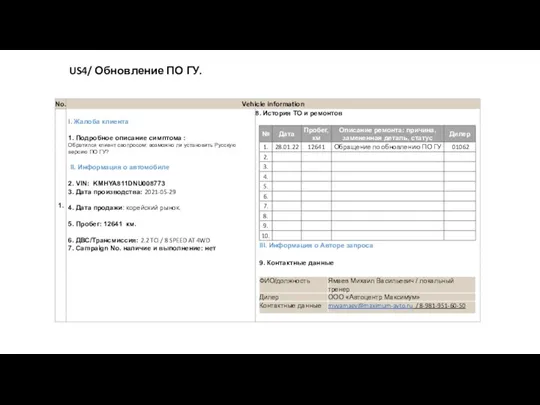 US4/ Обновление ПО ГУ
US4/ Обновление ПО ГУ Карданная передача полноприводного автомобиля КамАЗ-4310
Карданная передача полноприводного автомобиля КамАЗ-4310 Свободное движение твердого тела. (Лекция 5, Кафедра теоретической механики)
Свободное движение твердого тела. (Лекция 5, Кафедра теоретической механики) Система сходящихся сил
Система сходящихся сил Высота всасывания насоса. Условия бескавитационной работы насоса. (Лекция 8)
Высота всасывания насоса. Условия бескавитационной работы насоса. (Лекция 8) Теория решения изобретательских задач. Законы развития технических систем
Теория решения изобретательских задач. Законы развития технических систем Жарық дифракциясы. Френельдің аумақ әдісі. Жарықтың түзу сызықпен таралуы. Аумақ пластинасы
Жарық дифракциясы. Френельдің аумақ әдісі. Жарықтың түзу сызықпен таралуы. Аумақ пластинасы Принцип работы тепловых машин
Принцип работы тепловых машин