Содержание
- 2. Жидкостное травление Травлением в жидких средах (или химическим травлением) называется процесс переноса вещества из твёрдой фазы
- 3. Цели процессов химического травления удаление с оверхности полупроводниковой подложки механически нарушенного слоя; снятие с полупроводниковой подложки
- 4. Методы травления полупроводников - Изотропное травление; - Анизотропное травление; - Селективное травление; - Локальное травление; -
- 5. Изотропное травление – растворение полупроводника с одинаковой скоростью травления по всем направлениям монокристаллической подложки. Применяют для
- 6. Локальное травление – удаление материала со строго ограниченных и заданных участков подложки. Обеспечивает получение элементов требуемой
- 7. Типы растворения вещества По характеру взаимодействия с веществом химическое травление является реакцией растворения. Различают три типа
- 8. Кинетика процессов травления Все процессы травления полупроводниковых материалов являются реактивными. При этом про- цесс травления может
- 9. 1. Перенос молекул (ионов) из объёма раствора В начальный момент травления за счёт интенсивной реакции вблизи
- 10. 2. Адсорбция молекул травителя На данной стадии молекулы травителя вступают в контакт с поверхностью полупроводника. Этот
- 11. 3. Кинетическая стадия процесса. Данная стадия представляет собой собственно химическое взаимодействие адсорбированных молекул травителя с полупровод-
- 12. 4. Десорбция продуктов реакции В ходе кинетической стадии на поверхности полупроводника накапливаются продукты реакции, которые могут
- 13. 5. Удаление продуктов реакции в объём раствора Вблизи поверхности полупроводника накапливаются продукты реакции, концентрация которых в
- 14. Травление с диффузионным контролем В данном случае скорость процесса травления никак не связана со свойствами поверхности
- 15. Травление с кинетическим контролем Скорость травления будет различной для плоскостей кристаллов с различной плотностью упаковки атомов,
- 16. Механизмы травления полупроводников При отсутствии электрического поля травление полупроводников в жидких средах может происходить по двум
- 17. Особенности химического механизма травления При химическом механизме травления на поверхности полупроводника протекают окислительно–восстановительные реакции,обусловленные непосредственным, чисто
- 18. Травление кремния в щёлочи Si + 2H2O → SiO2 + 2H2↑; (31.1) SiO2 + xH2O →
- 19. Особенности электрохимического механизма травления При электрохимическом механизме травления на поверхности полупроводника протекают две сопряжённые реакции: анодного
- 20. Анодные реакции На микроанодах поверхности протекает анодная реакция окисления кремния, а также комплексообразование и перевод в
- 21. Катодные реакции На микрокатодах поверхности протекает катодная реакция восстановления основного окислителя (HNO3): HNO3 + 2H+ +
- 22. Режимы электрохимического травления В зависимости от самой медленной стадии различают травление под катодным контролем и анодным
- 23. Материалы, подвергаемые травлению В качестве материалов, наиболее часто подвергаемых травлению «мокрыми» процессами, выступают различные функциональные слои
- 24. Травление слоёв SiO2 Для химического травления слоев SiO2 используют, как правило, травители на основе HF. Однако
- 25. Травление нитрида кремния Химическое травление применяют для полного удаления слоев Si3N4 после процессов локального окисления. Для
- 26. Травление плёнок алюминия Жидкостное химическое травление алюминиевых слоев осуществляют, как правило, в травителе, состоящем из концентрированной
- 27. Жидкостное удаление фоторезиста Выбор метода снятия резиста и параметров процесса определяется исходя из следующих факторов: 1)
- 28. Удаление фоторезиста в кислотных составах На стадиях формирования активной структуры ИИЭ в фотолитографическом процессе участвуют химически
- 29. Удаление фоторезиста в кислотных растворителях На заключительных стадиях изготовления ИИЭ (формирование металлических слоев, вскрытие контактных окон
- 30. Недостатки жидкостного химического травления – капиллярные процессы в тонких щелях и проколах; – проблемы адгезии фоторезистивных
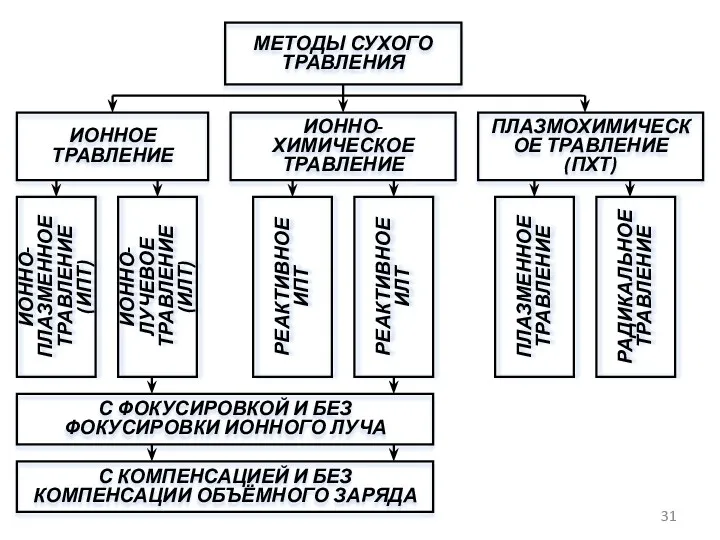
- 31. МЕТОДЫ СУХОГО ТРАВЛЕНИЯ ИОННОЕ ТРАВЛЕНИЕ ИОННО-ХИМИЧЕСКОЕ ТРАВЛЕНИЕ ПЛАЗМОХИМИЧЕСКОЕ ТРАВЛЕНИЕ (ПХТ) ИОННО-ПЛАЗМЕННОЕ ТРАВЛЕНИЕ (ИПТ) ИОННО-ЛУЧЕВОЕ ТРАВЛЕНИЕ (ИЛТ)
- 32. Особенности ионного травления При ионном травлении для удаления материала используется кинетическая энергия ионов инертных газов, т.е.
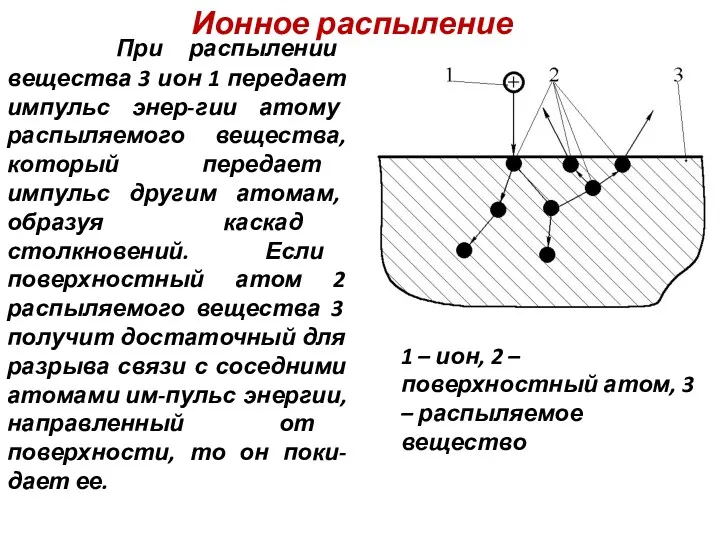
- 33. Ионное распыление При распылении вещества 3 ион 1 передает импульс энер-гии атому распыляемого вещества, который передает
- 34. Коэффициент распыления Эффективность процесса ионного распыления характеризуется коэффициентом распыления, который определяется числом удаленных частиц распыляемого вещества,
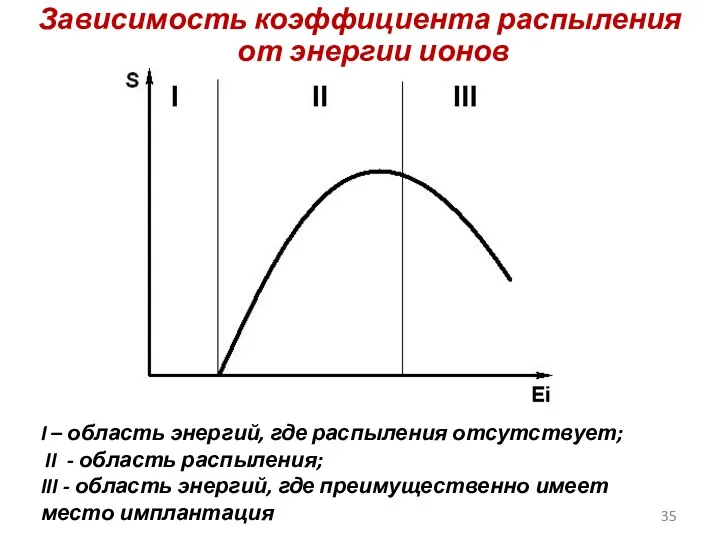
- 35. Зависимость коэффициента распыления от энергии ионов I – область энергий, где распыления отсутствует; II - область
- 36. Особенности ионно-химического травления При ионно–химическом травлении используется как кинетическая энергия ионов химически активных газов, так и
- 37. Особенности плазмохимического травления При ПХТ для удаления материала используется энергия химических реакций между ионами и радикалами
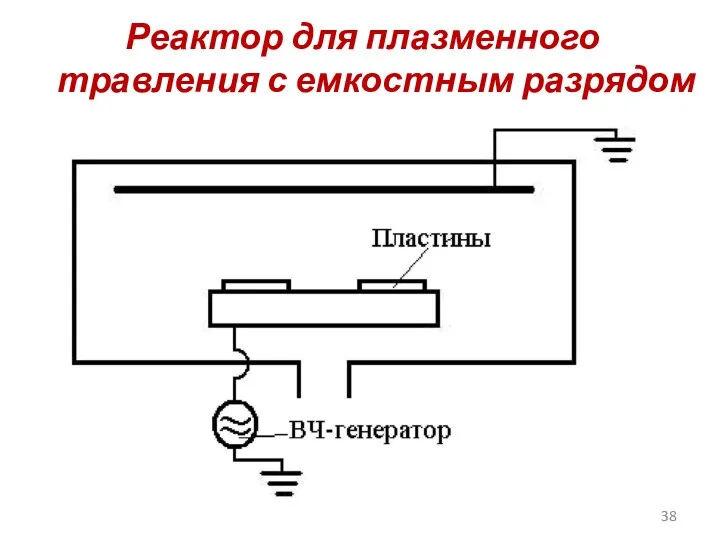
- 38. Реактор для плазменного травления с емкостным разрядом
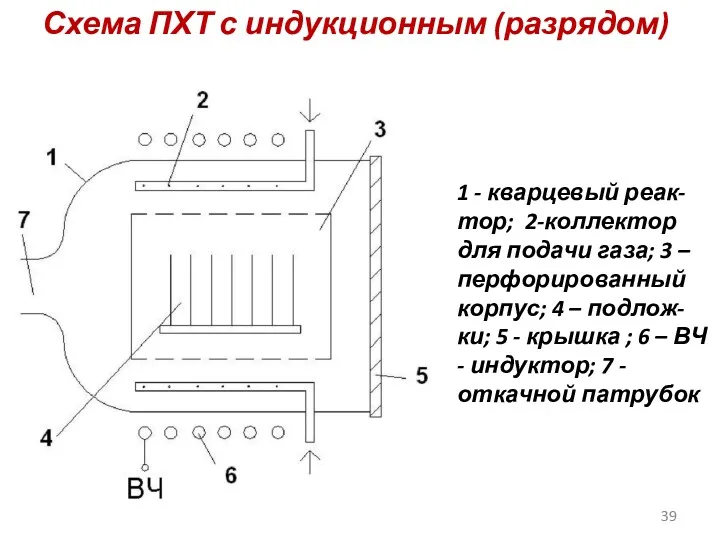
- 39. Схема ПХТ с индукционным (разрядом) 1 - кварцевый реак-тор; 2-коллектор для подачи газа; 3 – перфорированный
- 40. Процессы, протекающие в плазме Процессы, протекающие в плазме очень сложны и состоят из элементарных реакций между
- 41. Явления в газовых разрядах Возникновение ионов, атомов, радикалов Простая ионизация: Ar + e → Ar+ +
- 42. Кинетика ПХТ В общем случае кинетика состоит из следующих стадий: 1. Доставка молекул активного газа в
- 43. Основные параметры процессов травления Скорость травления Равномерность травления Селективность травления Анизотропия травления
- 44. Скорость травления d0 - исходная толщина слоя; d1 - конечная толщина слоя; t - время травления.
- 45. Равномерность травления Скорость травления, как правило, неоднородна по площади пластины и лежит в пределах , где
- 46. Селективность травления На практике все материалы, контактирующие с травителем, характеризуются конечным временем травления. Селективность (избирательность) –
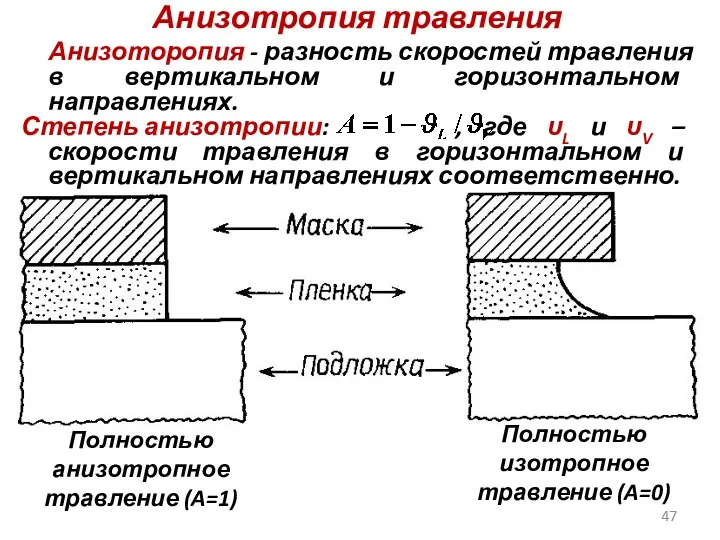
- 47. Анизотропия травления Анизоторопия - разность скоростей травления в вертикальном и горизонтальном направлениях. Степень анизотропии: , где
- 48. Сравнительные характеристики методов сухого травления
- 49. Пути повышения анизотропии ПХТ Чистое ПХТ при отсутствии каких-либо кристаллографических эффектов является изотропным. Для получения анизотропии
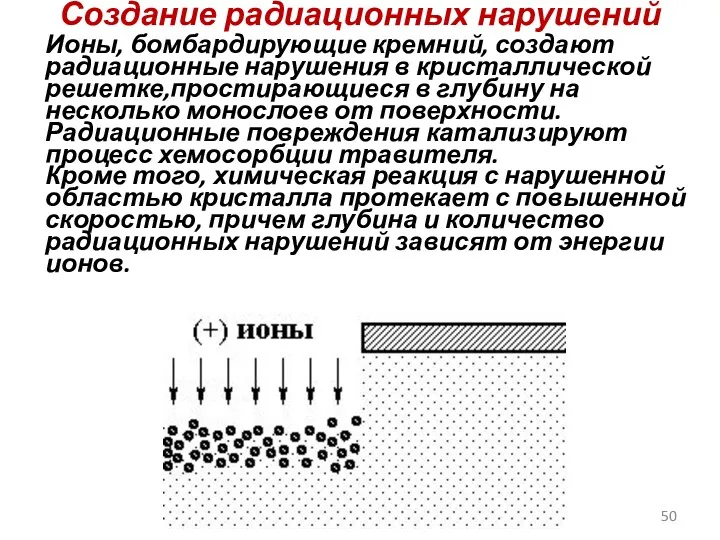
- 50. Создание радиационных нарушений Ионы, бомбардирующие кремний, создают радиационные нарушения в кристаллической решетке,простирающиеся в глубину на несколько
- 51. Формирование пассивирующего слоя на боковых стенках Определенные газы (например, CHF3, CClF3) или смесигазов (CF4-H2) распадаются в
- 52. БОШ – процесс Для глубокого анизотропного травления используют так называемый БОШ–процесс, который представляет собой чередование двух
- 53. Травление кремния Плазмохимическое травление кремния осуществляют во фторсодержащей плазме. Атомы фтора реагируют с кремнием n и
- 54. ПХТ слоёв SiO2 Используемые газы: C3F8, CHF3, O2, He. C3F8 диссоциирует, образуя химически активные радикалы CFX,
- 55. ПХТ слоёв Si3N4 Используемые газы: SF6, He. Травление осуществляется атомами фтора, которые освобождаются в плазме гексафторида
- 56. ПХТ алюминия Используемые газы: BCl3, Cl2, SiCl4, He. Травление алюминия осуществляется в плазмообразующей смеси BCl3 +
- 57. Улучшение эффективности удаления Al2O3 Процесс травления проводится в две стадии: - первые 60 секунд процесса (индукционный
- 58. Анизотропия процесса Добавка в газовую смесь SiCl4 производится для исключения бокового подтравливания под маску фоторезиста. После
- 59. Удаление фоторезиста Основным газом для «сухого» удаления резиста в плазме является кислород. При микроволновом возбуждении кислорода
- 61. Скачать презентацию



















































 Кривошипно- шатунный механизм
Кривошипно- шатунный механизм Исследование колебаний маятников различных видов
Исследование колебаний маятников различных видов История радиосвязи
История радиосвязи презентация Чудеса света
презентация Чудеса света Электромагнитная индукция
Электромагнитная индукция Презентация Дорога человечества в космос
Презентация Дорога человечества в космос Открытый урок по теме Молекулярная физика
Открытый урок по теме Молекулярная физика Определение предмета биофизики
Определение предмета биофизики Сила трения. Трение в природе и технике
Сила трения. Трение в природе и технике Защита от грозовых и коммутационных перенапряжений
Защита от грозовых и коммутационных перенапряжений Магнит өрісіндегі тогы бар контур
Магнит өрісіндегі тогы бар контур Магнитное поле и его графическое изображение
Магнитное поле и его графическое изображение Биохимический анализ. Фотометрия. Основные принципы
Биохимический анализ. Фотометрия. Основные принципы Физика. Разделы физики
Физика. Разделы физики урок по теме плотность вещества
урок по теме плотность вещества Техническое обслуживание и ремонт систем энергообеспечения и запуска двигателя
Техническое обслуживание и ремонт систем энергообеспечения и запуска двигателя Антенні та фідерні пристрої ЗРЛ. Загальні відомості і принцип дії фідерних пристроїв. (Тема 3.1)
Антенні та фідерні пристрої ЗРЛ. Загальні відомості і принцип дії фідерних пристроїв. (Тема 3.1) Допуски, посадки и контроль шлицевых соединений деталей
Допуски, посадки и контроль шлицевых соединений деталей Аэродинамика и летно-технические данные вертолёта. Тема №1. Основные летно-технические характеристики. Семинар №1
Аэродинамика и летно-технические данные вертолёта. Тема №1. Основные летно-технические характеристики. Семинар №1 Общие сведения о направляющих системах
Общие сведения о направляющих системах Расчет режимов электрических сетей
Расчет режимов электрических сетей Действие жидкости и газа на погруженное в них тело
Действие жидкости и газа на погруженное в них тело Элементарные частицы
Элементарные частицы Техническое обслуживание и ремонт тормозной системы трактора
Техническое обслуживание и ремонт тормозной системы трактора Раздел 1. Акустические преобразователи. Классификация
Раздел 1. Акустические преобразователи. Классификация Теплоотдача при поперечном обтекании труб
Теплоотдача при поперечном обтекании труб Режущий инструмент. Основные функции. Основы теории режущих инструментов
Режущий инструмент. Основные функции. Основы теории режущих инструментов Эксергия. Термодинамические процессы в газах, парах и их смесях. (Занятие 4)
Эксергия. Термодинамические процессы в газах, парах и их смесях. (Занятие 4)