Виникнення процесу горіння. Самозаймання речовин та матеріалів. Особливості самозаймання. Хімічне самозаймання. (Розділ 2.5.8) презентация
Содержание
- 2. План лекції 1. Особливості самозаймання. Класифікація процесів самозаймання. 2. Умови, які необхідні для виникнення самозаймання. 3.
- 3. 1. ОСОБЛИВОСТІ САМОЗАЙМАННЯ. КЛАСИФІКАЦІЯ ПРОЦЕСІВ САМОЗАЙМАННЯ Самозаймання - процес виникнення горіння за рахунок різкого збільшення швидкості
- 4. Відмінності процесу самозаймання від самоспалахування 1) нагрів системи ззовні відсутній Для виникнення самозаймання необхідне виконання певних
- 5. 2) горіння виникає не в усій системі, як при СС, а тільки в частині горючої системи,
- 6. Залежно від природи первинного теплового імпульсу самонагрівання розрізнюють чотири види самозаймання: - мікробіологічне (первинне тепловиділен-ня обумовлено
- 7. 2. УМОВИ, ЯКІ НЕОБХІДНІ ДЛЯ ВИНИКНЕННЯ САМОЗАЙМАННЯ Критична умова виникнення СЗ: q(+) = q(-) де Sок
- 8. Параметрами, що характеризують процес самозаймання, є критична температура – температура самонагріванн і час індукції. q(+) ↑
- 9. - теплофізичні характеристики матеріалу (теплоємність ср, теплопровідність λ); ср , λ ↑ q(-) ↑ Tсн ↑
- 10. Хімічним називається самозаймання, яке виникає внаслідок взаємодії речовин, реагуючих з виділенням тепла. Залежно від характеру окислювача,
- 11. 3.1. Хімічне самозаймання при контакті речовин з киснем повітря Речовини, які самозаймаються при контакті з повітрям
- 12. Самозаймання сірчистого заліза FeS, FeS2, Fe2S3 В природі: сульфід заліза FeS2 (сірчаний колчедан або пірит) знаходиться
- 13. В технологічній апаратурі утворюється FeS або Fe2S3 внаслідок взаємодії металевих конструкцій з сіркою S або H2S:
- 14. БОРОТЬБА З САМОЗАЙМАННЯМ СУЛЬФІДІВ ЗАЛІЗА 1) очищення від сірководню Н2S продукту, що зберігається; 2) обробка антикорозійним
- 15. САМОЗАЙМАННЯ ЖИРІВ І ОЛІЙ За походженням жири і масла поділяють: мінеральні, рослинні, тваринні. Мінеральні - суміш
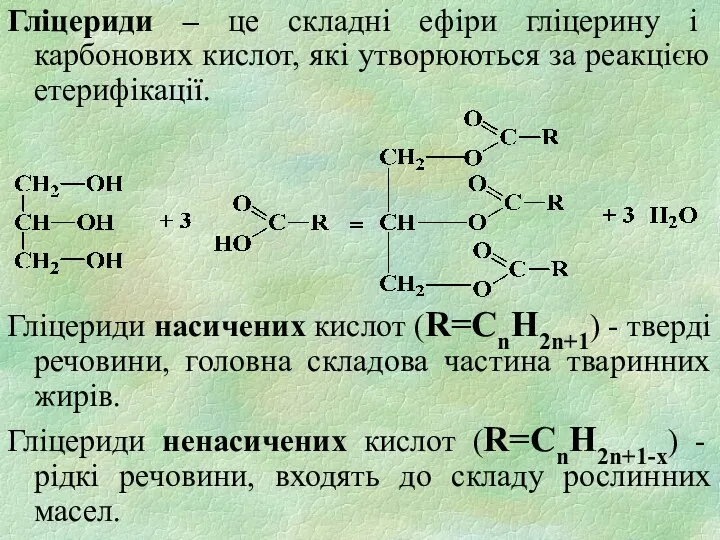
- 16. Гліцериди – це складні ефіри гліцерину і карбонових кислот, які утворюються за реакцією етерифікації. Гліцериди насичених
- 17. Самозаймання відбувається за рахунок тепловиділення при протіканні реакцій окислення і полімеризації, що відбуваються по місцю ненасичених
- 18. Схильність олії до самозаймання обумовлена наявністю достатньої кількості ненасичених зв'язків. Схильність олії до самозаймання можна визначити
- 19. Умови самозаймання жирів: 1) вміст значної кількості гліцеридів ненасичених кислот; 2) наявність великої поверхні окислення і
- 20. 3.2. ХІМІЧНЕ САМОЗАЙМАННЯ РЕЧОВИН ПРИ КОНТАКТІ З ВОДОЮ Реакції супроводжуються виділенням тепла, під впливом якого займаються
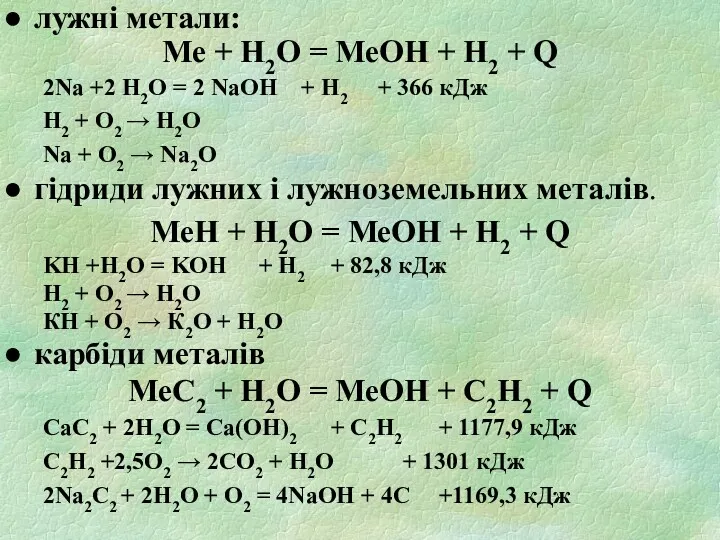
- 21. лужні метали: Ме + H2O = МеOH + H2 + Q 2Na +2 H2O = 2
- 22. оксиди і пероксиди металів МеО + H2O = МеOH + Q МеО2 + H2O = МеOH
- 23. металоорганічні сполуки реагують з водою, утворюючи горючі гази і велику кількість тепла: Be(CH3)2 + 2H2O =
- 24. 3.3. САМОЗАЙМАННЯ РЕЧОВИН ПРИ КОНТАКТІ З ХІМІЧНИМИ ОКИСНИКАМИ Розрізняють три підкласи самозаймання речовин при контакті з
- 25. Стиснутий кисень - енергійний окисник, який викликає СЗ речовин, які не самозайма-ються в кисні за нормальних
- 26. Рідкі окисники (Н2О2, HNO3, HMnO4, HClO3, HClO4 ) 4HNO3 = 2H2O + 4NO2 + O2 H2S
- 27. Такі окисники як селітри, хлорати, перхлорати лужних металів є небезпечними, якщо вони знаходяться в контакті з
- 29. Скачать презентацию






















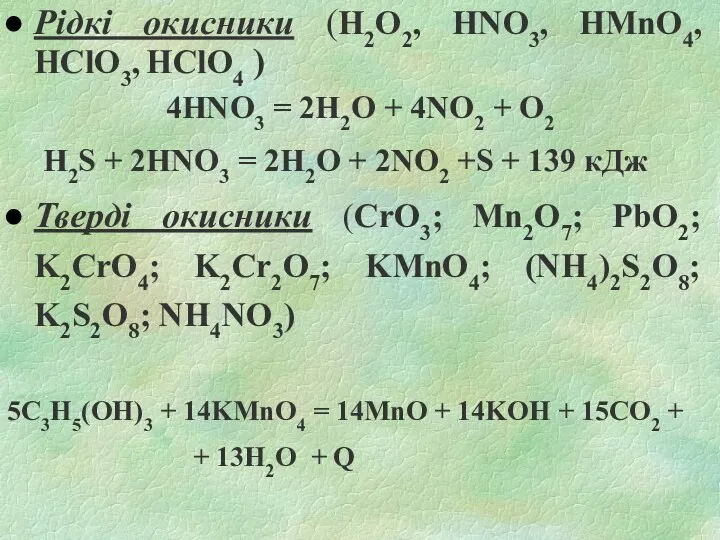

 Взаимодействие излучения с полупроводниками
Взаимодействие излучения с полупроводниками Диффузия. Распространение запахов
Диффузия. Распространение запахов Пр-во, передача и исп-е эл. энергии
Пр-во, передача и исп-е эл. энергии Деятельностный подход к обучению или Урок открытия нового знания
Деятельностный подход к обучению или Урок открытия нового знания Закон прямолинейного распространения света. Солнечные и Лунные затмения
Закон прямолинейного распространения света. Солнечные и Лунные затмения Заземляющие устройства в эл. сетях. Методика их расчета
Заземляющие устройства в эл. сетях. Методика их расчета Електричні двигуни
Електричні двигуни Проек по теме Молния
Проек по теме Молния Инфракрасная спектроскопия
Инфракрасная спектроскопия Системы переменного тока на вертолёте МИ-8МТВ-1
Системы переменного тока на вертолёте МИ-8МТВ-1 Технология RFID
Технология RFID Сферическое движение
Сферическое движение Изучение механизмов и их работа Тема: Повторение тем
Изучение механизмов и их работа Тема: Повторение тем Зубчатые передачи с зацеплением
Зубчатые передачи с зацеплением Колесные пары. Устройство и ремонт тепловозов
Колесные пары. Устройство и ремонт тепловозов Методы и техника исследований и измерений характеристик ТЭП, ЭГЭ, ЭГК на предреакторной и реакторной экспериментальных базах
Методы и техника исследований и измерений характеристик ТЭП, ЭГЭ, ЭГК на предреакторной и реакторной экспериментальных базах Жарықтың жұтылуы (абсорбция)
Жарықтың жұтылуы (абсорбция) Конические зубчатые передачи
Конические зубчатые передачи Раздаточная коробка передач в автомобиле
Раздаточная коробка передач в автомобиле Термодинамика. Идеальный газ. Законы идеального газа
Термодинамика. Идеальный газ. Законы идеального газа Механическая работа. Мощность
Механическая работа. Мощность Законы сохранения в механике
Законы сохранения в механике Тема №4. Электрооборудование. Занятие №1. Общее устройство электрооборудования
Тема №4. Электрооборудование. Занятие №1. Общее устройство электрооборудования Колебания и волны. Тема 5
Колебания и волны. Тема 5 Электромагнитная индукция
Электромагнитная индукция Электрическое поле в вакууме
Электрическое поле в вакууме Метод гидро- и сольвотермального синтеза
Метод гидро- и сольвотермального синтеза Электрический ток в газах
Электрический ток в газах