Содержание
- 2. Предмет и основные понятия термодинамики и молекулярной физики Термодинамика изучает общие тепловые свойства макроскопических систем, т.е.
- 3. Предмет и основные понятия термодинамики и молекулярной физики Равновесным состоянием называется состояние макроскопической системы, в котором
- 4. Идеальный газ Идеальный газ – физическая модель реального газа, представляющая собой совокупность большого числа материальных точек,
- 5. Термодинамические параметры газа . 1 Термодинамическая температура – физическая величина, показывающая степень нагретости тел и являющаяся
- 6. Термодинамические параметры газа 4 Плотность – физическая величина, численно равная массе вещества в единицу объема: В
- 7. Термодинамические параметры газа 6 Концентрация характеризует количество частиц в единице объема вещества: . В СИ концентрация
- 8. Термодинамические параметры газа Количество вещества определяется отношением массы m вещества к его молярной массе μ или
- 9. Термодинамические параметры газа 9 Число Авогадро показывает количество частиц в одном моле вещества или в углероде
- 10. Уравнение состояния идеального газа Уравнение состояния идеального газа связывает между собой основные термодинамические параметры газа. Экспериментально
- 11. Уравнение состояния идеального газа Уравнение состояния можно записать через другие термодинамические параметры: 1 Так как ,
- 12. Уравнение состояния идеального газа 4 По определению концентрации: , следовательно: , где – постоянная Больцмана, которая
- 13. Обобщенный газовый закон Уравнение Менделеева-Клапейрона массы газа запишется в виде: для неизменной Точное значение постоянной в
- 14. Обобщенный газовый закон Для любой, но постоянной, массы газы из уравнения Менделеева-Клапейрона получаем обобщенный газовый закон:
- 15. Изопроцессы. Газовые законы Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры,
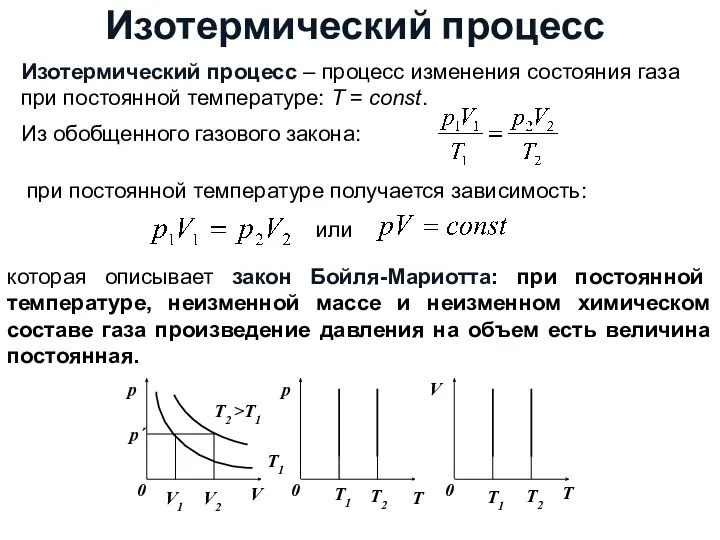
- 16. Изотермический процесс Изотермический процесс – процесс изменения состояния газа при постоянной температуре: Τ = const. Из
- 17. Изобарный процесс Изобарный процесс – процесс изменения состояния газа при постоянном давлении: p = const. Из
- 18. Изохорный процесс Изохорный процесс – процесс изменения состояния газа при постоянном объеме: V = const. Из
- 20. Скачать презентацию
















 Примеры задач к курсу Гидропривод
Примеры задач к курсу Гидропривод Компенсация реактивной мощности. Синхронные двигатели. Лекция 05
Компенсация реактивной мощности. Синхронные двигатели. Лекция 05 Полный привод Audi quattro
Полный привод Audi quattro Прямолинейное равноускоренное движение
Прямолинейное равноускоренное движение A4CFx – New Alpha. Power Train Variation Engine
A4CFx – New Alpha. Power Train Variation Engine Светодиоды. Светодиодные лампы или светодиодные светильники
Светодиоды. Светодиодные лампы или светодиодные светильники Фізика як наука
Фізика як наука Об открытии закона Архимеда.
Об открытии закона Архимеда. Общие сведения о деталях машин
Общие сведения о деталях машин Основы расчета реакторов
Основы расчета реакторов Асинхронные генераторы
Асинхронные генераторы Простые механизмы
Простые механизмы Электроразведка. Электрическое и магнитное поля
Электроразведка. Электрическое и магнитное поля Гидравлический пресс
Гидравлический пресс Инструкция пользователя MyKia 2. 0
Инструкция пользователя MyKia 2. 0 Способы соединения жил кабелей
Способы соединения жил кабелей Физика в баскетболе
Физика в баскетболе “Положение тела в пространстве”
“Положение тела в пространстве” Фізика у XVII столітті
Фізика у XVII столітті Пластыкалық қалдықтар
Пластыкалық қалдықтар Урок-презентация по теме Звуковой барьер
Урок-презентация по теме Звуковой барьер Магнит өрісі. Магнит индукция векторы
Магнит өрісі. Магнит индукция векторы Автоматизация производственных процессов в машиностроении
Автоматизация производственных процессов в машиностроении Введение в Физику
Введение в Физику Презентация по теме Сила тока
Презентация по теме Сила тока Резьбовые соединения (РС)
Резьбовые соединения (РС) Geely atlas
Geely atlas Основы триботехники. Лекция 1
Основы триботехники. Лекция 1