Содержание
- 2. КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ КЩР определенное соотношение концентрации протонов водорода Н+ и гидроксильных анионов (ОН-) в биологических
- 3. КОНЦЕНТРАЦИЯ Н+ ВО ВНЕКЛЕТОЧНОЙ ЖИДКОСТИ СОСТАВЛЯЕТ ОДНУ МИЛЛИОННУЮ ОТ СОДЕРЖАНИЯ НАТРИЯ Врачи, как правило, соглашаются с
- 4. ЗНАЧЕНИЕ ПОСТОЯНСТВА КЩР ДЛЯ ОРГАНИЗМА 1) рН определяет физикохимические свойства коллоидных структур 2) рН определяет активность,
- 5. ПОСЛЕДСТВИЯ СДВИГА РН+ В ТУ ИЛИ ИНУЮ СТОРОНУ сдвиг рН на одну десятую (0,1) от
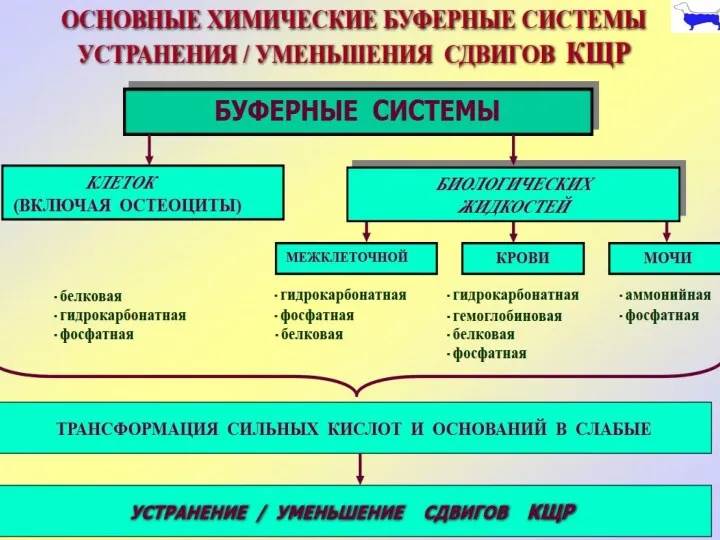
- 6. МЕХАНИЗМЫ ПОДДЕРЖАНИЯ КЩР Выделяют два основных механизма, обеспечивающих уравновешивание кислых ионов: 1. Химические буферные системы крови
- 7. ХИМИЧЕСКИЕ БУФЕРНЫЕ СИСТЕМЫ КРОВИ И ТКАНЕЙ
- 8. ГИДРОКОРБОНАТНЫЙ БУФЕР [H+]=24×(pCO2):[HCO3-] УРАВНЕНИЕ Гендерсона-Хассельбаха =
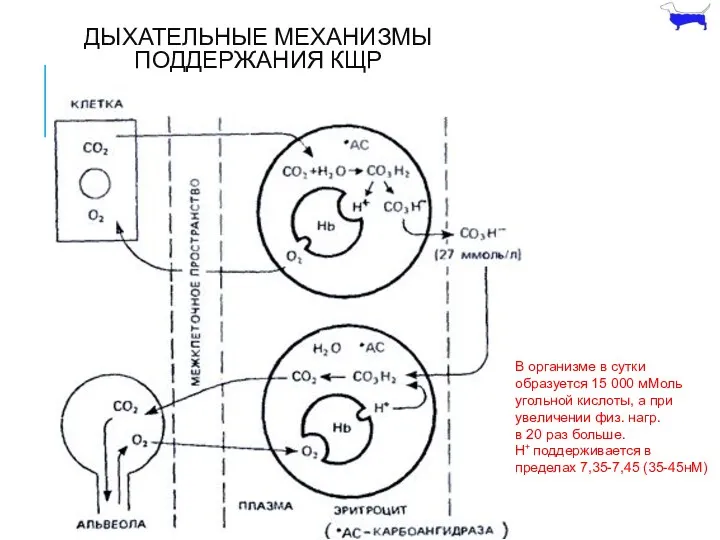
- 9. ДЫХАТЕЛЬНЫЕ МЕХАНИЗМЫ ПОДДЕРЖАНИЯ КЩР В организме в сутки образуется 15 000 мМоль угольной кислоты, а при
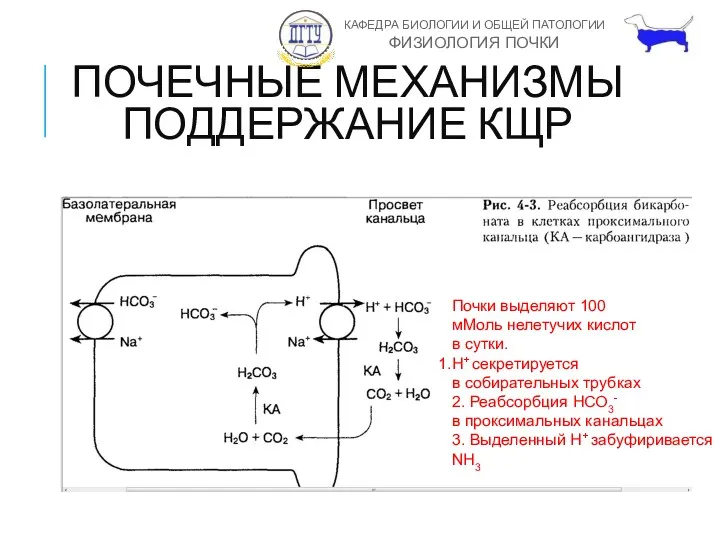
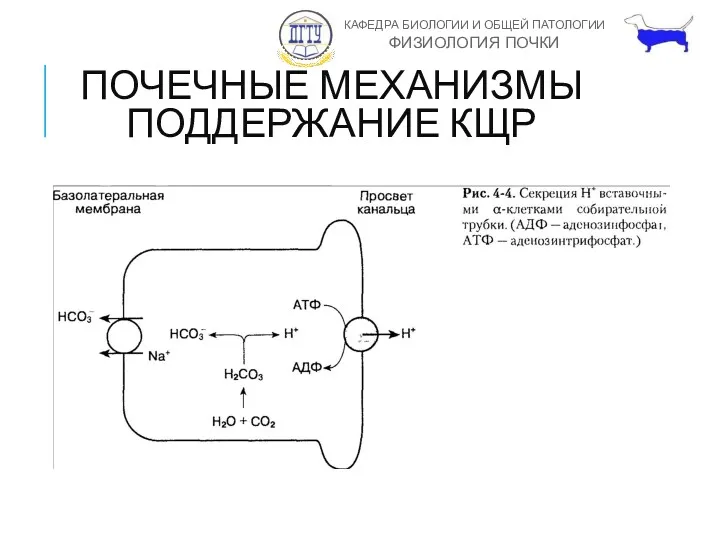
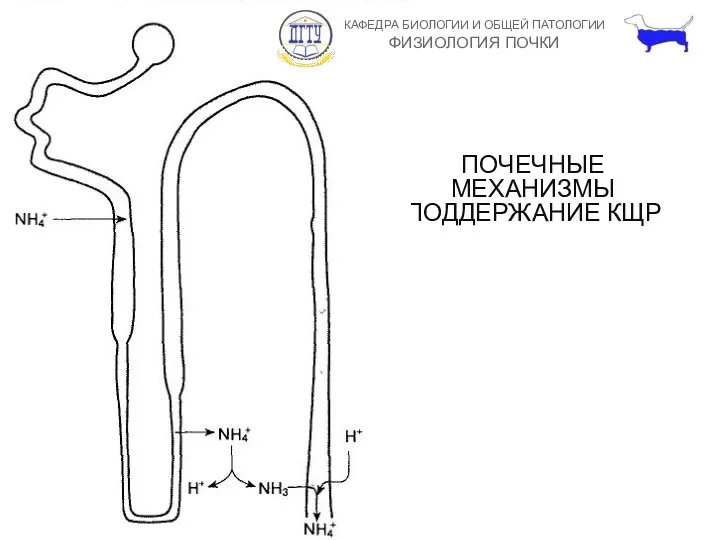
- 10. ПОЧЕЧНЫЕ МЕХАНИЗМЫ ПОДДЕРЖАНИЕ КЩР Почки выделяют 100 мМоль нелетучих кислот в сутки. H+ секретируется в собирательных
- 11. ПОЧЕЧНЫЕ МЕХАНИЗМЫ ПОДДЕРЖАНИЕ КЩР
- 12. ПОЧЕЧНЫЕ МЕХАНИЗМЫ ПОДДЕРЖАНИЕ КЩР
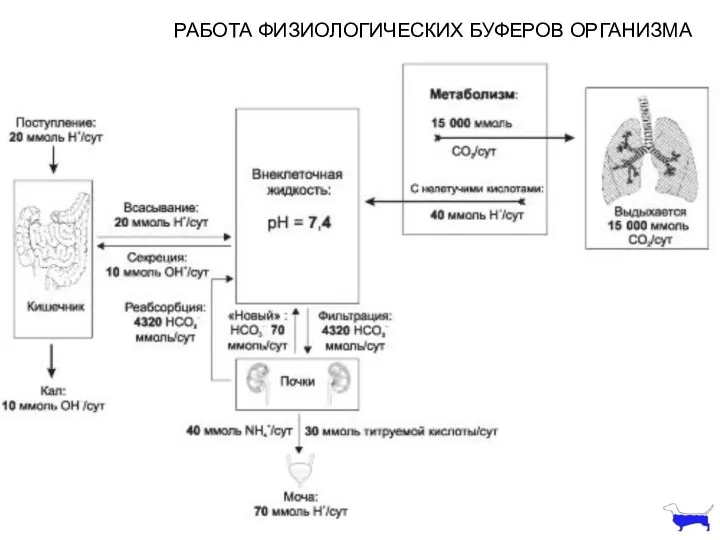
- 13. РАБОТА ФИЗИОЛОГИЧЕСКИХ БУФЕРОВ ОРГАНИЗМА
- 14. КИСЛОТНОСТЬ (PH) pH 7,4±0,04 (норма) 7,36-7,44 Ацидоз (ацидемия) pH Алкалоз (алкалемия) pH>7,45 4!
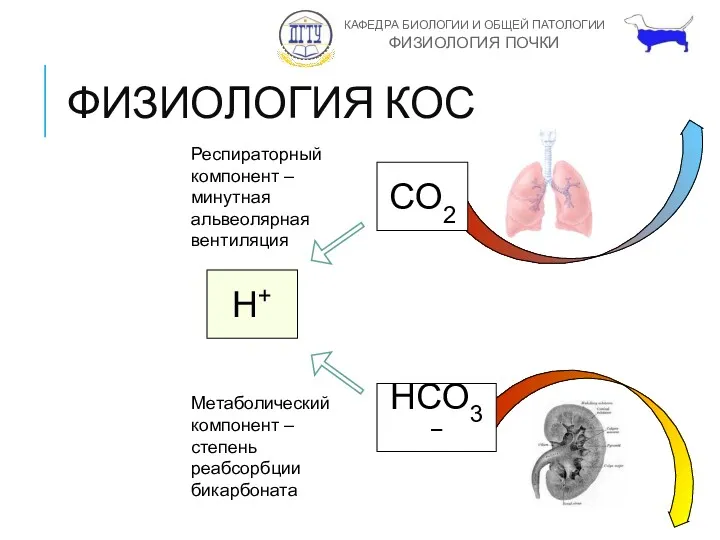
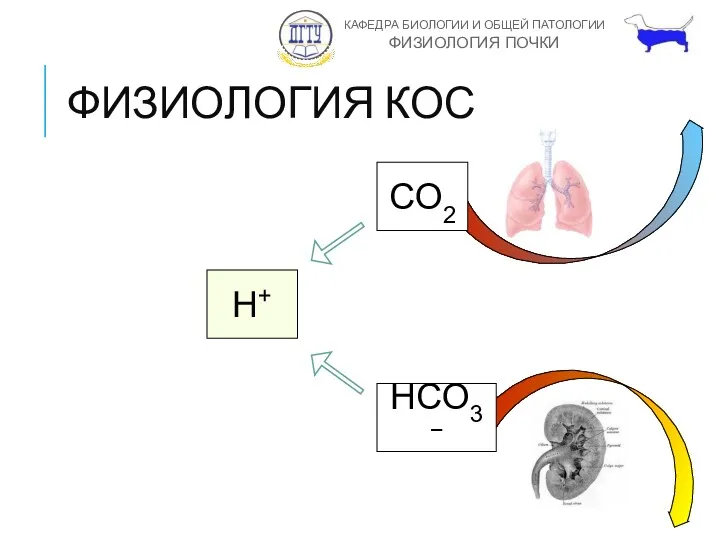
- 15. ФИЗИОЛОГИЯ КОС CO2 H+ HCO3− Респираторный компонент – минутная альвеолярная вентиляция Метаболический компонент – степень реабсорбции
- 16. ФИЗИОЛОГИЯ КОС CO2 H+ HCO3−
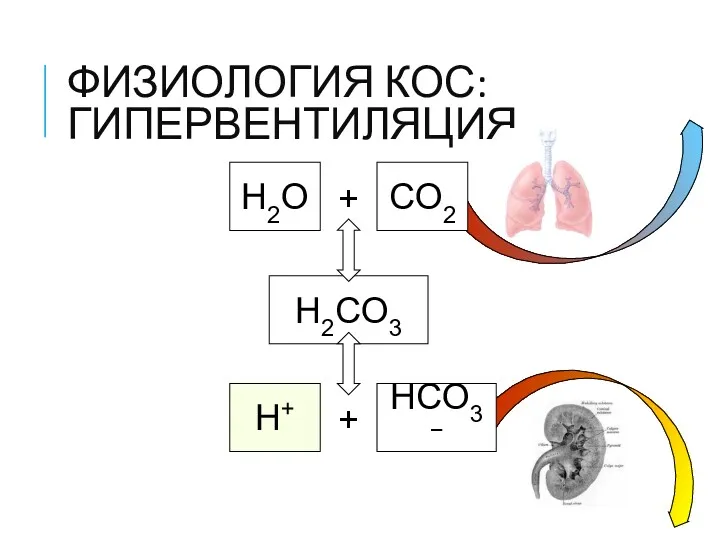
- 17. ФИЗИОЛОГИЯ КОС: ГИПЕРВЕНТИЛЯЦИЯ H2O + CO2 H2CO3 H+ + HCO3−
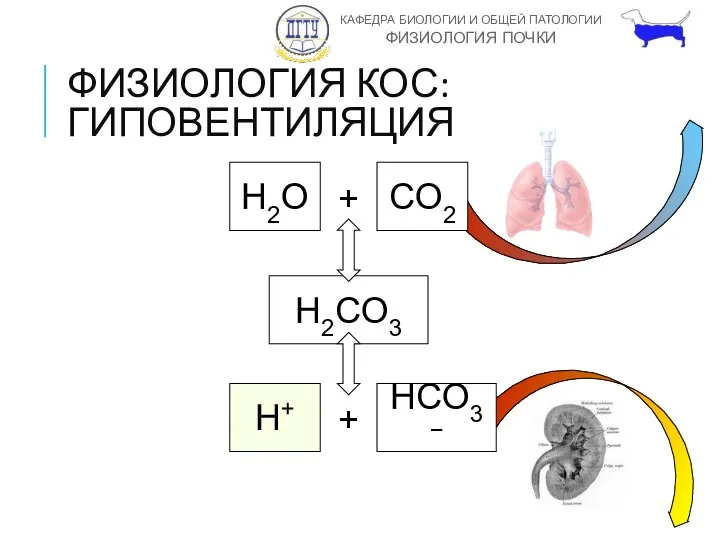
- 18. ФИЗИОЛОГИЯ КОС: ГИПОВЕНТИЛЯЦИЯ H2O + CO2 H2CO3 H+ + HCO3−
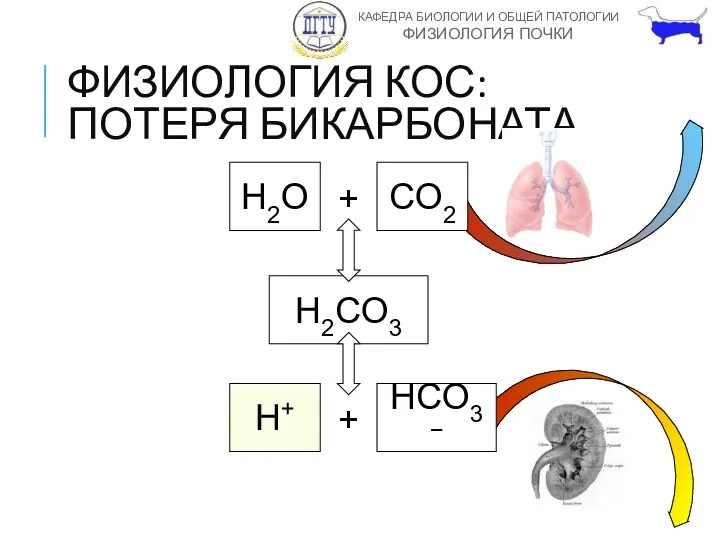
- 19. ФИЗИОЛОГИЯ КОС: ПОТЕРЯ БИКАРБОНАТА H2O + CO2 H2CO3 H+ + HCO3−
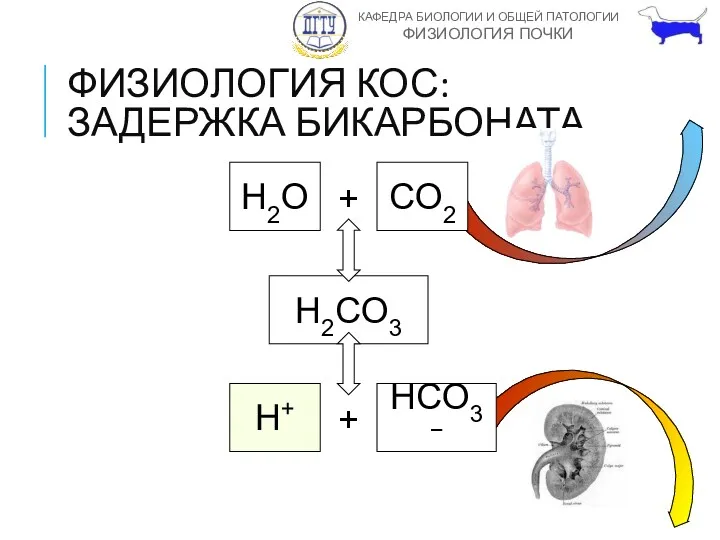
- 20. ФИЗИОЛОГИЯ КОС: ЗАДЕРЖКА БИКАРБОНАТА H2O + CO2 H2CO3 H+ + HCO3−
- 21. Бикарбонат – это сода (щелочная реакция) Протоны H+ - это кислота их источник в том числе
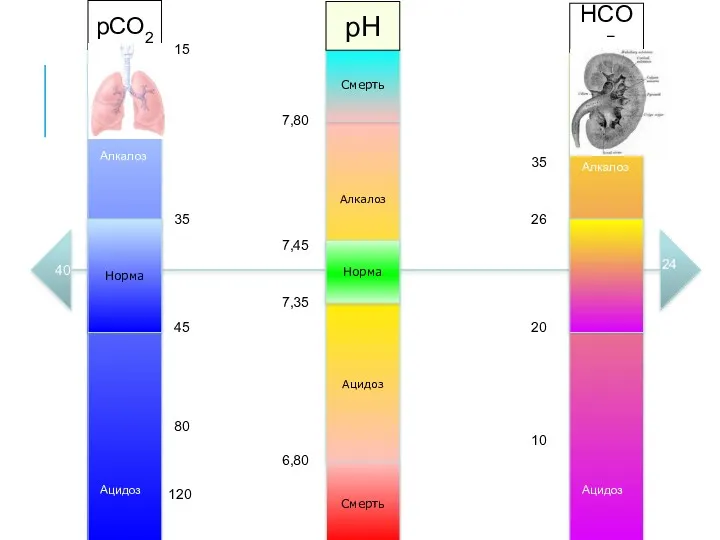
- 22. НОРМЫ pH 7,4±0,04 pCO2 40±4 мм рт. ст. HCO3− 24±4 ммоль/л 4!
- 23. РЕСПИРАТОРНЫЙ КОМПОНЕНТ: ВЕНТИЛЯЦИЯ Оценивается по CO2 Прямо пропорциональна минутной альвеолярной вентиляции (л/мин) Чем больше вентилиция, тем
- 24. МЕТАБОЛИЧЕСКИЙ КОМПОНЕНТ: КОНЦЕНТРАЦИЯ БИКАРБОНАТА Оценивается по HCO3- и BE (щелочной резерв) Зависит от: Реабсорбции/задержки бикарбоната почками
- 25. ФИЗИОЛОГИЯ НАРУШЕНИЯ КОС Первичное нарушение приводит к сдвигу pH Вторичное нарушение является компенсаторным, направлено в противоположную
- 26. ПОНЯТИЕ КОМПЕНСАЦИИ И ДЕКОМПЕНСАЦИИ Компенсация – pH в норме, а pCO2 и HCO3− изменены - хронический
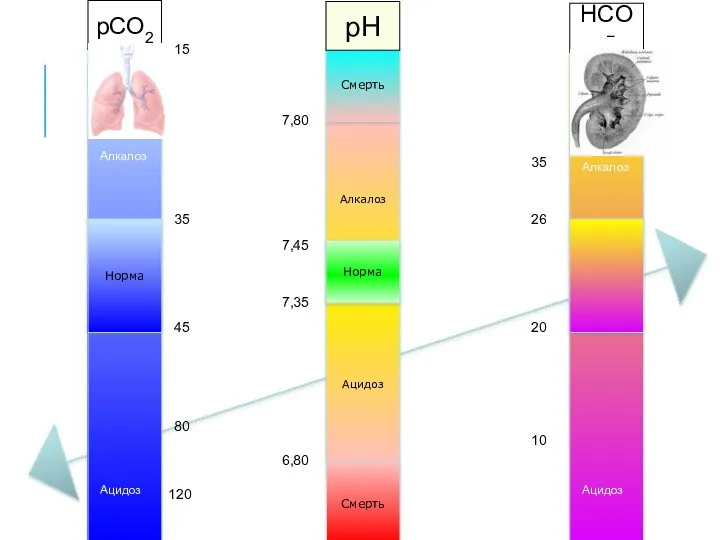
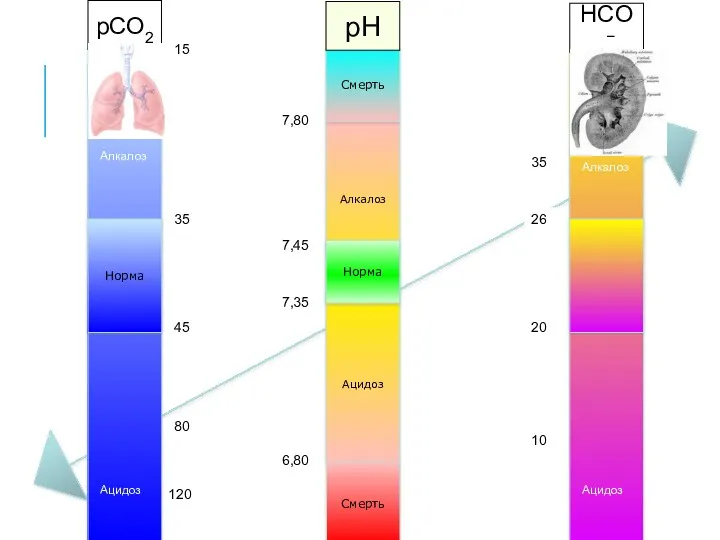
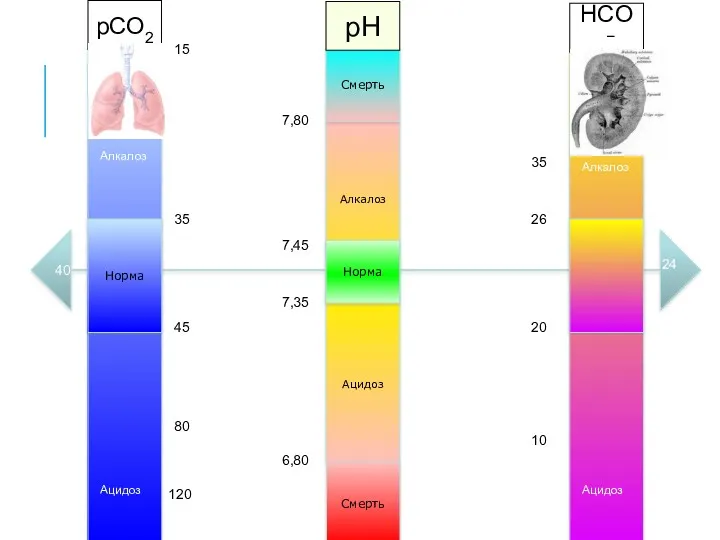
- 27. Алкалоз Ацидоз Норма Смерть Смерть 7,35 7,45 6,80 7,80 Норма pCO2 pH HCO3− 35 45 80
- 28. Алкалоз Ацидоз Норма Смерть Смерть 7,35 7,45 6,80 7,80 Норма pCO2 pH HCO3− 35 45 80
- 29. Алкалоз Ацидоз Норма Смерть Смерть 7,35 7,45 6,80 7,80 Норма pCO2 pH HCO3− 35 45 80
- 30. Алкалоз Ацидоз Норма Смерть Смерть 7,35 7,45 6,80 7,80 Норма pCO2 pH HCO3− 35 45 80
- 31. Алкалоз Ацидоз Норма Смерть Смерть 7,35 7,45 6,80 7,80 Норма pCO2 pH HCO3− 35 45 80
- 32. Алкалоз Ацидоз Норма Смерть Смерть 7,35 7,45 6,80 7,80 Норма pCO2 pH HCO3− 35 45 80
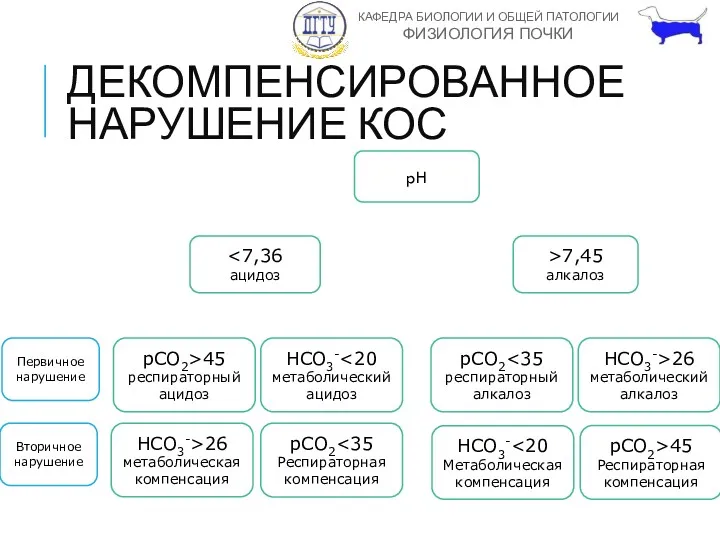
- 33. ДЕКОМПЕНСИРОВАННОЕ НАРУШЕНИЕ КОС pH >7,45 алкалоз pCO2>45 респираторный ацидоз HCO3- метаболический ацидоз pCO2 респираторный алкалоз HCO3->26
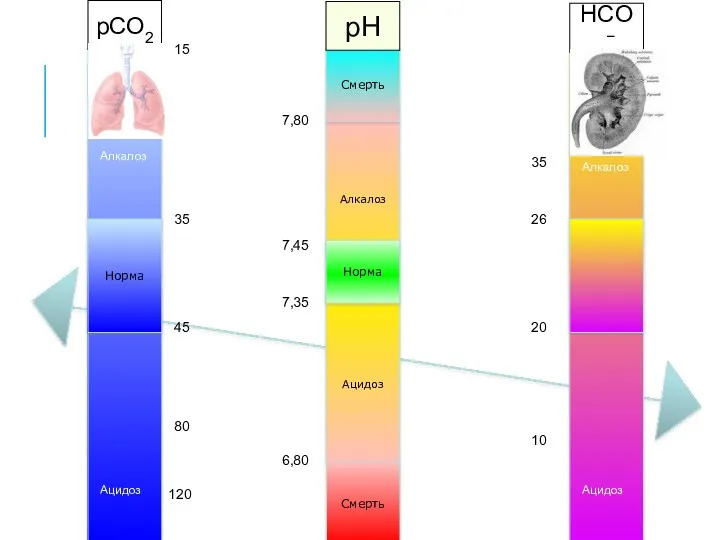
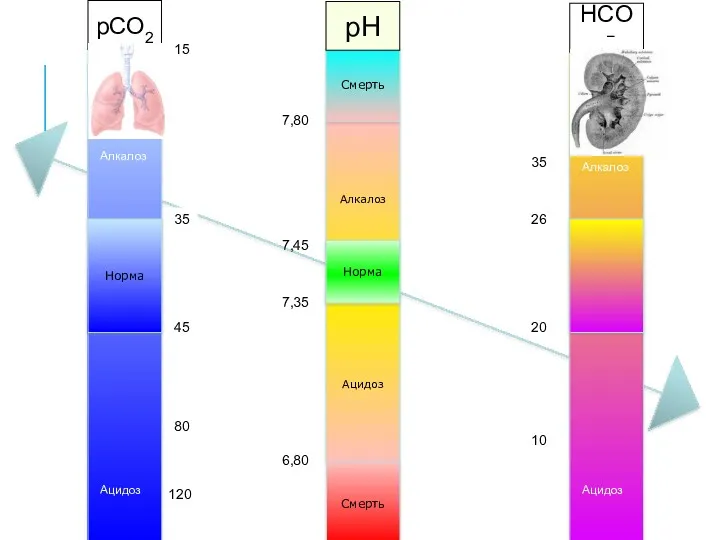
- 34. ПЕРВИЧНОЕ НАРУШЕНИЕ Что приводит к сдвигу pH? Респираторный (pCO2) компонент или Метаболический (HCO3−) компонент? pH 7,30
- 35. ВТОРИЧНОЕ НАРУШЕНИЕ (КОМПЕНСАЦИЯ) Что старается вернуть pH в норму? Респираторный (pCO2) компонент или Метаболический (HCO3−) компонент?
- 36. ЩЕЛОЧНОЙ РЕЗЕРВ (BE) Oтражает метаболический компонент КЩС при нормальных условиях (давление 1 атм, paCO2=40) Количество ммоль
- 37. ИНТЕРПРЕТАЦИЯ BE Норма − 0±4 (обычно +2) “-” − метаболический ацидоз или компенсация “+” − метаболический
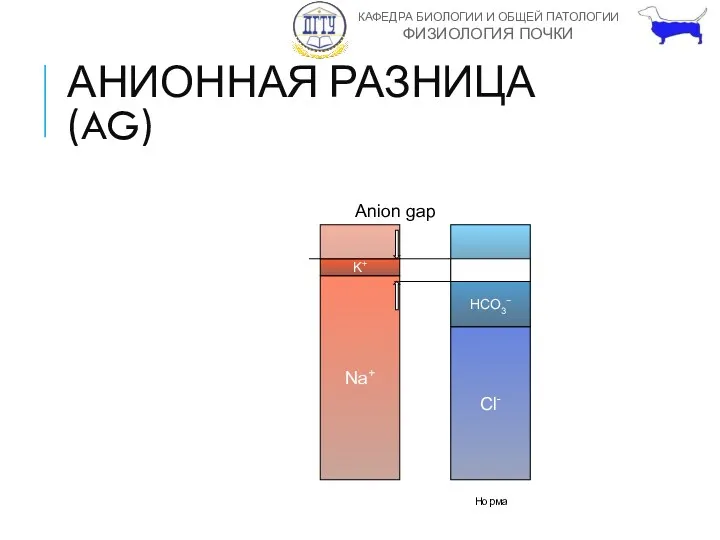
- 38. АНИОННАЯ РАЗНИЦА (ANION GAP) Разница между неизмеряемыми анионами и катионами AG=(Na+ + K+) - (HCO3−+Cl−) Позволяет
- 39. АНИОННАЯ РАЗНИЦА (AG) Na+ K+ Неизмер. Анионы Катионы 160 мЭкв/л Cl- HCO3− Неизмер. Сульфаты Фосфаты Белки
- 40. АНИОННАЯ РАЗНИЦА (AG) Норма
- 41. ГИПЕРХЛОРЕМИЧЕСКИЙ АЦИДОЗ – ПРИ ПОТЕРЕ HCO3- Cl- HCO3− Гиперхлоремический
- 42. НОРМОХЛОРЕМИЧЕСКИЙ АЦИДОЗ – ПРИ ПОЯВЛЕНИИ НЕИЗМЕРЯЕМОГО АНИОНА Cl- HCO3− Cl- HCO3− Гиперхлоремический Нормохлоремический
- 43. НОРМА AG Человеки 8-12 мЭкв/л Собаки 12-24 мЭкв/л Кошки 13-27 мЭкв/л такая разница потому, что у
- 44. СНИЖЕНИЕ AG Гипопротеинемия Снижение общего белка на 10 г/л снижает AG на 2,5 мЭкв/л Гипоальбуминемия Снижение
- 45. ВИДЫ НАРУШЕНИЙ КОС
- 46. РЕСПИРАТОРНЫЙ АЦИДОЗ Неэффективная вентиляция и/или перфузия легких ЦНС, n. phrenicus, дыхательные мышцы Воздухоносные пути Плевральная полость,
- 47. РЕСПИРАТОРНЫЙ АЛКАЛОЗ Тахипноэ Повреждения ЦНС Возбуждение Лихорадка, гипертермия Ятрогенное тахипноэ при ИВЛ Эклампсия pH 7,51 pO2
- 48. МЕТАБОЛИЧЕСКИЙ АЦИДОЗ Потери бикарбоната (гиперхлоремический) Введение H+ и связывание бикарбоната (нормохлоремический) Дифференцируем по анионной разнице, уровню
- 49. АЦИДОЗ С УВЕЛИЧЕНИЕМ AG (НОРМОХЛОРЕМИЧЕСКИЙ) H+ связывает бикарбонат Увеличиваются неизмеряемые анионы Лактат-ацидоз Шок Серьезная гипоксемия Генерализованные
- 50. АЦИДОЗ С УВЕЛИЧЕНИЕМ AG (НОРМОХЛОРЕМИЧЕСКИЙ) Парентеральное питание (избыток аминокислот) Уремические токсины Кетоацидоз Отравление Метанол Этиленгликоль Паральдегид
- 51. АЦИДОЗ БЕЗ УВЕЛИЧЕНИЯ AG (ГИПЕРХЛОРЕМИЧЕСКИЙ) Потери бикарбоната, компенсируются повышением Cl- Через ЖКТ Диарея Панкреат. или билиарн.
- 53. Скачать презентацию




![ГИДРОКОРБОНАТНЫЙ БУФЕР [H+]=24×(pCO2):[HCO3-] УРАВНЕНИЕ Гендерсона-Хассельбаха =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/259442/slide-7.jpg)
























 Туберкулез и ВИЧ
Туберкулез и ВИЧ Организация акушерско-гинекологической помощи в России. Роль врача стоматолога в антенатальной охране плода. Менструальный цикл и его рег
Организация акушерско-гинекологической помощи в России. Роль врача стоматолога в антенатальной охране плода. Менструальный цикл и его рег Анальгетики
Анальгетики Механизмы трофического действия физических упражнений
Механизмы трофического действия физических упражнений Жылқының шаншу түрінде өтетін аурулары
Жылқының шаншу түрінде өтетін аурулары Курстық жұмыс. Сальмонеллез ауруының таралу мониторингі. Диагностикасы және емі
Курстық жұмыс. Сальмонеллез ауруының таралу мониторингі. Диагностикасы және емі Общие вопросы лучевой диагностики. Ультразвуковое исследование
Общие вопросы лучевой диагностики. Ультразвуковое исследование Иммунный ответ. Определение, виды, особенности врожденного и адаптивного иммунитета
Иммунный ответ. Определение, виды, особенности врожденного и адаптивного иммунитета Mechanical injuries
Mechanical injuries Папулезные дерматозы или дерматозы с неустановленной этиологией
Папулезные дерматозы или дерматозы с неустановленной этиологией Стандарты лучевой диагностики заболеваний легких и средостения
Стандарты лучевой диагностики заболеваний легких и средостения Эмоционально-волевая сфера
Эмоционально-волевая сфера Здоровое питание. Пирамида питания
Здоровое питание. Пирамида питания Принципы доказательной медицины при проведении клинических исследований в наркологии
Принципы доказательной медицины при проведении клинических исследований в наркологии Субъективные и объективные методы обследования в клинике внутренних болезней
Субъективные и объективные методы обследования в клинике внутренних болезней Связь психологии и медицины (Лекция 2)
Связь психологии и медицины (Лекция 2) Проявления аллергии в полости рта у детей разного возраста
Проявления аллергии в полости рта у детей разного возраста Бордетеллы - мелкие грамотрицательные неподвижные коккобациллы. Микробиология
Бордетеллы - мелкие грамотрицательные неподвижные коккобациллы. Микробиология Характеристика основных стандартных лечебных диет
Характеристика основных стандартных лечебных диет Введение в неонатологию. Новорожденный ребенок
Введение в неонатологию. Новорожденный ребенок Видеокапсульная эндоскопия толстой кишки
Видеокапсульная эндоскопия толстой кишки Черепно-мозговые нервы (VII-XII)
Черепно-мозговые нервы (VII-XII) Дифтерия в современных условиях, дифференциальная диагностика, лечение
Дифтерия в современных условиях, дифференциальная диагностика, лечение Жалпы практика дәрігерінің жұмысын ұйымдастыру. Дәрігерлік амбулатория жұмысының менеджмент негіздері
Жалпы практика дәрігерінің жұмысын ұйымдастыру. Дәрігерлік амбулатория жұмысының менеджмент негіздері Анемиялық синдром. Нәрестелердің физиологиялық анемиясы. Лимфогранулематоз. Созылмалы миелолейкоз
Анемиялық синдром. Нәрестелердің физиологиялық анемиясы. Лимфогранулематоз. Созылмалы миелолейкоз Виды нарушений опорно-двигательного аппарата (кроме ДЦП)
Виды нарушений опорно-двигательного аппарата (кроме ДЦП) Заболевания носа и придаточных пазух. Методы исследования
Заболевания носа и придаточных пазух. Методы исследования Лайм-боррелиоз. Факторы патогенности
Лайм-боррелиоз. Факторы патогенности