Содержание
- 2. Общие положения Все манипуляции – после карантина Перед выполнением манипуляций с животными необходимо надеть средства индивидуальной
- 3. Хендлинг Проведение хендлинга до начала экспериментальных процедур: Минимизирует стресс у животных, вызванный взаимодействия с человеком Снижает
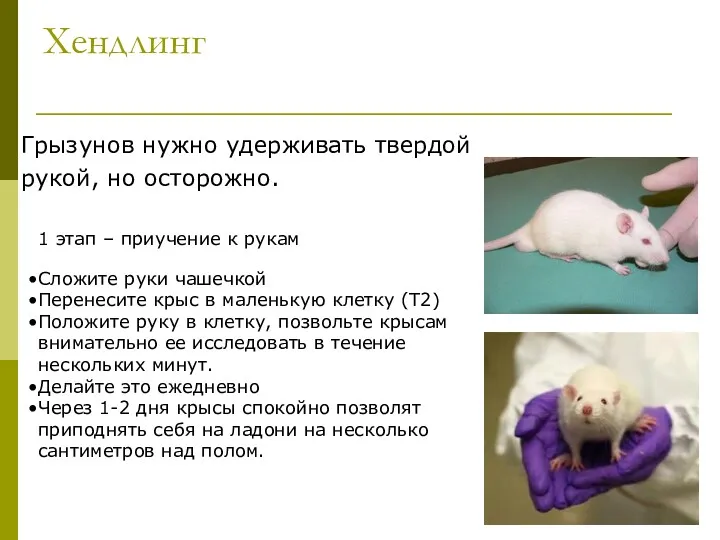
- 4. Хендлинг Грызунов нужно удерживать твердой рукой, но осторожно. 1 этап – приучение к рукам Сложите руки
- 5. Хендлинг 2 этап Для того, чтобы взять крысу в руки, необходимо вначале аккуратно взять ее, поместив
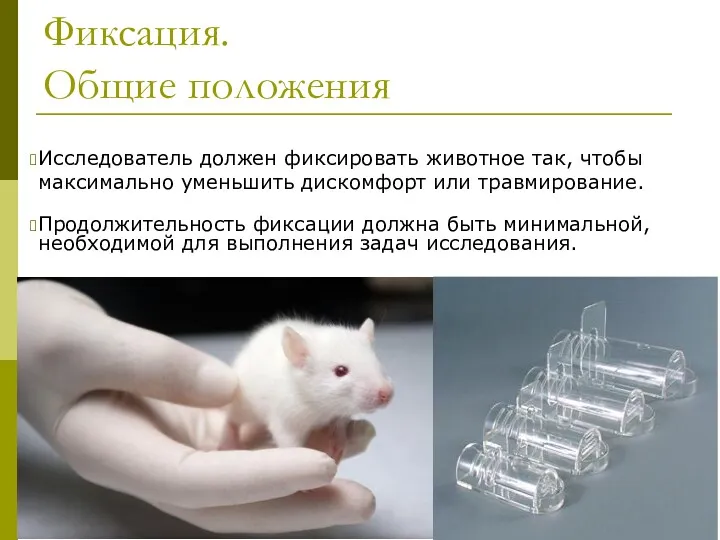
- 6. Фиксация. Общие положения Исследователь должен фиксировать животное так, чтобы максимально уменьшить дискомфорт или травмирование. Продолжительность фиксации
- 7. Фиксация крыс В зависимости от задач можно фиксировать крысу любым из следующих способов: • Фиксация крысы
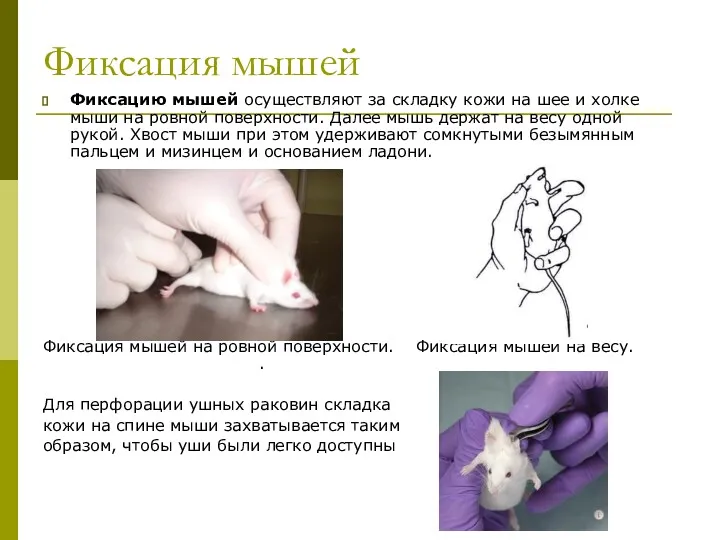
- 8. Фиксация мышей Фиксацию мышей осуществляют за складку кожи на шее и холке мыши на ровной поверхности.
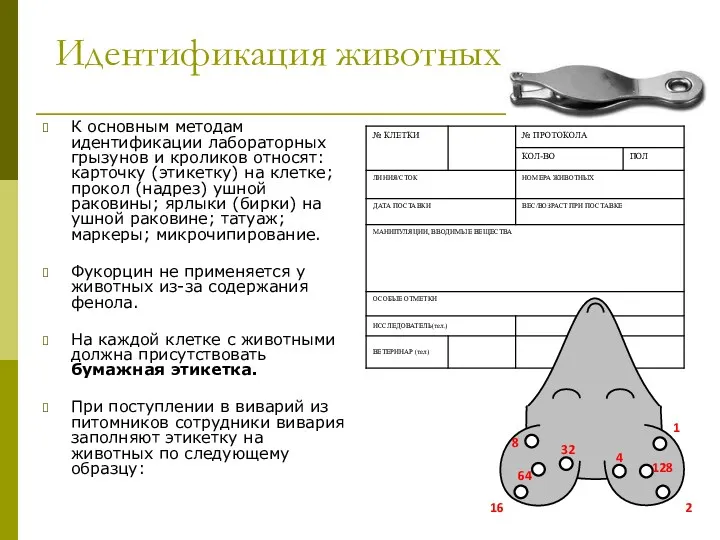
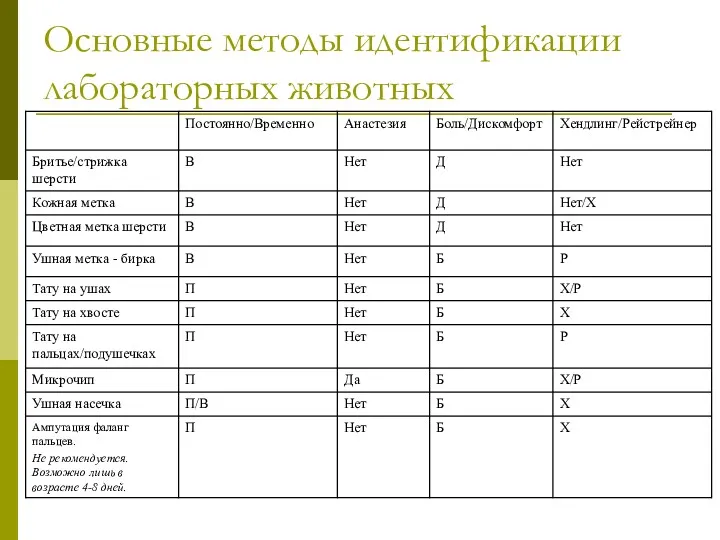
- 9. Идентификация животных К основным методам идентификации лабораторных грызунов и кроликов относят: карточку (этикетку) на клетке; прокол
- 10. Основные методы идентификации лабораторных животных
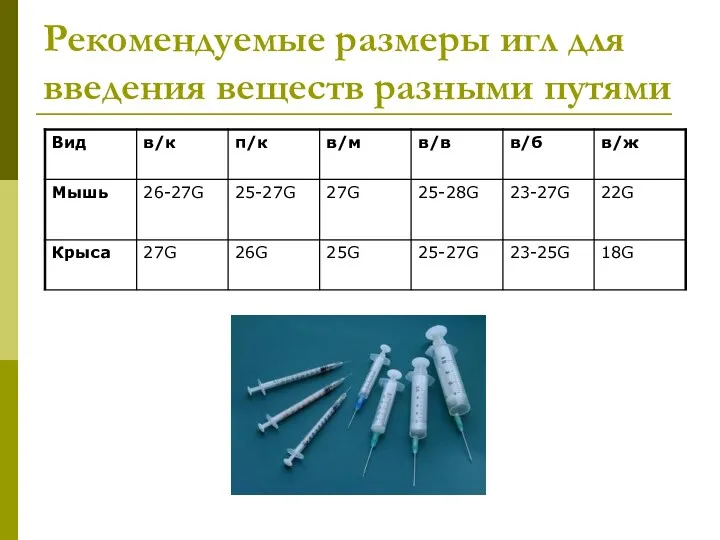
- 11. Введение экспериментальных веществ Для каждого пути введения следует выбрать подходящий размер иглы Меняйте иглы перед введением
- 12. Рекомендуемые размеры игл для введения веществ разными путями
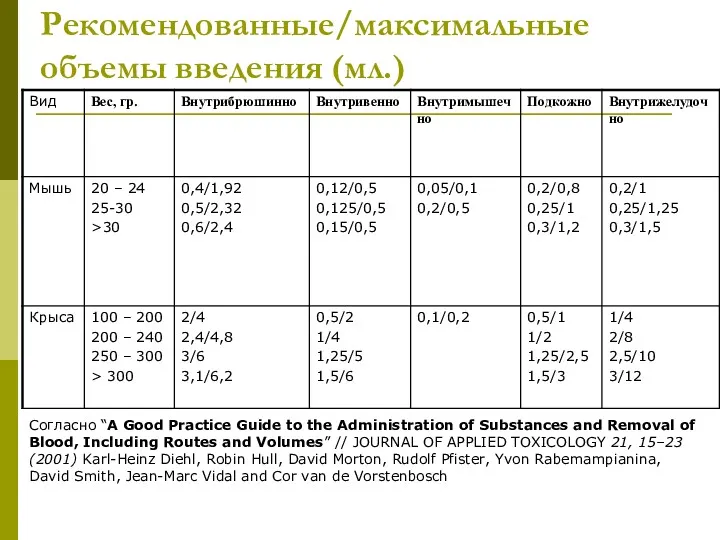
- 13. Рекомендованные/максимальные объемы введения (мл.) Согласно “A Good Practice Guide to the Administration of Substances and Removal
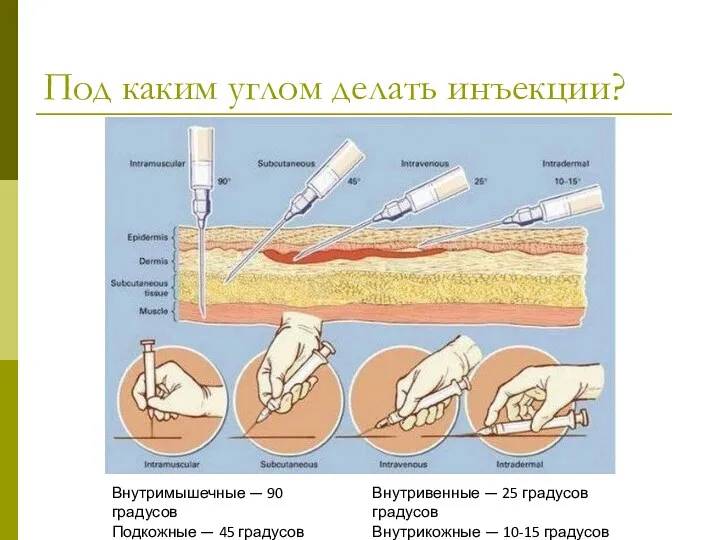
- 14. Под каким углом делать инъекции? Внутримышечные — 90 градусов Подкожные — 45 градусов Внутривенные — 25
- 15. Подкожное введение Для проведения подкожных инъекций желательно наличие ассистента, который будет выполнять фиксацию животного. Объем зависит
- 16. Инстилляции глазных капель При использовании автоматической пипетки: Набрать в пипетку необходимый объем препарата. Левой рукой зафиксировать
- 17. Интраназальное введение Набрать в пипетку нужный объем раствора (общий объем вводимого вещества – не более 20
- 18. Внутрибрюшинное введение Набрать в шприц нужный объем раствора. Животное жестко зафиксировать в руке: В случае проведения
- 19. Внутрижелудочное введение Зафиксировать животное рукой. Правильная фиксация является необходимым условием успешного выполнения процедуры. Фиксацию крыс осуществляют
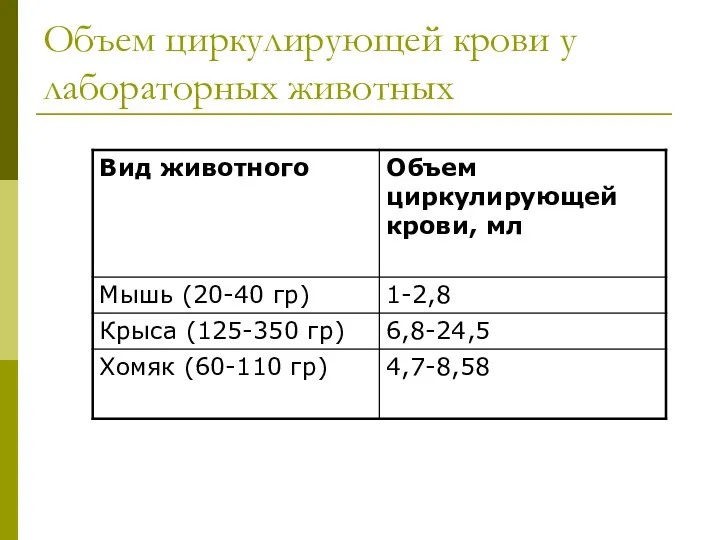
- 20. Отбор крови Если кровь отбирать слишком часто, у животного может развиться анемия. Восстановление полного кровяного состава
- 21. Объем циркулирующей крови у лабораторных животных
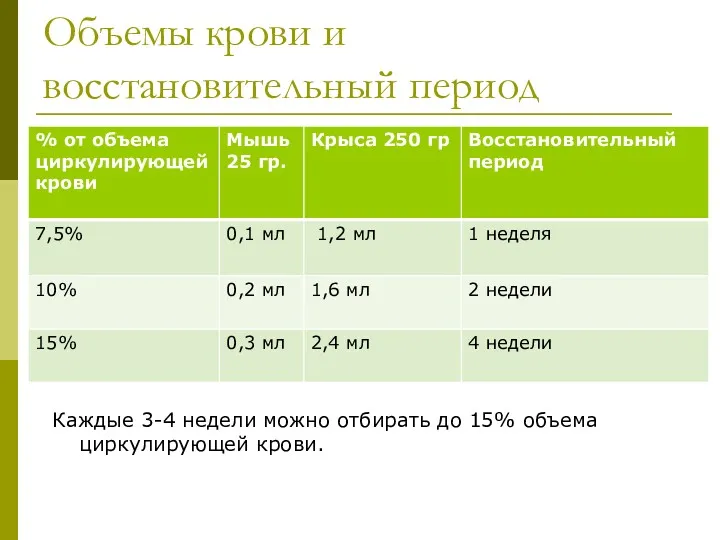
- 22. Объемы крови и восстановительный период Каждые 3-4 недели можно отбирать до 15% объема циркулирующей крови.
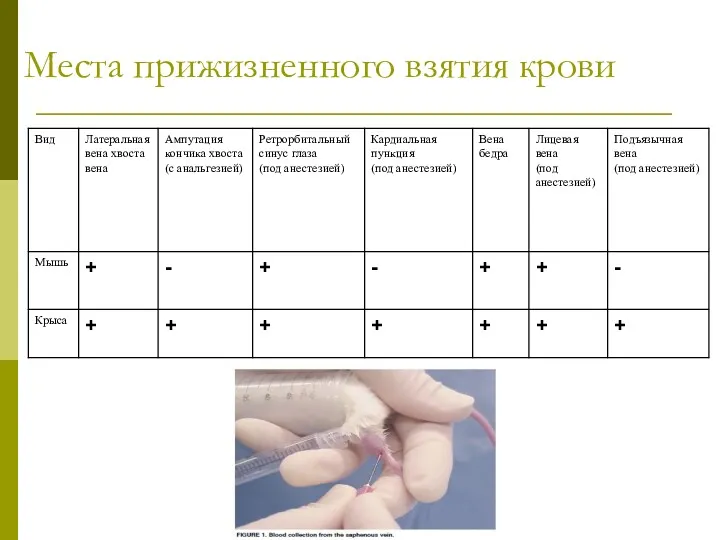
- 23. Места прижизненного взятия крови
- 24. Процедура взятия проб крови путем ампутации кончика хвоста у крыс Для того чтобы сосуды хвоста расширились,
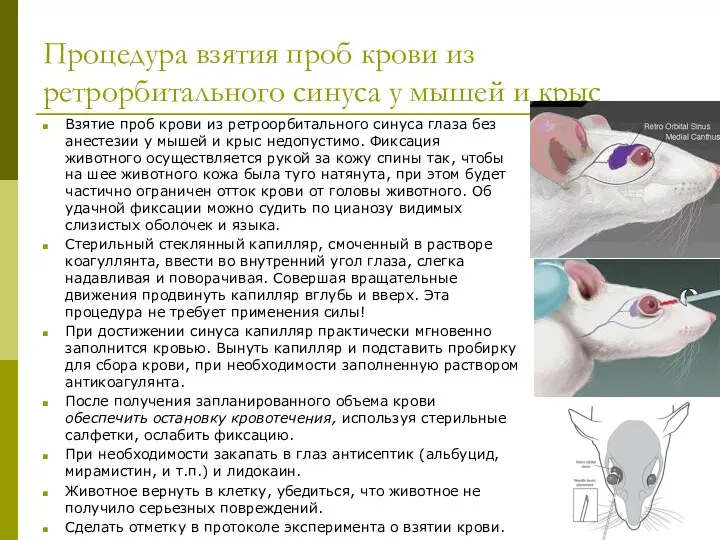
- 25. Процедура взятия проб крови из ретрорбитального синуса у мышей и крыс Взятие проб крови из ретроорбитального
- 26. Процедура взятия проб крови из лицевой вены у мышей и крыс Достать животное из клетки, наркотизировать
- 27. Процедура взятия проб крови из камер сердца у мышей и крыс Взятие проб крови из камер
- 28. Маркировка образцов Образец – любой материал, взятый из тест-системы для изучения, анализа или хранения В соответствии
- 29. Материалы для хирургических вмешательств Клеющаяся сторона к животным. Если возможно, накрывать животных вместе с хвостом.
- 30. Хирургические вмешательства При проведении хирургических операций исследователь должен руководствоваться принципами гуманного обращения с животными и соблюдать
- 31. Предоперационная подготовка Для проведения операций c выживанием животного все материалы, которые будут соприкасаться с операционным полем
- 32. Послеоперационный уход Все анестетики угнетают терморегуляцию и способствуют расширению сосудов. Гипотермия приводит к усилению реакции на
- 33. Послеоперационный уход Приглушенный свет, чистая комната, минимальный хэндлинг Максимальное обогащение среды Питание на уровне пола (в
- 35. Скачать презентацию




















 Полиомиелит. Протекание болезни полиомиелита
Полиомиелит. Протекание болезни полиомиелита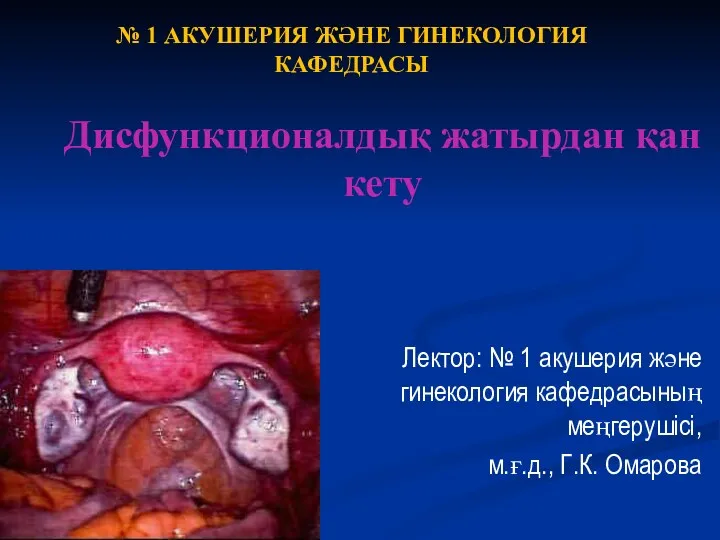 Дисфункционалдық жатырдан қан кету
Дисфункционалдық жатырдан қан кету Интерпретация данных методов инструментальной диагностики ЭЭГ психических расстройств, связанных с органическим поражением ЦНС
Интерпретация данных методов инструментальной диагностики ЭЭГ психических расстройств, связанных с органическим поражением ЦНС Временная остановка наружного кровотечения. Ошибки на догоспитальном этапе
Временная остановка наружного кровотечения. Ошибки на догоспитальном этапе Акушерлік перитонит. Жайылған септикалық инфекция
Акушерлік перитонит. Жайылған септикалық инфекция Синдром хронической болезни почек
Синдром хронической болезни почек Балалар ауруларын біріктіріп жүргізу жоспарын құрастыру(жөтел және қиындаған тыныс)
Балалар ауруларын біріктіріп жүргізу жоспарын құрастыру(жөтел және қиындаған тыныс) Иммундық процестердің бұзылуы. Аллергия, анафилаксия, СПИД
Иммундық процестердің бұзылуы. Аллергия, анафилаксия, СПИД Сестринский процесс при гломерулонефритах
Сестринский процесс при гломерулонефритах Гинекологиялық науқастардан анамнез жинау
Гинекологиялық науқастардан анамнез жинау Роль ствола мозга в регуляции двигательных функций
Роль ствола мозга в регуляции двигательных функций Хронический гастрит
Хронический гастрит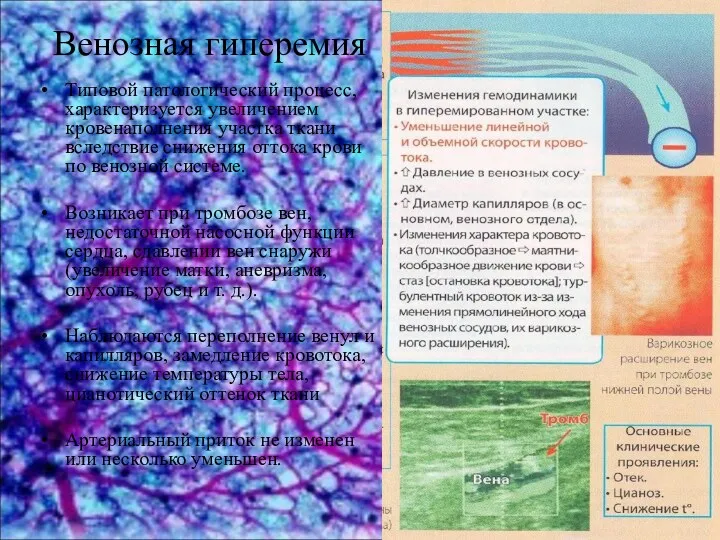 Венозная гиперемия
Венозная гиперемия Электронная медицинская аппаратура
Электронная медицинская аппаратура Лечение заболеваний и травм коленных суставов
Лечение заболеваний и травм коленных суставов Диагностические и профилактические мероприятия болезней вымени
Диагностические и профилактические мероприятия болезней вымени ЛФК при заболеваниях органов пищеварения
ЛФК при заболеваниях органов пищеварения Первая помощь при неотложных состояниях: закон и порядок
Первая помощь при неотложных состояниях: закон и порядок Нарушение кровообращения. Отеки
Нарушение кровообращения. Отеки Лайелл синдромы, Стивен-Джонсон синдромы
Лайелл синдромы, Стивен-Джонсон синдромы Профессиональные нейротоксикозы
Профессиональные нейротоксикозы Азық қорыту жүйесін зерттеу. Азық қабылдау және су ішудің бұзылуы
Азық қорыту жүйесін зерттеу. Азық қабылдау және су ішудің бұзылуы IgA нефропатия. Клиникасы:
IgA нефропатия. Клиникасы: Биохимия почек и мочи. (Лекция 10)
Биохимия почек и мочи. (Лекция 10) Укусы ядовитых животных
Укусы ядовитых животных Көз жасы мүшесінің патологиясы. Дакриоцистит, жас нүктесінің тарылуы, жас нүктесінің сырт айналуы
Көз жасы мүшесінің патологиясы. Дакриоцистит, жас нүктесінің тарылуы, жас нүктесінің сырт айналуы Парвавирусный энтерит собак
Парвавирусный энтерит собак Наследственные болезни обмена веществ
Наследственные болезни обмена веществ