Эмбриология. Оценка качества ооцитов. Факторы влияющие на качество ооцитов. Классическая методика эко. Оценка оплодотворения презентация
Содержание
- 2. Подготовка к пункции Успех вспомогательных репродуктивных технологий зависит от правильной координации медицинского и научного подходов к
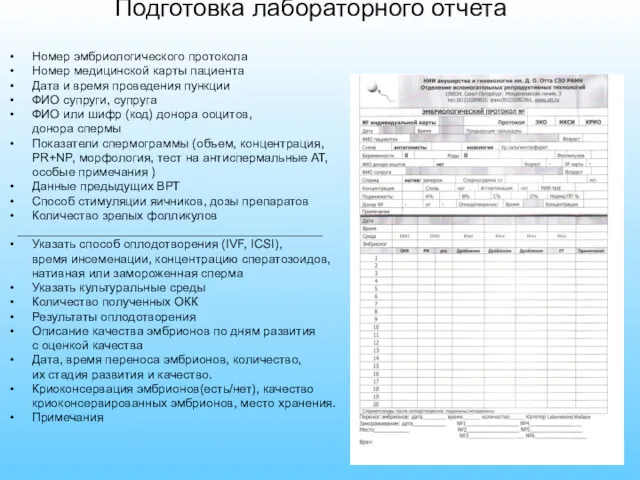
- 3. Номер эмбриологического протокола Номер медицинской карты пациента Дата и время проведения пункции ФИО супруги, супруга ФИО
- 4. Подготовка к проведению пункции Чашка с культуральной средой (среда для оплодотворения, с оптимальным состав для осуществления
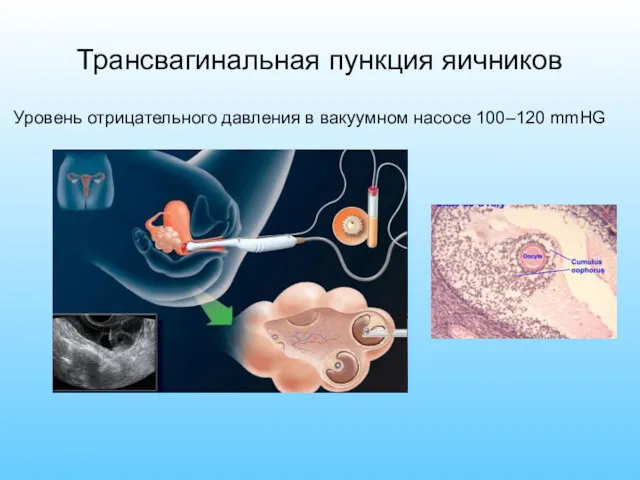
- 5. Трансвагинальная пункция яичников Уровень отрицательного давления в вакуумном насосе 100–120 mmHG
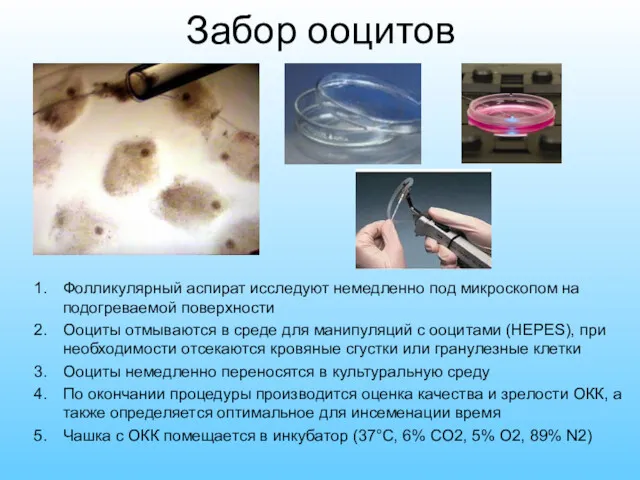
- 6. Забор ооцитов Фолликулярный аспират исследуют немедленно под микроскопом на подогреваемой поверхности Ооциты отмываются в среде для
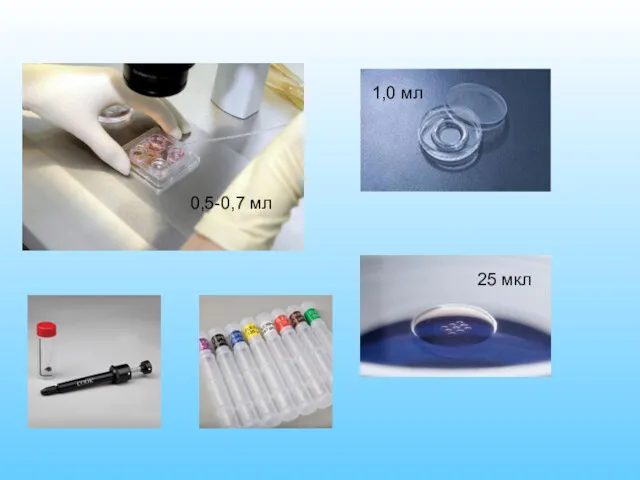
- 7. 25 мкл 0,5-0,7 мл 1,0 мл
- 8. Рис. Схематическое изображение строения яицеклетки человека. 1 – ядро с проядрышком; 2 – плазмолемма, оолемма; 3
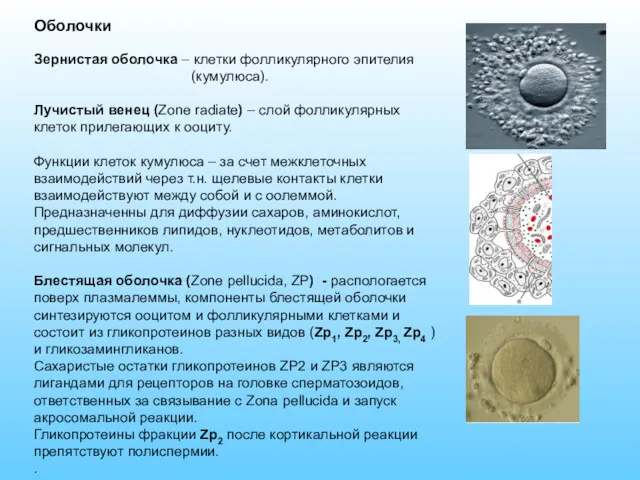
- 9. Оболочки Зернистая оболочка – клетки фолликулярного эпителия (кумулюса). Лучистый венец (Zone radiate) – слой фолликулярных клеток
- 10. Органеллы Эндоплазмотическая сеть Аппарат Гольджи Лизосомы Вакуоли Митохондрии Рибосомы Цитоскелет (микротрубочки и микрофиламенты) Отсутствуют центриоли. В
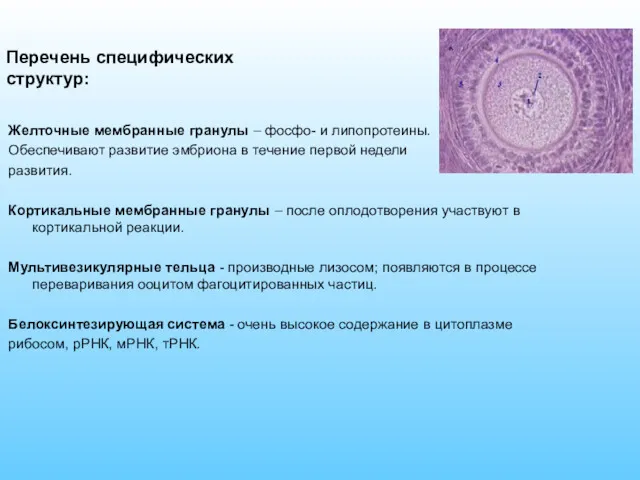
- 11. Желточные мембранные гранулы – фосфо- и липопротеины. Обеспечивают развитие эмбриона в течение первой недели развития. Кортикальные
- 12. Основной фактор, определяющий результаты IVF – Морфо-функциональное состояние яйцеклетки Качество ооцита – фактор, ограничивающий фертильность женщины
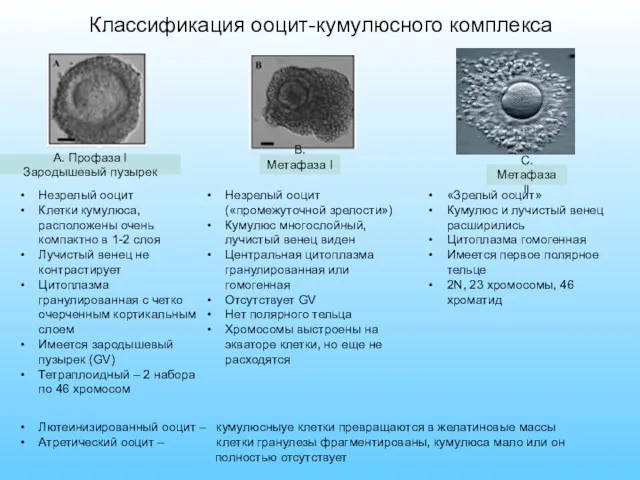
- 13. Классификация ооцит-кумулюсного комплекса B. Метафаза I A. Профаза I Зародышевый пузырек Незрелый ооцит Клетки кумулюса, расположены
- 14. Около 20% ооцитов не зрелые – в стадии МI или GV Асперируемые фолликулы Дефицит рецепторов ЛГ
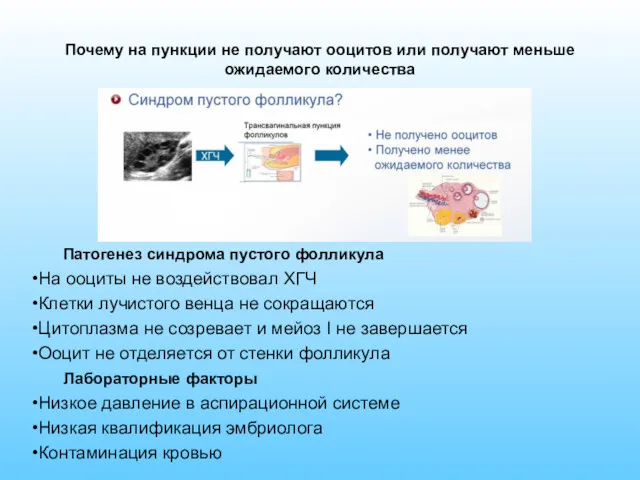
- 15. Почему на пункции не получают ооцитов или получают меньше ожидаемого количества Патогенез синдрома пустого фолликула На
- 16. Качество ооцитов (прогностические факторы) Характеристики Морфологические (аномальные морфологические характеристики отмечаются у 60-70% ооцитов). (Van Blerkom J,
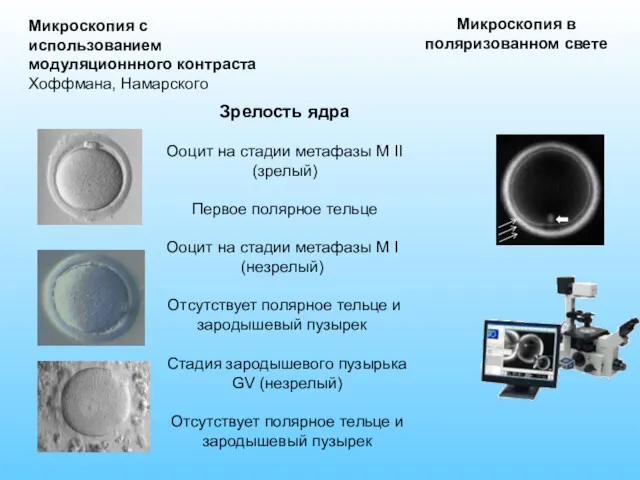
- 17. Микроскопия в поляризованном свете Микроскопия с использованием модуляционнного контраста Хоффмана, Намарского Зрелость ядра Ооцит на стадии
- 18. Hum Reprod Update. 2011 Jan-Feb; 17(1): 34–45. Predictive value of oocyte morphology in human IVF: a
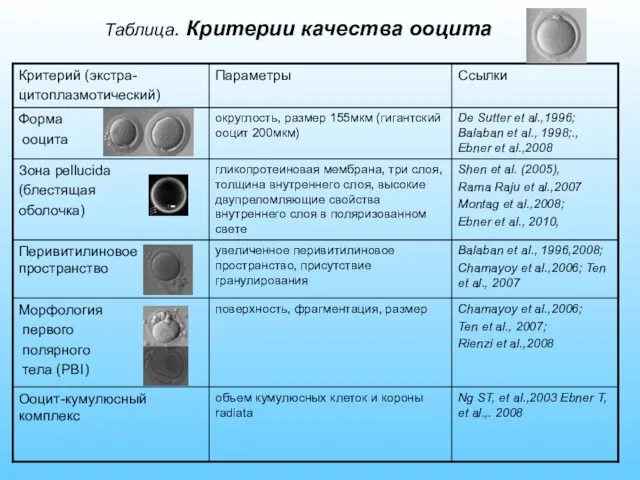
- 19. Таблица. Критерии качества ооцита
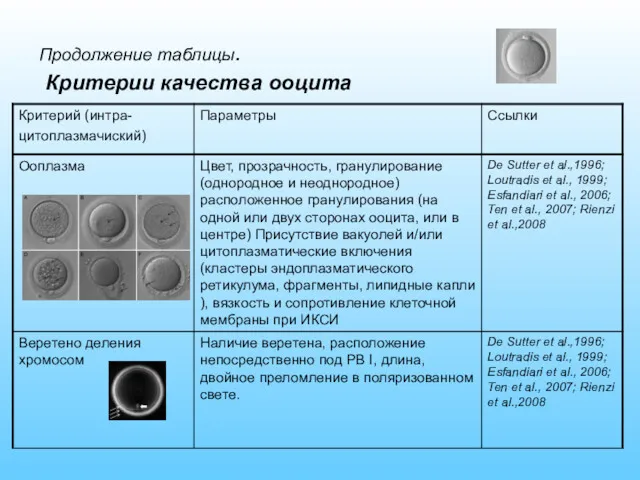
- 20. Продолжение таблицы. Критерии качества ооцита
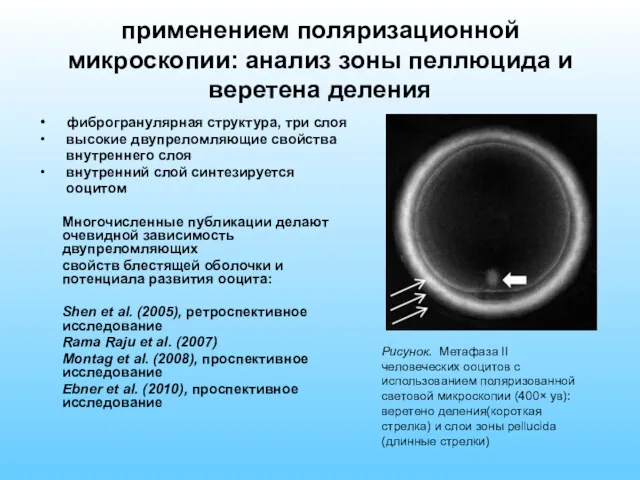
- 22. применением поляризационной микроскопии: анализ зоны пеллюцида и веретена деления фиброгранулярная структура, три слоя высокие двупреломляющие свойства
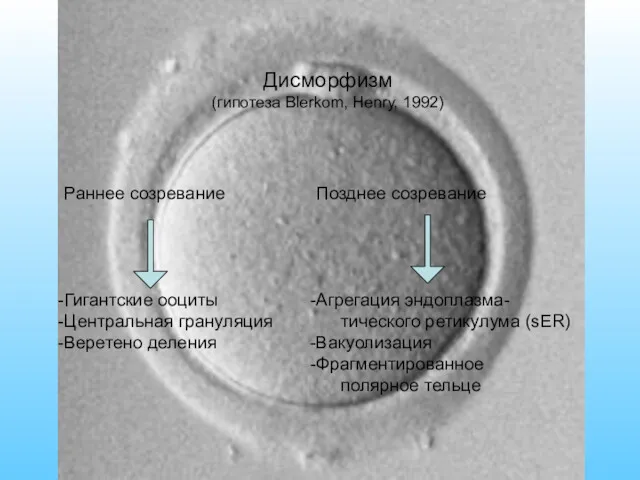
- 23. Дисморфизм (гипотеза Blerkom, Henry, 1992) Раннее созревание Гигантские ооциты Центральная грануляция Веретено деления Позднее созревание Агрегация
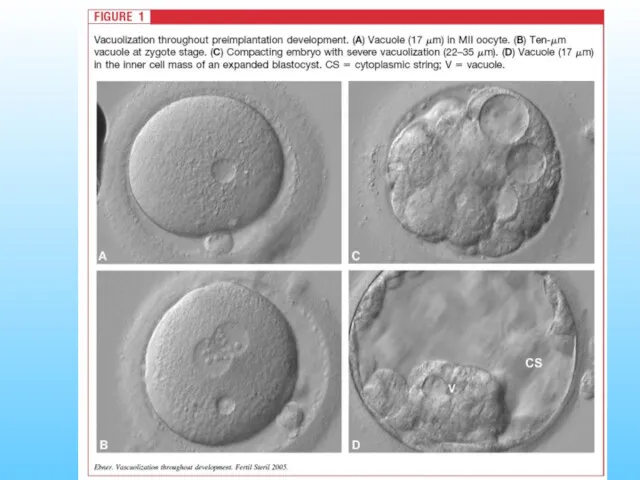
- 24. Криоконсервированные ооциты Возможные последствия Изменение метаболизма Ультраструктуральные повреждения (оргенеллы, цитоскелет), деполимеризация микротрубочек MII веретена деления (степень
- 25. Кумулятивный показатель беременности (возраст пациенток Криоконсервация эмбрионов Криоконсервация ооцитов
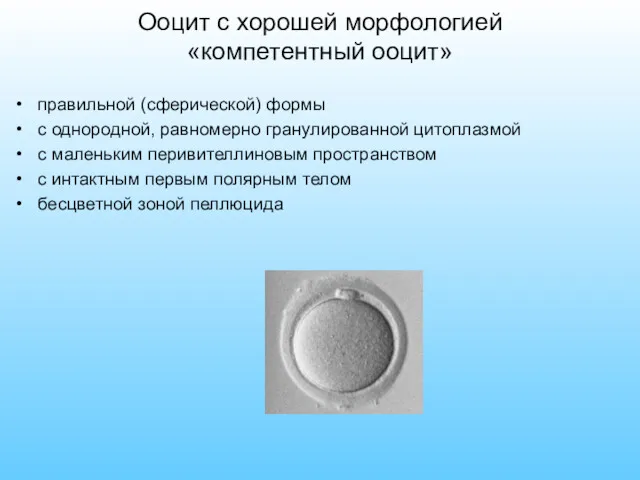
- 26. Ооцит с хорошей морфологией «компетентный ооцит» правильной (сферической) формы с однородной, равномерно гранулированной цитоплазмой с маленьким
- 27. Созревание ооцитов в условиях in vitro (IVM – in vitro maturation) репродуктивная технология 1991 год –
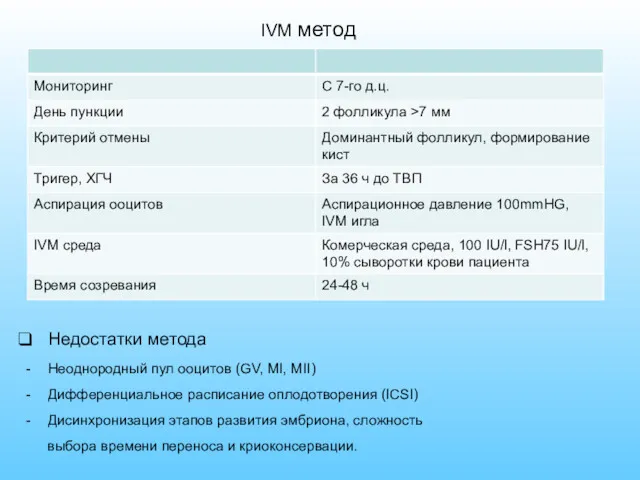
- 28. IVM метод Недостатки метода Неоднородный пул ооцитов (GV, MI, MII) Дифференциальное расписание оплодотворения (ICSI) Дисинхронизация этапов
- 29. Факторы, влияющие на качество ооцита Клинические факторы Гинекологические заболевания (синдром поликистозных яичников, эндометриоз, аутоимунный оофорит) Стимуляция
- 30. Клинические факторы. Стимуляция суперовуляции в циклах ЭКО влияет на микроокружение ооцита и как следствие на качество
- 31. Возраст 1.Остановка эмбриогенеза может быть результатом событий, связанных с созреванием или несостоятельностью метаболизма ооцита. Цитоплазма ооцита
- 32. Рисунок. Уровень анеуплоидии в 3816 FISH диагностиках ооцитов относительно материнского возраста. Распределение хромосом зависело от возраста
- 33. «Маркеры апоптоза как предикторы эффективности вспомогательных репродуктивных технологий» Грищенко Н.Г. Харьковский национальный медицинский университет Международный медицинский
- 34. Факторы, влияющие на качество ооцита Клинические факторы Гинекологические заболевания (синдром поликистозных яичников, эндометриоз, аутоимунный оофорит) Стимуляция
- 35. pH культуральной среды pH культуральной среды находится в физиологическом интервале 7,2 – 7,4. Бикарбонатный буфер культ.
- 36. Температура При снижение температуры изменяется веретено деления. Деполимеризация веретена деления Нарушения метаболизма, стабильности клеточных мембран итранспортных
- 37. Осмолярность Важной характеристикой среды является ее осмолярность, определяемая концентрацией и константами диссоциации ее компонентов. Обычно осмолярность
- 38. Как обеспечить стабильность среды культивирования Использовать минеральное масло. При работе с гаметами и эмбрионами вне инкубатора
- 39. О2 Ооцитам и эмбрионам необходим кислород, в условиях in vitro они генерируют АТФ путем аэробного окислительного
- 40. Выводы Получение ооцита Трансвагинальная функция фолликулов под ультрозвуковым контролем Температура 37°С Стабильный рН-7,4 Качество ооцитов На
- 41. Классическая методика экстракорпорального оплодотворения
- 42. Подготовка сперматозоидов к оплодотворению Активация спермиев в придатках яичка (эпидидимусе) – обретение подвижности. Сперматозоид должен встретить
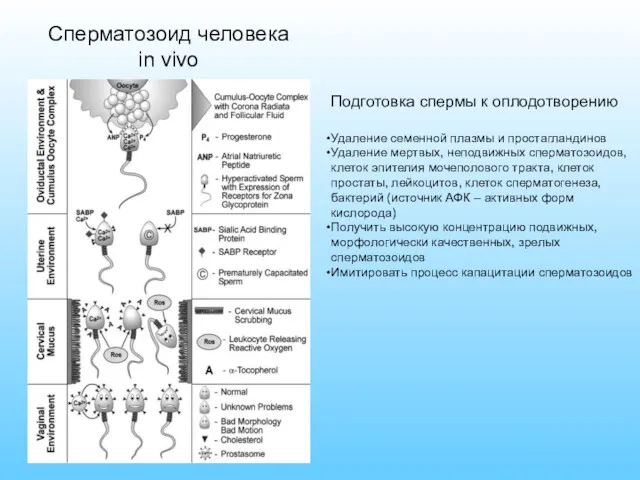
- 43. Сперматозоид человека in vivo Подготовка спермы к оплодотворению Удаление семенной плазмы и простагландинов Удаление мертвых, неподвижных
- 44. Капацитация Биохимически капацитация — это изменение строения некоторых молекул (стеролов, липидов и гликозилированных белков) цитоплазматической мембраны
- 45. Спермий в половых путях самки. Схема оплодотворения. Капацитация Гиперактивация Преодоление 3-х естественных барьеров: клетки кумулюса и
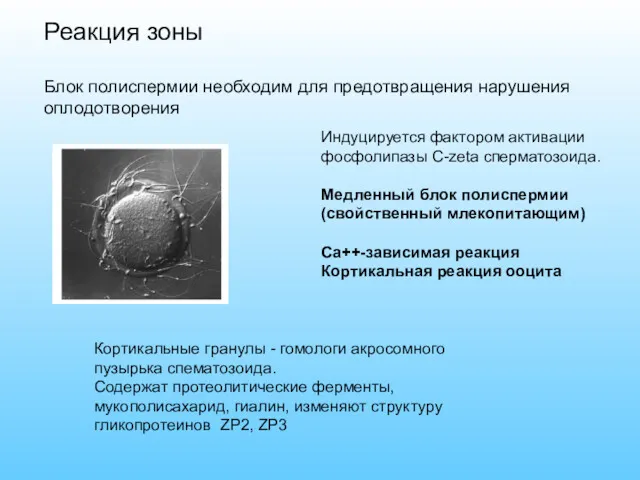
- 46. Реакция зоны Блок полиспермии необходим для предотвращения нарушения оплодотворения Индуцируется фактором активации фосфолипазы С-zeta сперматозоида. Медленный
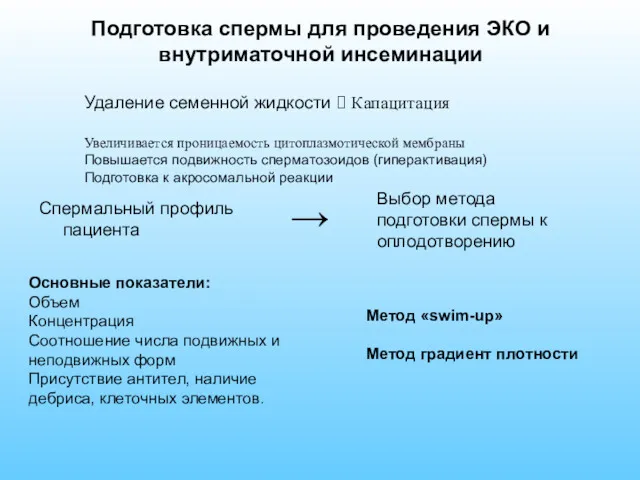
- 47. Подготовка спермы для проведения ЭКО и внутриматочной инсеминации Спермальный профиль пациента Выбор метода подготовки спермы к
- 48. Метод «swim-up» Принцип метода основан на различной подвижности сперматозоидов Критерии выбора метода: - нормозооспрмия - легкие
- 49. Метод «градиент плотности» Критерии выбора метода: - олиго-, астено-, тератозооспермия - присутствие значительной клеточной контаминации и
- 50. Подготовка спермы к проведению ИКСИ Критерии выбора: - олигоспермия, объем ≤ 0,5 мл - выраженная олиго-астенозооспермия,
- 51. Инсеменация ООЦИТОВ in vitro Фактор времени Тригер овуляции (ХГЧ)→36 часов→пункция → → 2- 6 часов→инсеменация Способность
- 52. Инсеменация ООЦИТОВ in vitro Количественный фактор Культивирование в большом объеме Количество прогрессивно подвижных сперматозоидов обычно должно
- 53. Сперматозоид капацитация гиперактивация связывание с zona pellucida акросомный экзоцитоз проникновение сквозь zona pellucida сплавление мембран спермия
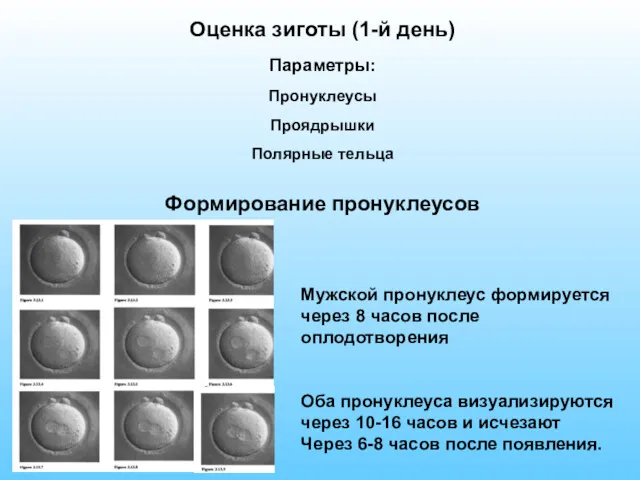
- 54. Оценка зиготы (1-й день) Параметры: Пронуклеусы Проядрышки Полярные тельца Формирование пронуклеусов Мужской пронуклеус формируется через 8
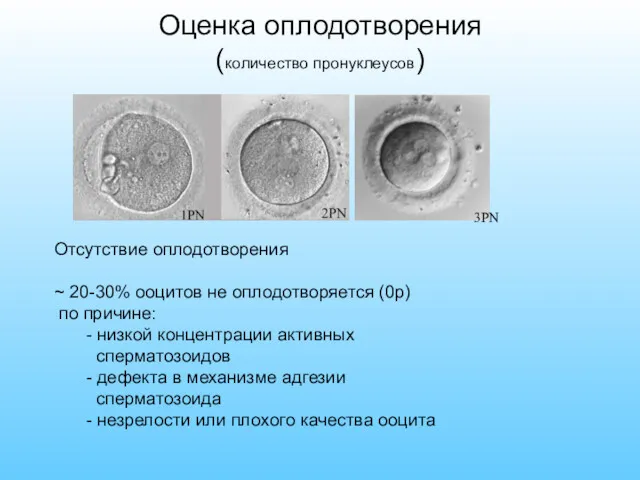
- 55. Оценка оплодотворения (количество пронуклеусов) 3PN Отсутствие оплодотворения ~ 20-30% ооцитов не оплодотворяется (0р) по причине: -
- 56. Качество пронуклеарных зигот, их морфология Форма зиготы Цитоплазматическое гало (органеллы клетки: митохондрии смещены к центру и
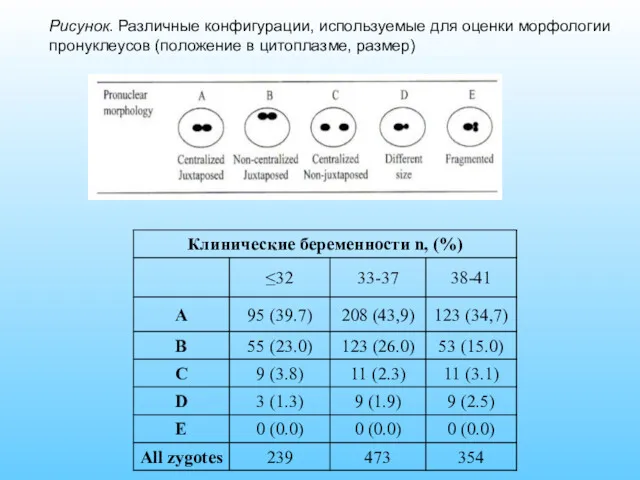
- 57. Рисунок. Различные конфигурации, используемые для оценки морфологии пронуклеусов (положение в цитоплазме, размер)
- 58. Рисунок.Ориентация пронуклеусов относительно PBII Figure 2: Computer-dependent measurements of morphological features in zygotes. Оолемма (зеленый), цитоплазматическое
- 59. Classification of PNs by Tesarik et al., 1999 Zygotes classified according to Tesarik's system and the
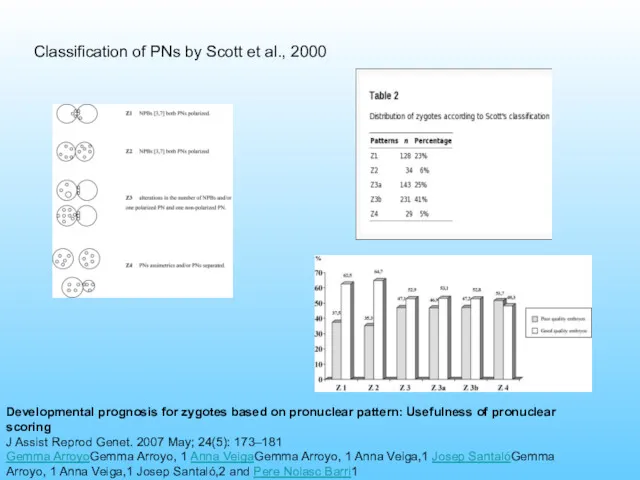
- 60. Classification of PNs by Scott et al., 2000 Developmental prognosis for zygotes based on pronuclear pattern:
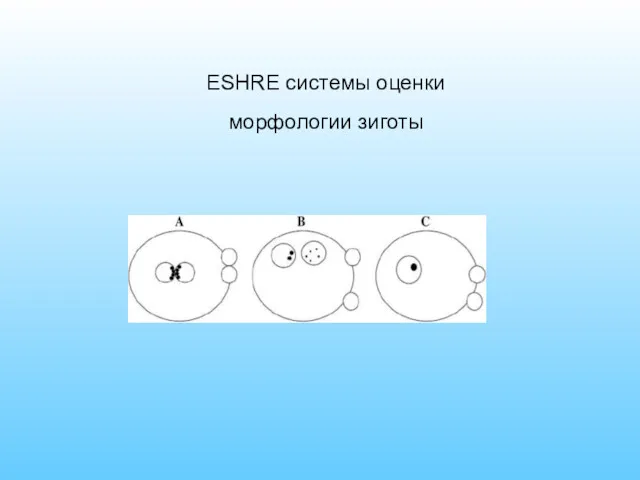
- 61. ESHRE системы оценки морфологии зиготы
- 63. Скачать презентацию




































 Фармацевтична опіка при симптоматичному лікуванні болю у горлі, кашлю, лихоманки
Фармацевтична опіка при симптоматичному лікуванні болю у горлі, кашлю, лихоманки Вскармливание детей первого года жизни
Вскармливание детей первого года жизни Prophylaxis as the main task of a family doctor
Prophylaxis as the main task of a family doctor Патофизиология опухолевого роста (механизмы канцерогенеза)
Патофизиология опухолевого роста (механизмы канцерогенеза) Применение методов статистического анализа для оценки состояния общественного здоровья и здравоохранения (тема № 1)
Применение методов статистического анализа для оценки состояния общественного здоровья и здравоохранения (тема № 1) ВИЧ-инфекция. Общие положения. Истинные и ложные пути передачи. Диагностика. Меры профилактики
ВИЧ-инфекция. Общие положения. Истинные и ложные пути передачи. Диагностика. Меры профилактики Пневмония у детей
Пневмония у детей Організація фармацевтичного забезпечення населення в умовах медичного страхування. Організація проведення аудиторської перевірки
Організація фармацевтичного забезпечення населення в умовах медичного страхування. Організація проведення аудиторської перевірки Охрана материнства и детства
Охрана материнства и детства Основы микрохирургии
Основы микрохирургии Болевой синдром в онкологии
Болевой синдром в онкологии Гестационный сахарный диабет
Гестационный сахарный диабет Медицинская и санитарная техника
Медицинская и санитарная техника Пероральные лекарственные формы с модифицированным высвобождением
Пероральные лекарственные формы с модифицированным высвобождением Профилактика инфекционных заболеваний
Профилактика инфекционных заболеваний Органы кроветворения и иммунной защиты
Органы кроветворения и иммунной защиты Речевые нарушения у детей
Речевые нарушения у детей Удаление зубов
Удаление зубов Диспепсия. Классификация
Диспепсия. Классификация Вступление в систему непрерывного медицинского и фармацевтического образования. Пошаговые инструкции
Вступление в систему непрерывного медицинского и фармацевтического образования. Пошаговые инструкции Экстрапирамидная система
Экстрапирамидная система Кардиомиопатия такоцубо: уникальная кардиомиопатия с переменной морфологией желудочка
Кардиомиопатия такоцубо: уникальная кардиомиопатия с переменной морфологией желудочка Афазия. Характеристика семантической афазии
Афазия. Характеристика семантической афазии Лицензирование медицинской деятельности
Лицензирование медицинской деятельности Анемии. Клиника, диагностика, лечение
Анемии. Клиника, диагностика, лечение Мастер-класс. Травматологический конкурс
Мастер-класс. Травматологический конкурс Кариес и его профилактика
Кариес и его профилактика Порядок проведения диспансеризации определенных групп взрослого населения
Порядок проведения диспансеризации определенных групп взрослого населения