Содержание
- 2. История 1891 г. – Д.А. Романовский доказал возможность воздействия лекарственного средства на возбудителя в организме человека.
- 3. Зинаида Виссарионовна Ермольева – создатель отечественного пенициллина З.В. Ермольева и сэр Говард Флори. 1944 В.А. Каверин
- 4. История стрептомицин (1944 г.), полимиксин (1947 г.), хлортетрациклин (1948 г.) бензилпенициллин, неомицин (1949 нистатин (1950 г.),
- 5. В результате применения антибиотиков: сокращены случаи летальных исходов от инфекционных заболеваний; смягчена тяжесть течения инфекционных заболеваний;
- 6. Антибиотики Термин «антибиотик» произошел от греческих слов: Anti - против Bios – жизнь или от латинского
- 7. Классификация антибиотиков По источникам выделения; По способу получения; По спектру действия; По химическому составу; По механизму
- 8. Способы получения антибиотиков Биологический синтез – антибиотики, полученные из природных источников (пенициллин, стрептомицин). Химический синтез –
- 9. Классификация антибиотиков по химическому строению β-Лактамы (пенициллины, цефалоспорины, карбапенемы). Аминогликозиды (стрептомицин, гентамицин). Тетрациклины (тетрациклин, доксициклин). Макролиды
- 10. Классификация антибиотиков по источникам выделения Антибиотики вырабатываемые: микроорганизмами (грамицидины, полимиксины), в том числе актиномицетами (стрептомицин, тетрациклины,
- 11. Классификация антибиотиков по спектру биологического действия Противобактериальные антибиотики узкого спектра действия: природные и полусинтетические пенициллины, полусинтетические
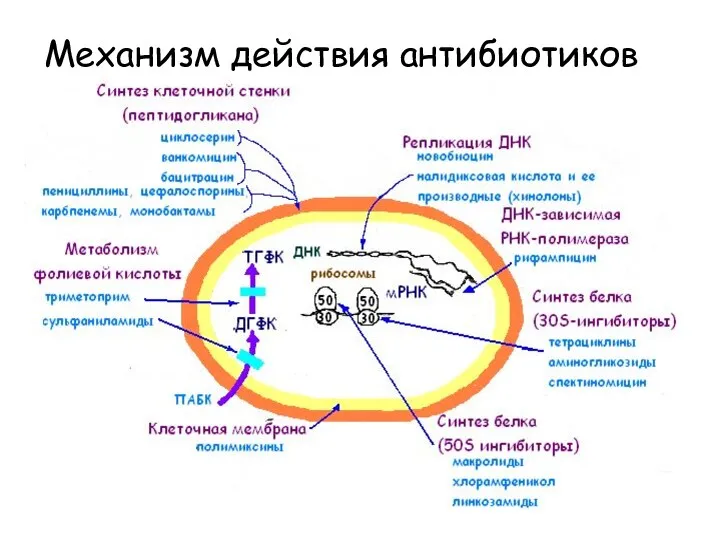
- 12. Механизм действия антибиотиков
- 13. Общие принципы реализации антимикробного эффекта: антибиотик должен: связаться с бактерией и пройти через ее оболочку; быть
- 14. Побочное действие антибиотиков На макроорганизм Токсические реакции: гепатотоксическое действие (тетрациклины, эритромицин), нефротоксическое действие (аминогликозиды), нарушение формирование
- 15. Лекарственная устойчивость микроорганизмов и пути ее преодоления При изучении действия трепанового синего на трипаносомы Эрлих установил
- 16. Устойчивость бактерий к антибиотикам
- 17. Генетические модификации Наследуемый признак. Детерминируется внехромасомным R фактором - или геном резистентности. Ген резистентности микроорганизм получает
- 18. Множественная лекарственная устойчивость С высокой частотой R- гены передаются плазмидами и транспозонами. Один транспозон передает резистентность
- 19. Механизмы резистентности Нарушение проницаемости клеточных оболочек. Причина – полная или частичная утрата пориновых белков. Модификация мишеней
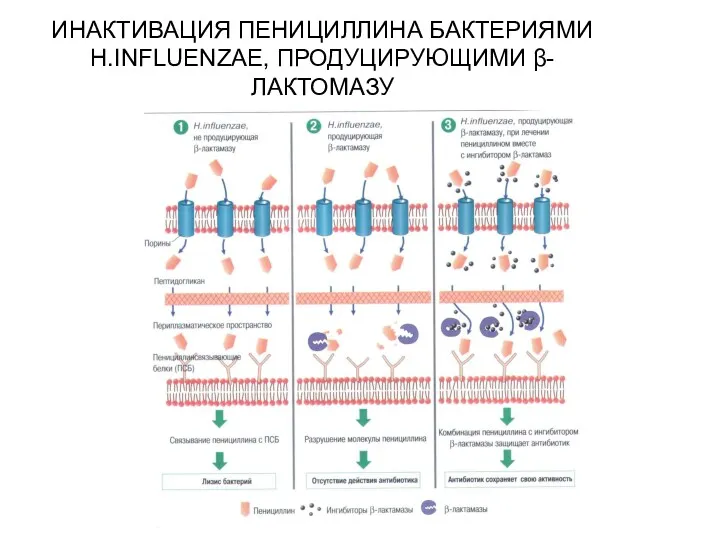
- 20. Механизмы резистентности Инактивация антибиотика β-лактамазы → гидролиз β-лактамного кольца (бета-лактамазы – ферменты, разрушающие активный центр антибиотиков).
- 21. ИНАКТИВАЦИЯ ПЕНИЦИЛЛИНА БАКТЕРИЯМИ H.INFLUENZAE, ПРОДУЦИРУЮЩИМИ β-ЛАКТОМАЗУ
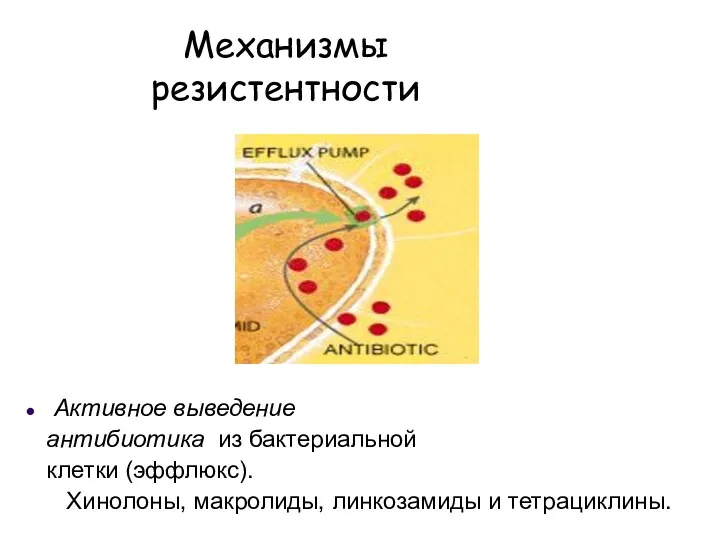
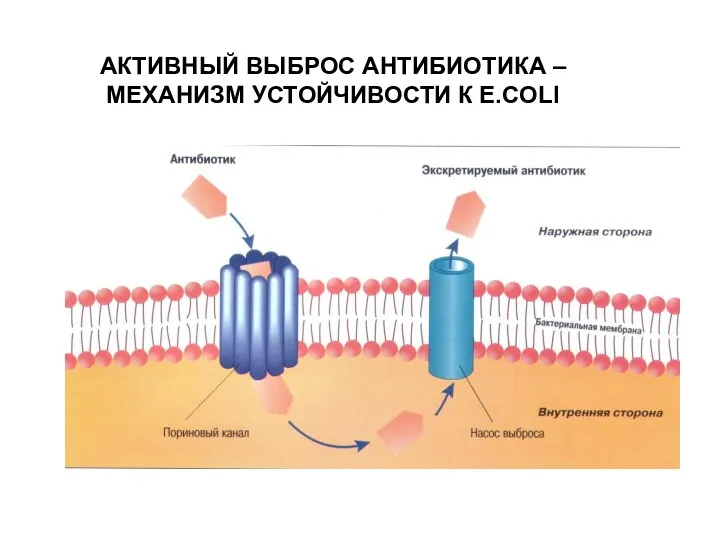
- 22. Механизмы резистентности Активное выведение антибиотика из бактериальной клетки (эффлюкс). Хинолоны, макролиды, линкозамиды и тетрациклины.
- 23. АКТИВНЫЙ ВЫБРОС АНТИБИОТИКА – МЕХАНИЗМ УСТОЙЧИВОСТИ К E.COLI
- 24. В ответ на применение антибиотиков микроорганизмы ответили биологическими реакциями, сила которых не уступает силе атаки. На
- 25. Пути преодоления антибиотикорезистентности Получение и введение в практику новых антибиотиков. Полиантибиотикотерапия. Применение антибиотиков только по показаниям.
- 26. Методы определения чувствительности бактерий к антибиотикам Серийных разведений В агаре, в бульоне (макровариант, микровариант) Диффузионные Диско-диффузионный
- 27. Метод серийных разведений ЛД – минимальная концентрация антибиотика, подавляющая видимый рост исследуемого микроорганизма
- 28. Диско-диффузионный метод
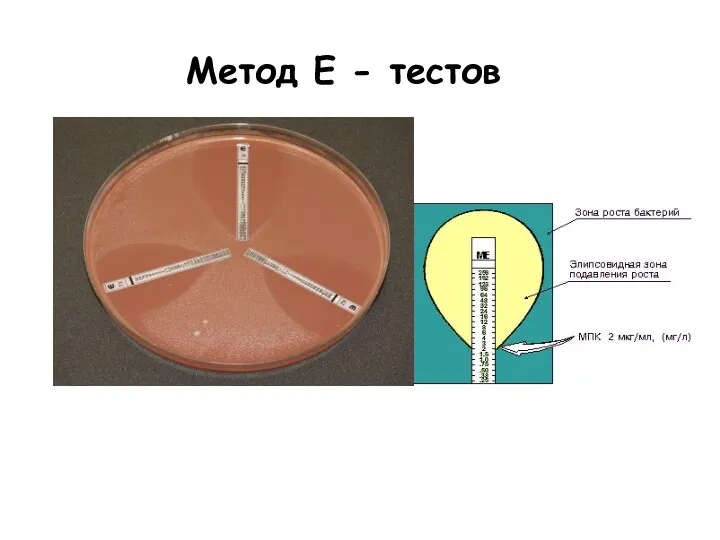
- 29. Метод Е - тестов МПК
- 31. Скачать презентацию























 Эпидемиология и профилактика ВИЧ-инфекции
Эпидемиология и профилактика ВИЧ-инфекции Радиационная медицина. История развития. Радиоактивность. Радиационный фон
Радиационная медицина. История развития. Радиоактивность. Радиационный фон Епідеміологія як наука. Основи епідеміологічного методу дослідження
Епідеміологія як наука. Основи епідеміологічного методу дослідження Диспансерное наблюдение детей
Диспансерное наблюдение детей Анестезия в России. Опыт применения наркоза
Анестезия в России. Опыт применения наркоза Заболевания органов дыхания и их профилактика
Заболевания органов дыхания и их профилактика Современные методы изготовления бюгельных протезов на огнеупорной модели
Современные методы изготовления бюгельных протезов на огнеупорной модели Үлкен жартышар қызметінің асимметриясы
Үлкен жартышар қызметінің асимметриясы Рентгеновская семиотика
Рентгеновская семиотика Школы больных и центр здоровья
Школы больных и центр здоровья Основні переваги грудного вигодовування малят
Основні переваги грудного вигодовування малят Синдромы и методы функциональной диагностики при патологии ЖВП и печени
Синдромы и методы функциональной диагностики при патологии ЖВП и печени ВИЧ инфекция. Клиника, лечение, профилактика
ВИЧ инфекция. Клиника, лечение, профилактика Черепно-мозговая травма. Классификация
Черепно-мозговая травма. Классификация Рак полового члена
Рак полового члена Загальні принципи діагностики і лікування онкологічних хворих
Загальні принципи діагностики і лікування онкологічних хворих Балалардағы қант диабетінің морфологиялық ерекшеліктері. Мориак синдромы
Балалардағы қант диабетінің морфологиялық ерекшеліктері. Мориак синдромы Науқасқа, оның отбасына және туыстарына каралы хабарды жеткiзу
Науқасқа, оның отбасына және туыстарына каралы хабарды жеткiзу Черный мор (чума)
Черный мор (чума) Фехтование. Рациональное питание спортсменов
Фехтование. Рациональное питание спортсменов Лихорадка. Типы лихорадок в зависимости от величины температуры тела
Лихорадка. Типы лихорадок в зависимости от величины температуры тела Gastroenterology. Exam preparation
Gastroenterology. Exam preparation Esophageal Cancer
Esophageal Cancer Лабораторное оборудование
Лабораторное оборудование Иммундық жауаптың нейро эндокринді реттелуі
Иммундық жауаптың нейро эндокринді реттелуі zapor_Smagulova_342
zapor_Smagulova_342 Паратуберкулез. Індеттік ерекшеліктері
Паратуберкулез. Індеттік ерекшеліктері Анемиялық синдром кезінде клиникалық лабараториялық сипаттама
Анемиялық синдром кезінде клиникалық лабараториялық сипаттама