Содержание
- 2. Жоспар Кіріспе Негізгі бөлім ДЗ сапасын бақылау GLP Даму тарихы GLP негізгі міндеті Қолдану аймағы GLP
- 3. Кіріспе Дәрі-дәрмек сапасы ауруларды емдеу және алдын алу, зор денсаулық және өмір сүру жағдайының жоғары сапасы
- 4. ДД.ММ.20ГГ Қазақстанда 63 фармацевтикалық қызмет нысандарында фармацевтикалық препараттарды өндіру, тасымалдау, сақтау және жүзеге асыру талаптарын анықтайтын
- 5. Тиісті фармацевтикалық практикаларды бекіту туралы Қазақстан Республикасы Денсаулық сақтау және әлеуметтік даму министрінің 2015 жылғы 27
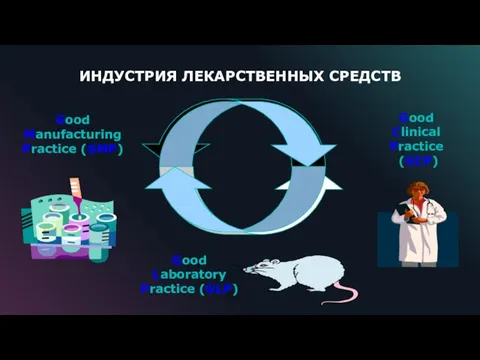
- 6. Good Manufacturing Practice (GMP) Good Clinical Practice (GCP) Good Laboratory Practice (GLP) ИНДУСТРИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
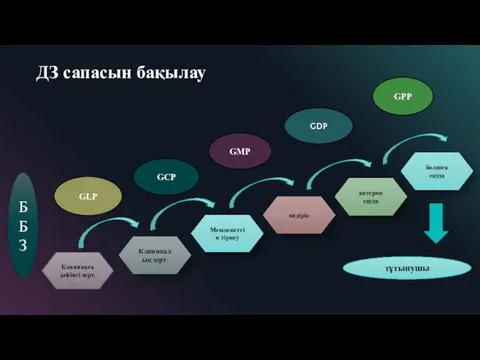
- 7. ДЗ сапасын бақылау ББЗ Клиникаға дейінгі зерт. Клиникалық зерт. Мемлекеттік тіркеу өндіріс көтерме сауда бөлшек сауда
- 8. GLP GLP стандарты (ағылшын Good Laboratory Practice -Тиісті лабораториялық практика) - зертханалық нәтижелерінің дәйектілігі мен сенімділігін
- 9. МЕЖДУНАРОДНЫЙ СТАНДАРТ «OECD Principles on Good Laboratory Practice» (OECD, ENV/MC/CHEM(98)17, 1997 г.) НАЦИОНАЛЬНЫЕ СТАНДАРТЫ «Принципы надлежащей
- 10. Даму тарихы GLP жүйесі 20 жылдан астам уақыт бойы жұмыс істеп келеді. Бастапқыда GLP стандарттары жүйесінің
- 11. Даму тарихы GLP ережесін құру кезінде бұрын GMP талаптарына бекітілген сапаны бақылау принциптері қолданылды. Сонымен қатар,
- 12. GLP негізгі міндеті GLP негізгі міндеті - толық қадағалау және зерттеу барысында қалпына келтіруге мүмкіндік береді.
- 13. Клиникаға дейінгі зерттеулер ДД.ММ.20ГГ Жаңа ДЗ клиникаға дейінгі этапта зерттеудің мақсаты – олардың фармакологиялық қасиеттері мен
- 14. ДД.ММ.20ГГ ДОБАВИТЬ НИЖНИЙ КОЛОНТИТУЛ ► Фармакологиялық зерттеулер Фармакологиялық зерттеулер жаңа ДЗ негізгі әсерін, оның ағзадағы маңызды
- 15. СХЕМА ДОКЛИНИЧЕСКИХ ИСПЫТАНИЙ НА БЕЗОПАСНОСТЬ
- 16. ДД.ММ.20XX Бұл стандарт клиникалық емес фармацевтикалық өнімдер, пестицидтер, косметикалық өнімдер, ветеринариялық препараттар, тамақ және азық қоспалары
- 17. GLP талаптары
- 18. GLP принциптері
- 19. 58.31 Руководство исследовательской организации (Testing facility management) 58.33 Руководитель исследования (Study director) 58.35 Группа обеспечения качества
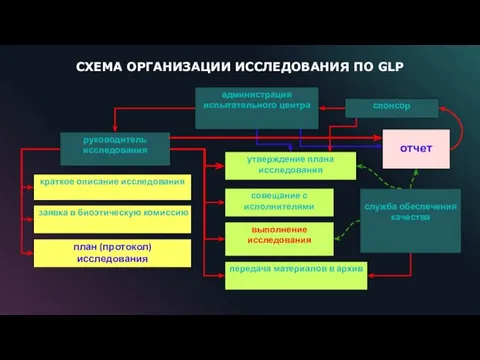
- 20. СХЕМА ОРГАНИЗАЦИИ ИССЛЕДОВАНИЯ ПО GLP руководитель исследования краткое описание исследования заявка в биоэтическую комиссию план (протокол)
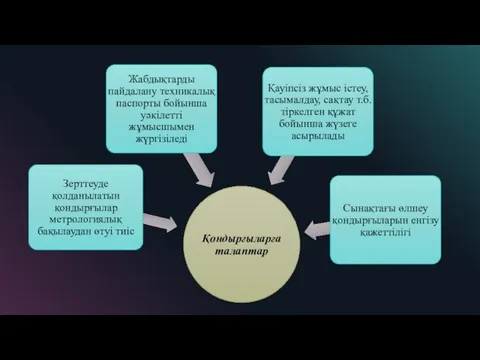
- 23. Бөлмелерге талаптар Бөлмелер арнайы талаптарға сай болу керек Зерттелінетін жануарлардың, ауру жануарлардың бөлмелері және тамақ сақтайтын
- 24. Лаборатория размещена в корпусе биомедицинских исследований (2450 кв.м) Филиала ИБХ РАН (Институт биоорганической химии Российской академии
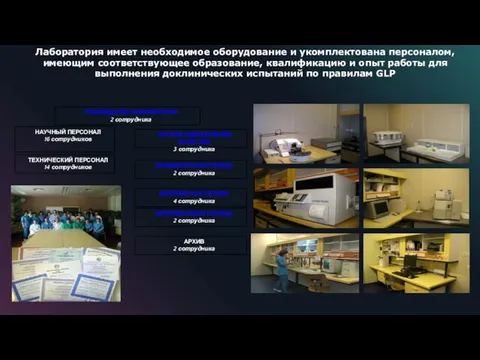
- 25. Лаборатория имеет необходимое оборудование и укомплектована персоналом, имеющим соответствующее образование, квалификацию и опыт работы для выполнения
- 26. Қорытынды Қорыта келгенде, GLP қағидаларын қамтитын медициналық және экологиялық қауіпсіздік саласындағы клиникалық емес сынақтарға зертханалық, жылыжайлық
- 27. Кері байланыс: 1. GLP- дегеніміз не? 2. Қандай стандарт құрамына кіреді? 3. GLP стандарты қай кезде
- 29. Скачать презентацию





















 ВКР: Эффективность применения препарата “Пиростоп” при пироплазмозе собак
ВКР: Эффективность применения препарата “Пиростоп” при пироплазмозе собак Реанимационные мероприятия в кардиологии
Реанимационные мероприятия в кардиологии Диагностикалық лапараскопия
Диагностикалық лапараскопия Грудное вскармливание и прикорм
Грудное вскармливание и прикорм Орнитоз (пситтакоз)
Орнитоз (пситтакоз) Абдоминальная хирургия. Кишечный шов
Абдоминальная хирургия. Кишечный шов Гонорея
Гонорея Оценка экотоксичности теллура методом биотестирования
Оценка экотоксичности теллура методом биотестирования Созылмалы жүрек жетіспеушілігі бар пациентті оқыту
Созылмалы жүрек жетіспеушілігі бар пациентті оқыту Балалардағы пародонт аурулары
Балалардағы пародонт аурулары Анамен бала денсаулығын қорғау
Анамен бала денсаулығын қорғау Уход за больными в хирургической клинике
Уход за больными в хирургической клинике Медицинские приборы
Медицинские приборы Қан кету. Оның түрлері. Қан кету кезіндегі алғашқы медициналық көмек
Қан кету. Оның түрлері. Қан кету кезіндегі алғашқы медициналық көмек Глаукома
Глаукома Инфаркт миокарда
Инфаркт миокарда Гигиена лечебно-профилактических учреждений
Гигиена лечебно-профилактических учреждений Гипотензивные средства
Гипотензивные средства Clinical removable prosthodontics. Fitting the framework
Clinical removable prosthodontics. Fitting the framework Жүрекке перкуссия мен аускультация жасау әдістерінің тарихы
Жүрекке перкуссия мен аускультация жасау әдістерінің тарихы Ультразвуковая диагностика костно-суставной системы
Ультразвуковая диагностика костно-суставной системы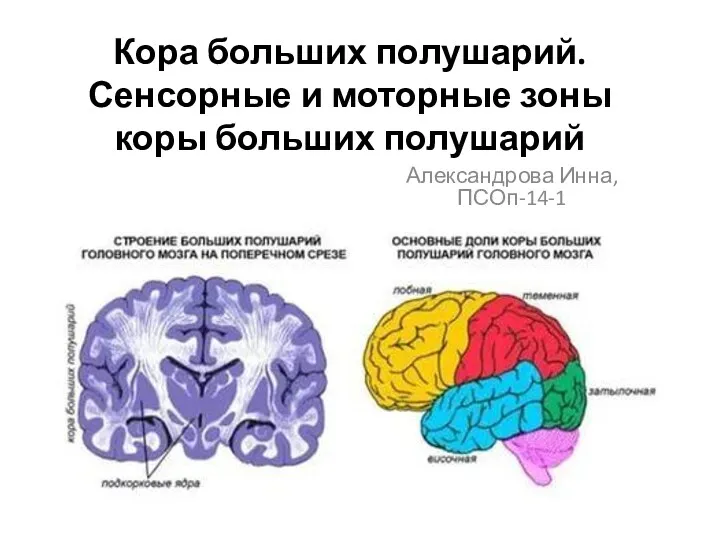 Кора больших полушарий. Сенсорные и моторные зоны коры больших полушарий
Кора больших полушарий. Сенсорные и моторные зоны коры больших полушарий Санитарные нормы и правила
Санитарные нормы и правила Антиадренергиялық заттар
Антиадренергиялық заттар ИСПОЛЬЗОВАНИЕ ИКТ ПРИ КОРРЕКЦИИ НАРУШЕНИЙ ЗВУКОПРОИЗНОШЕНИЯ
ИСПОЛЬЗОВАНИЕ ИКТ ПРИ КОРРЕКЦИИ НАРУШЕНИЙ ЗВУКОПРОИЗНОШЕНИЯ Природне вигодовування дітей раннього віку
Природне вигодовування дітей раннього віку Пищевые отравления
Пищевые отравления Жұқпалы аурулар
Жұқпалы аурулар