Содержание
- 2. Иммуноглобулины Ig/антитела – АГ-распознающие молекулы В-клеток В-клетки организма продуцируют антитела ко всем возможным АГ Индивидуальная В-клетка
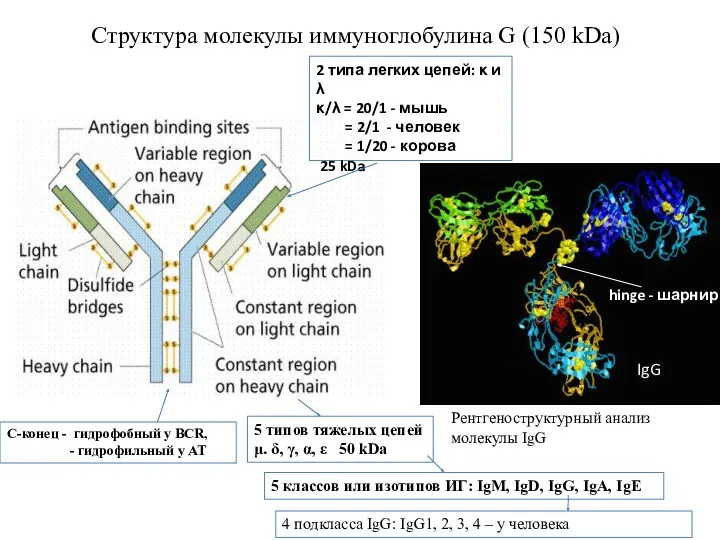
- 3. Структура молекулы иммуноглобулина G (150 kDa) С-конец - гидрофобный у BCR, - гидрофильный у АТ IgG
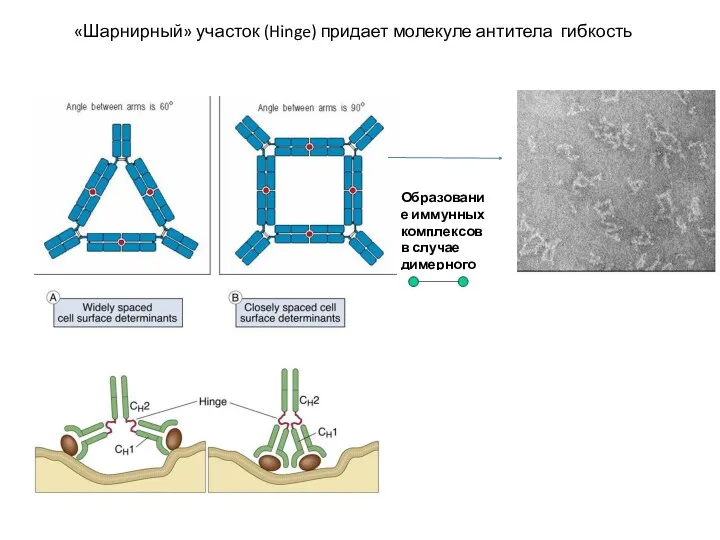
- 4. «Шарнирный» участок (Hinge) придает молекуле антитела гибкость Образование иммунных комплексов в случае димерного АГ
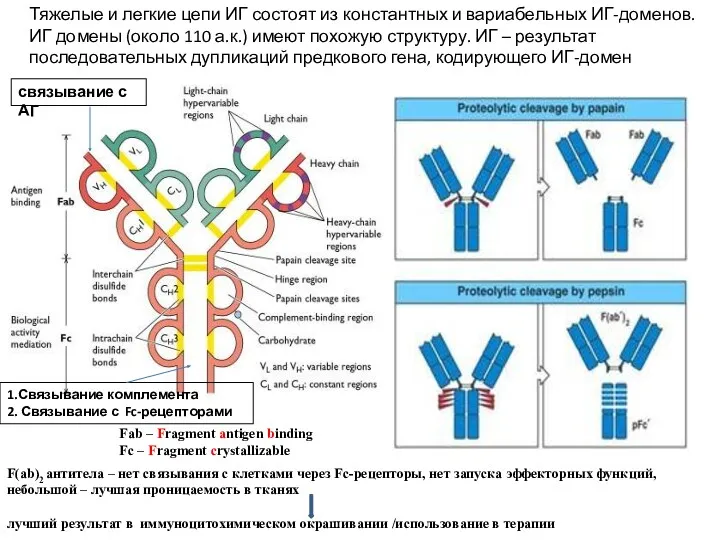
- 5. Тяжелые и легкие цепи ИГ состоят из константных и вариабельных ИГ-доменов. ИГ домены (около 110 а.к.)
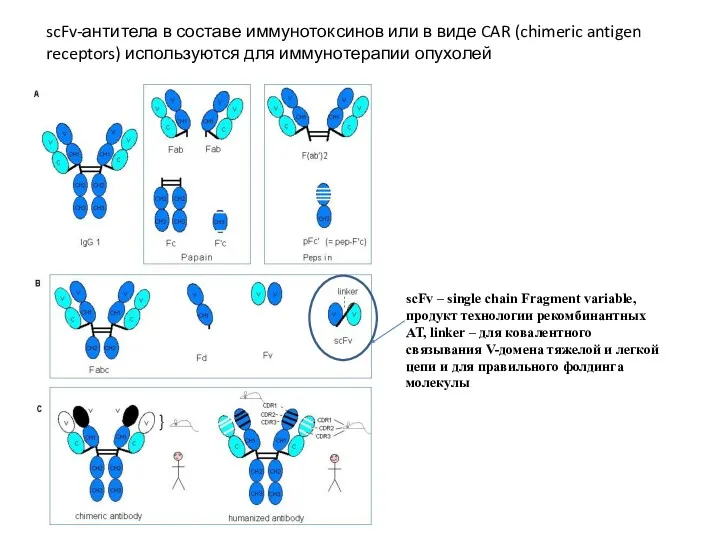
- 6. scFv – single chain Fragment variable, продукт технологии рекомбинантных АТ, linker – для ковалентного связывания V-домена
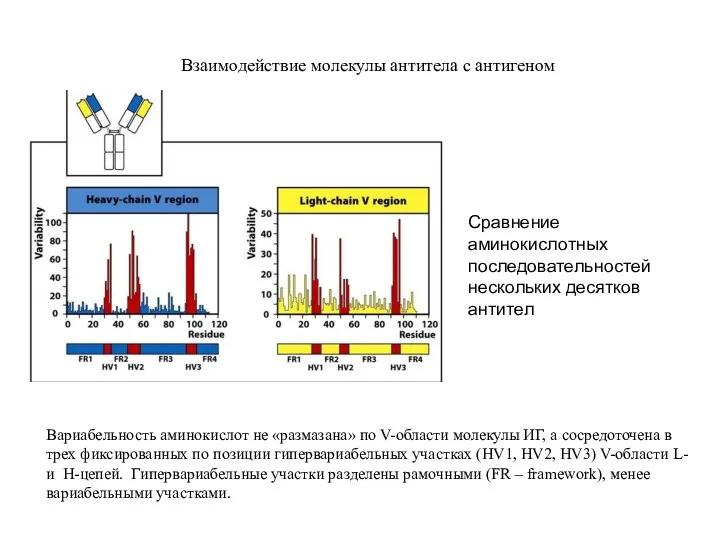
- 7. Взаимодействие молекулы антитела с антигеном Вариабельность аминокислот не «размазана» по V-области молекулы ИГ, а сосредоточена в
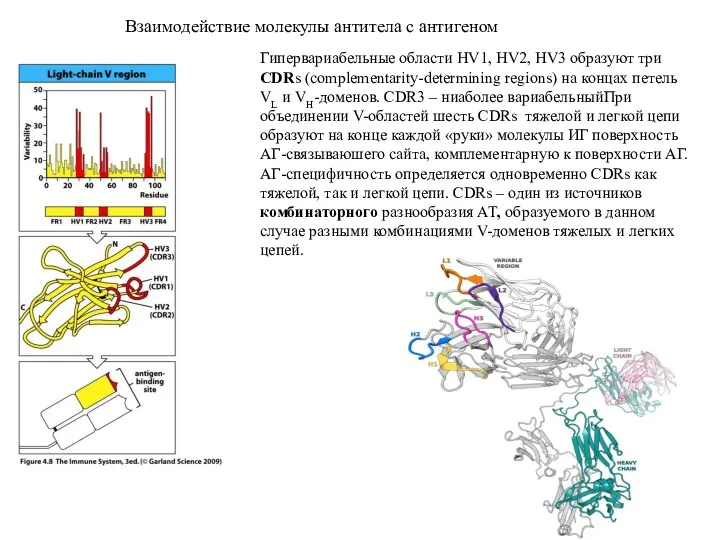
- 8. Взаимодействие молекулы антитела с антигеном Гипервариабельные области HV1, HV2, HV3 образуют три CDRs (complementarity-determining regions) на
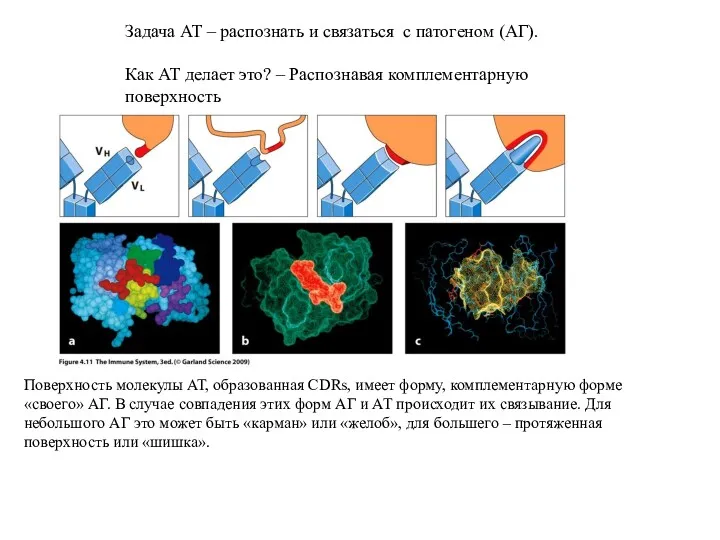
- 9. Задача АТ – распознать и связаться с патогеном (АГ). Как АТ делает это? – Распознавая комплементарную
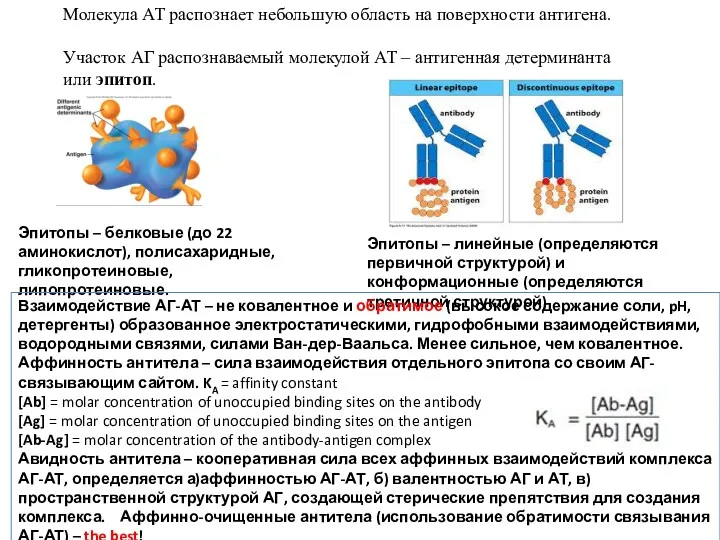
- 10. Молекула АТ распознает небольшую область на поверхности антигена. Участок АГ распознаваемый молекулой АТ – антигенная детерминанта
- 11. Генерирование разнообразия иммуноглобулинов Потенциальный репертуар иммуноглобулинов или число вариантов специфичностей антител в организме человека – 1011
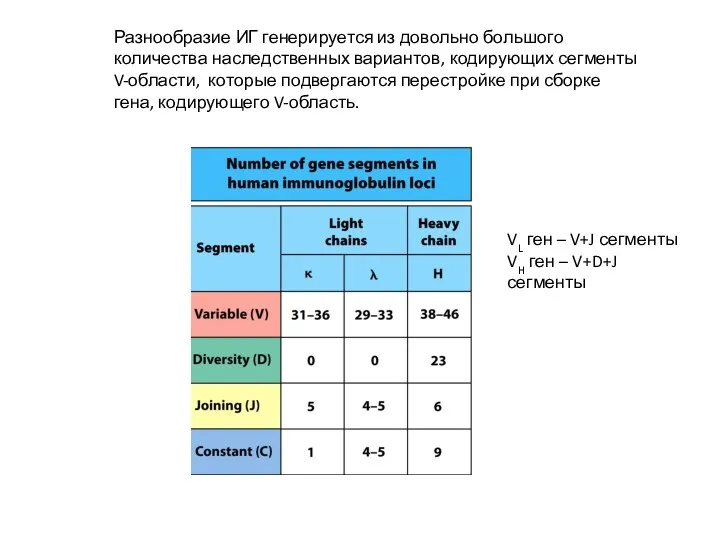
- 12. Разнообразие ИГ генерируется из довольно большого количества наследственных вариантов, кодирующих сегменты V-области, которые подвергаются перестройке при
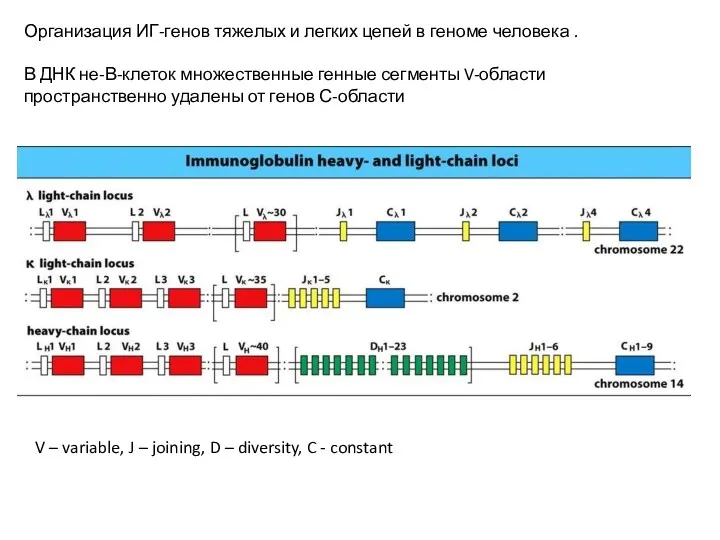
- 13. Организация ИГ-генов тяжелых и легких цепей в геноме человека . В ДНК не-В-клеток множественные генные сегменты
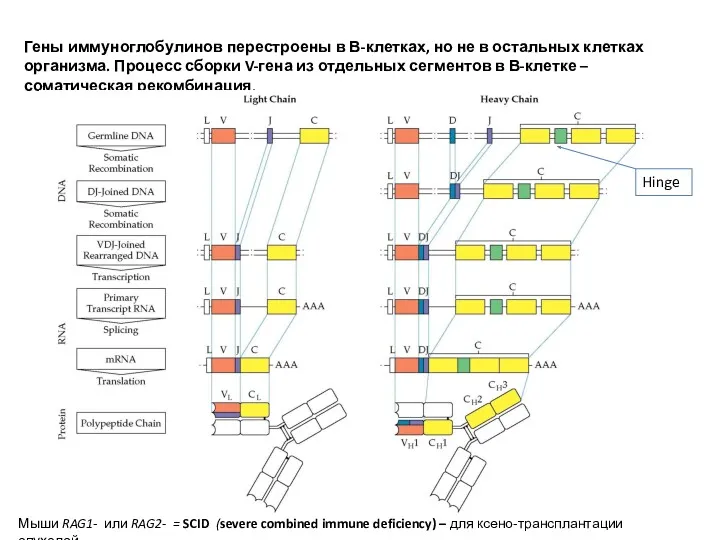
- 14. Гены иммуноглобулинов перестроены в В-клетках, но не в остальных клетках организма. Процесс сборки V-гена из отдельных
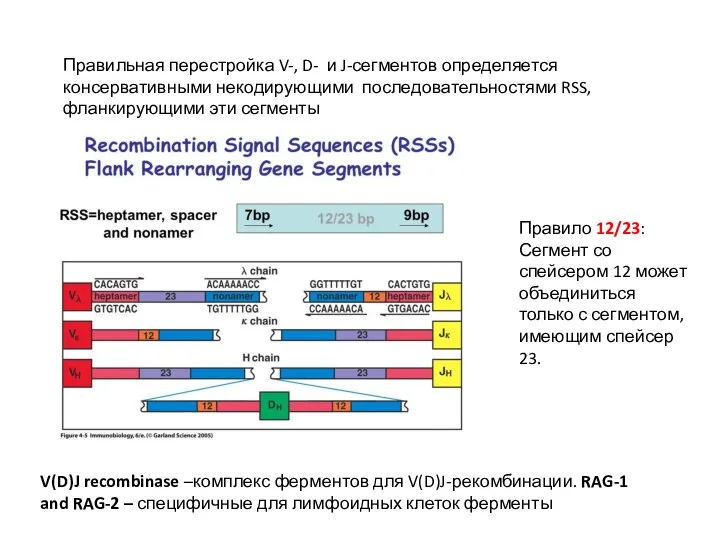
- 15. Правильная перестройка V-, D- и J-сегментов определяется консервативными некодирующими последовательностями RSS, фланкирующими эти сегменты Правило 12/23:
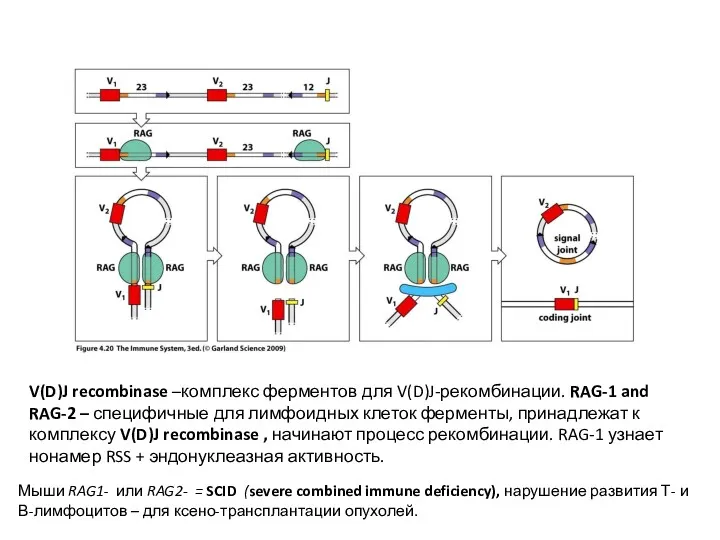
- 16. V(D)J recombinase –комплекс ферментов для V(D)J-рекомбинации. RAG-1 and RAG-2 – специфичные для лимфоидных клеток ферменты, принадлежат
- 17. Четыре главных процесса генерируют разнообразие молекул антител: Экзон V-области образуется от комбинации двух V-J (L-цепи) или
- 18. + 5. Класс-переключение – разнообразие С-областей = функциональное разнообразие антител
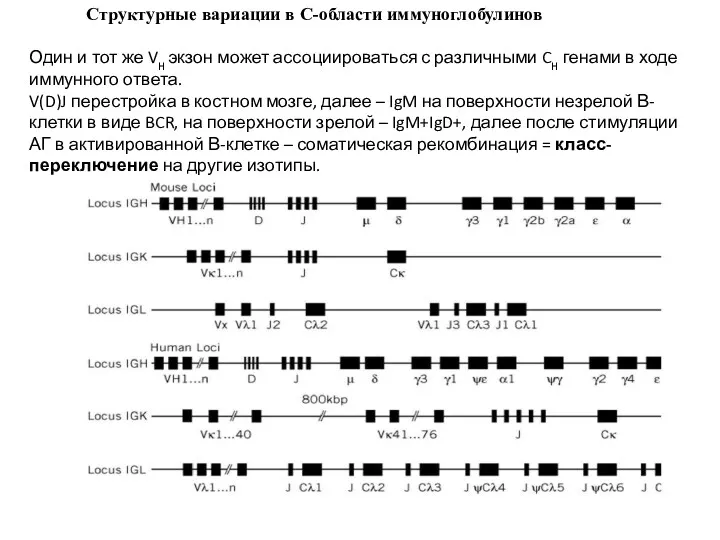
- 19. Структурные вариации в С-области иммуноглобулинов Один и тот же VH экзон может ассоциироваться с различными CH
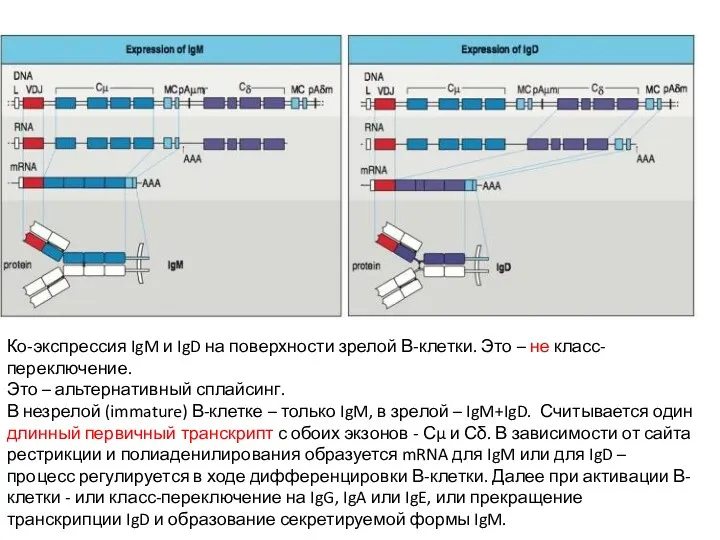
- 20. Ко-экспрессия IgM и IgD на поверхности зрелой В-клетки. Это – не класс-переключение. Это – альтернативный сплайсинг.
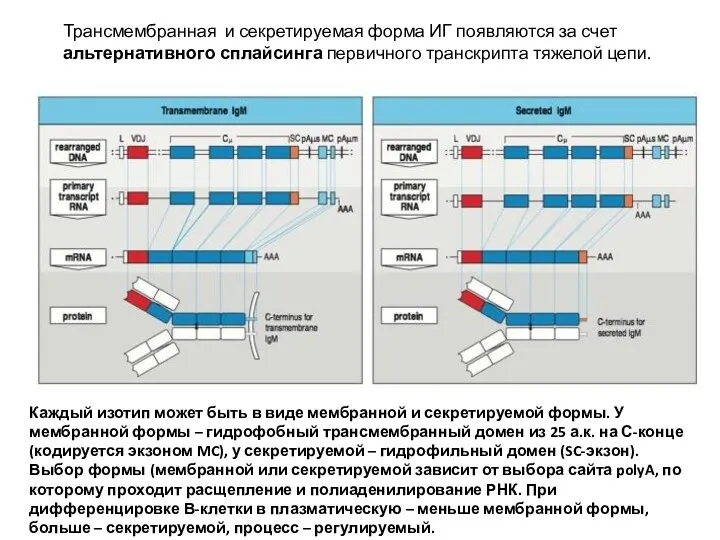
- 21. Трансмембранная и секретируемая форма ИГ появляются за счет альтернативного сплайсинга первичного транскрипта тяжелой цепи. Каждый изотип
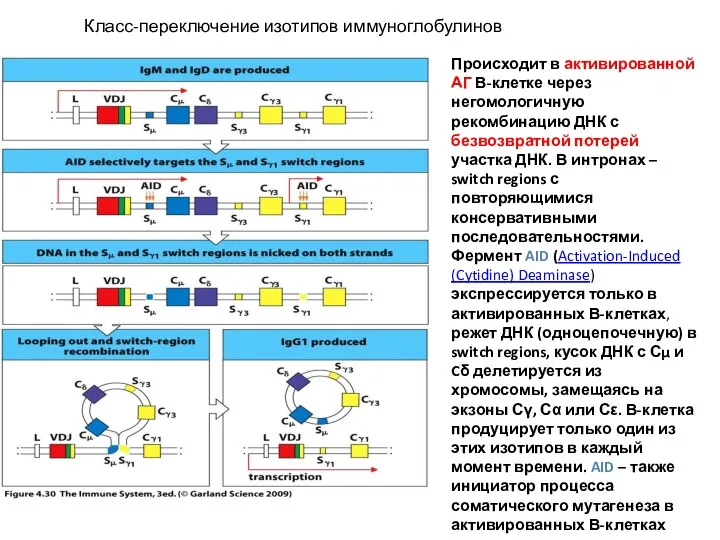
- 22. Класс-переключение изотипов иммуноглобулинов Происходит в активированной АГ В-клетке через негомологичную рекомбинацию ДНК с безвозвратной потерей участка
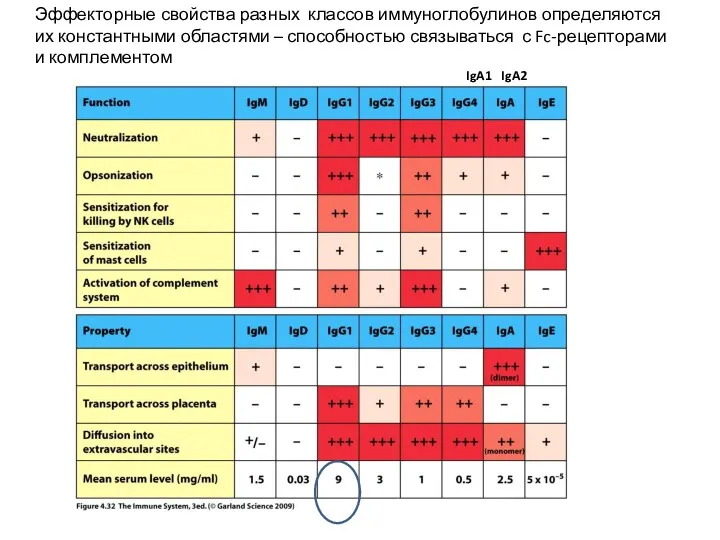
- 23. Эффекторные свойства разных классов иммуноглобулинов определяются их константными областями – способностью связываться с Fc-рецепторами и комплементом
- 24. Образует пентамеры при секреции Образует димеры при секреции
- 25. Антитела – важный инструмент в биологическом эксперименте, медицинской диагностике и терапии. Поликлональные антитела Моноклональные антитела
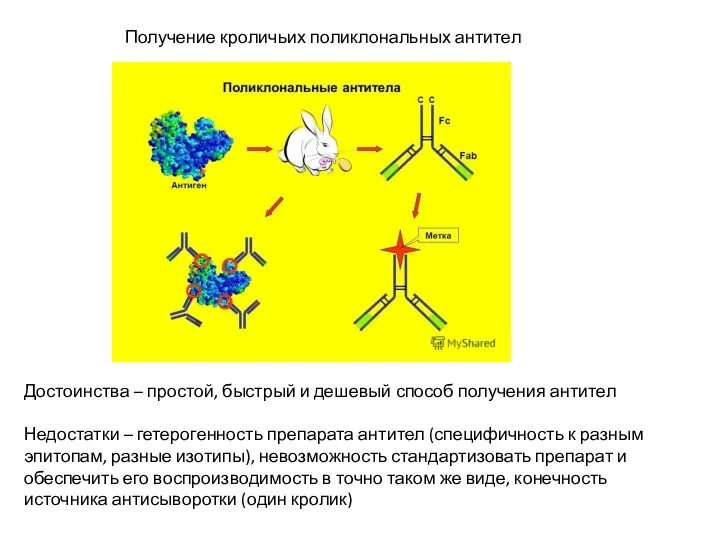
- 26. Получение кроличьих поликлональных антител Достоинства – простой, быстрый и дешевый способ получения антител Недостатки – гетерогенность
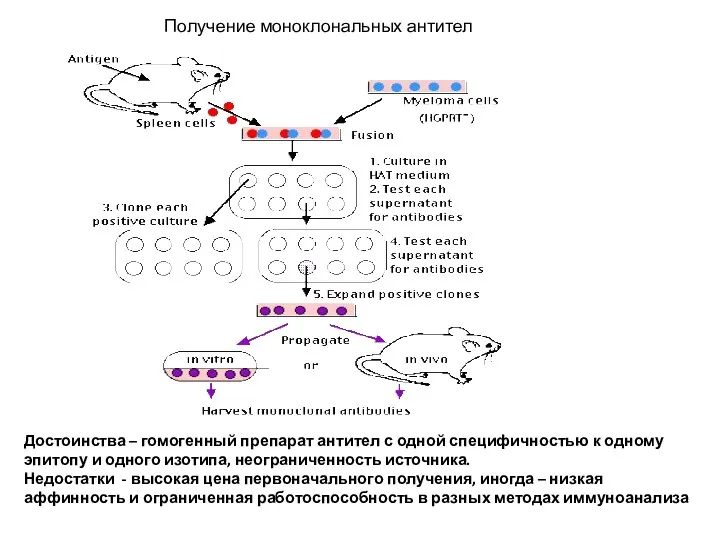
- 27. Получение моноклональных антител Достоинства – гомогенный препарат антител с одной специфичностью к одному эпитопу и одного
- 28. Методы иммуноанализа: ELISA (ИФА) Иммуноблоттинг – dot-blot (дот-блот), Western blotting Иммуногистохимия + иммуноцитохимия Flow Cytometry
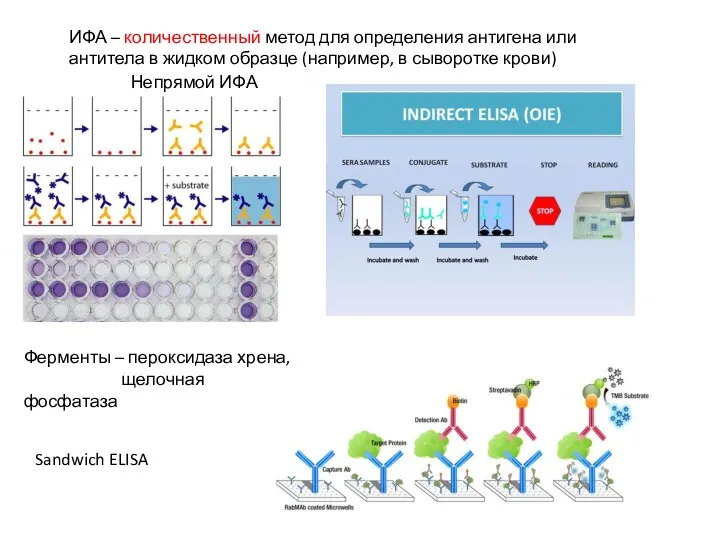
- 29. ИФА – количественный метод для определения антигена или антитела в жидком образце (например, в сыворотке крови)
- 30. Dot-blot анализ на нитроцеллюлозной мембране
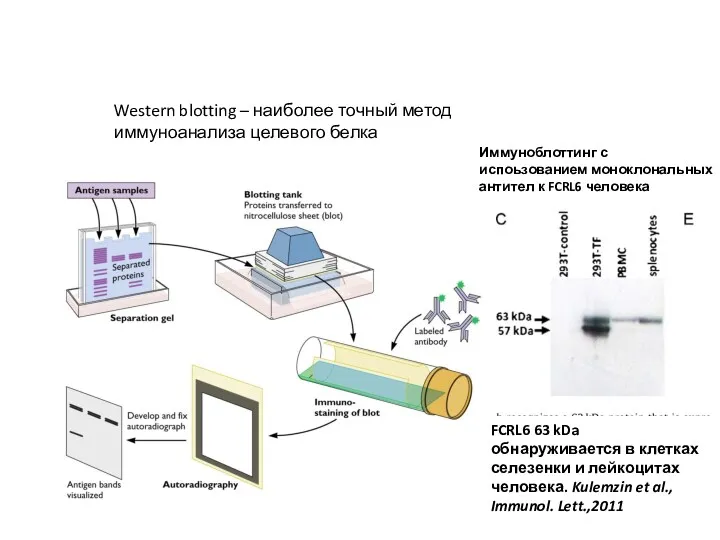
- 31. Western blotting – наиболее точный метод иммуноанализа целевого белка FCRL6 63 kDa обнаруживается в клетках селезенки
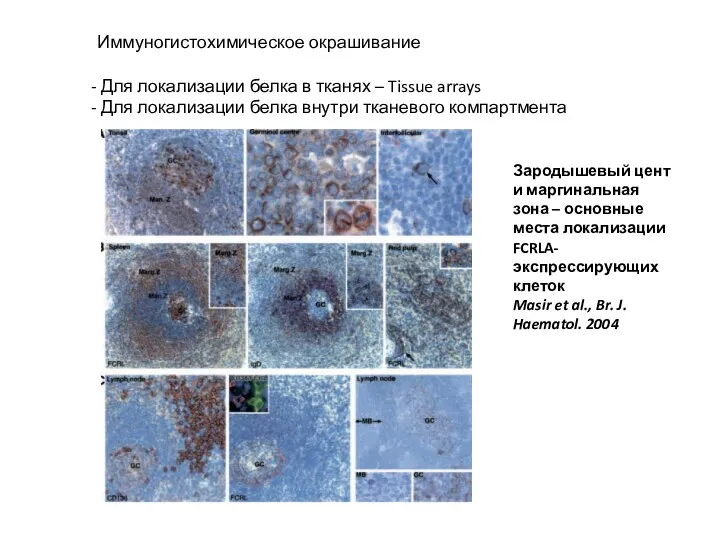
- 32. Иммуногистохимическое окрашивание Для локализации белка в тканях – Tissue arrays Для локализации белка внутри тканевого компартмента
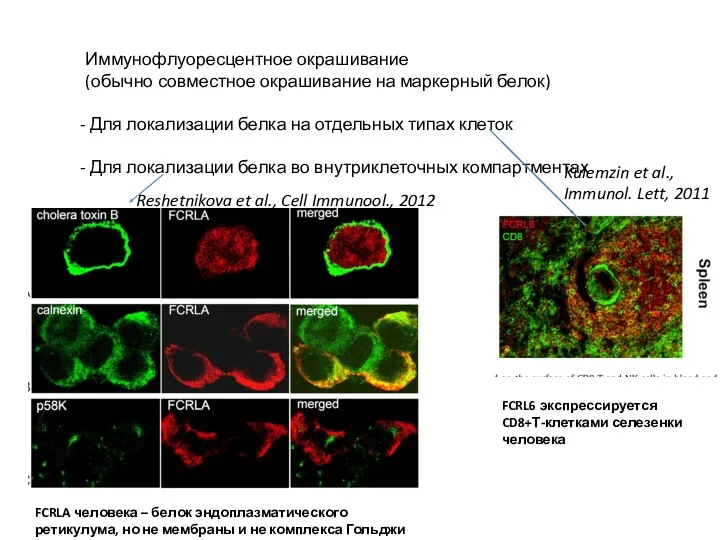
- 33. Иммунофлуоресцентное окрашивание (обычно совместное окрашивание на маркерный белок) Для локализации белка на отдельных типах клеток Для
- 35. Скачать презентацию








 Фармацевтическая опека пациентов при боли в горле и гортани
Фармацевтическая опека пациентов при боли в горле и гортани Қызыл жалпақ теміреткі. Жүйелі қызыл жегі. Күлдіреуікше. Ауыз қуысындағы көріністері
Қызыл жалпақ теміреткі. Жүйелі қызыл жегі. Күлдіреуікше. Ауыз қуысындағы көріністері Реабилитация больных, перенесших инсульт
Реабилитация больных, перенесших инсульт Бронхоэктатикалық ауру, диагностикасы және емдеу әдістері
Бронхоэктатикалық ауру, диагностикасы және емдеу әдістері Кровотечение из дистальных отделов желудочно-кишечного тракта у детей. Занятие № 4
Кровотечение из дистальных отделов желудочно-кишечного тракта у детей. Занятие № 4 Неопухолевые заболевания ободочной кишки. Часть № 2
Неопухолевые заболевания ободочной кишки. Часть № 2 Наркотические анальгетики
Наркотические анальгетики Диалектика. Диалектиканың негізгі заңдары
Диалектика. Диалектиканың негізгі заңдары Метаболический синдром
Метаболический синдром Жүкті әйелдің тамақтануы
Жүкті әйелдің тамақтануы Программа дифференциальной диагностики при суставном синдроме. Критерии диагностики ревматических заболеваний
Программа дифференциальной диагностики при суставном синдроме. Критерии диагностики ревматических заболеваний Пульпит. Клиническая классификация пульпита:
Пульпит. Клиническая классификация пульпита: Фракционная терапия лица
Фракционная терапия лица Методы обеспечения проходимости дыхательных путей. Коникотомия. Интубация трахеи
Методы обеспечения проходимости дыхательных путей. Коникотомия. Интубация трахеи Диагностикалық лапароскопия әдістері
Диагностикалық лапароскопия әдістері Закаливающие процедуры для детей дошкольного возраста
Закаливающие процедуры для детей дошкольного возраста Хирургическая инфекция
Хирургическая инфекция Острая ревматическая лихорадка
Острая ревматическая лихорадка Антибиотики. Синтетические противомикробные средства
Антибиотики. Синтетические противомикробные средства Жұқпалы аурулар
Жұқпалы аурулар Железы внешней, внутренней и смешанной секреции
Железы внешней, внутренней и смешанной секреции Фармакология кардиотонических препаратов
Фармакология кардиотонических препаратов Особенности вакцинации отдельных контингентов людей. Вакцины будущего
Особенности вакцинации отдельных контингентов людей. Вакцины будущего Плевриты
Плевриты Физиология родов
Физиология родов Дифференциальная диагностика заболеваний ВНЧС. Методы обследования при заболеваниях височно-нижнечелюстного сустава
Дифференциальная диагностика заболеваний ВНЧС. Методы обследования при заболеваниях височно-нижнечелюстного сустава Анатомо-физиологические особенности нервной системы у детей. Нервно-психическое развитие
Анатомо-физиологические особенности нервной системы у детей. Нервно-психическое развитие Ротова порожнина. Травлення в ротовій порожнині
Ротова порожнина. Травлення в ротовій порожнині