Содержание
- 2. Апластическая анемия Впервые описана Паулем Эрлихом в 1888 году у беременной женщины 21 года. Сам термин
- 3. Апластическая анемия Конституциональная (анемия Даймонда - Блекфена, анемия Фанкони и другие) Приобретенная
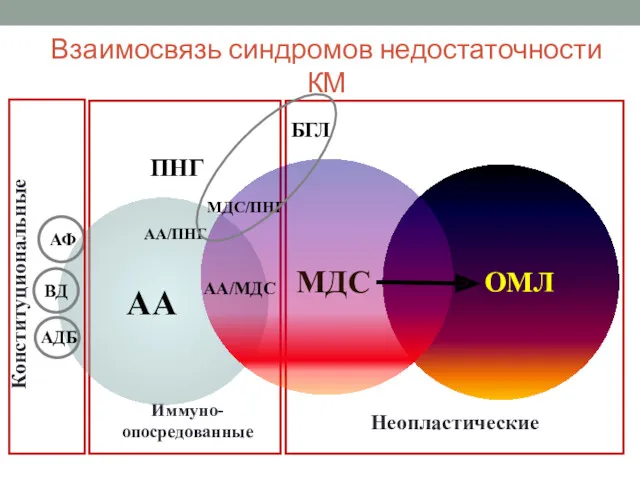
- 4. Взаимосвязь синдромов недостаточности КМ ОМЛ ПНГ АА МДС БГЛ ВД АДБ АА/ПНГ МДС/ПНГ АА/МДС АФ
- 5. Приобретенная АА. Эпидемиология 2 случая на 1 000 000 населения в мире ежегодно страны Азии :
- 6. Классификация приобретенной АА 1. Идиопатическая АА 2. Вторичные АА, связанные с: радиацией; л/c и химическими токсинами
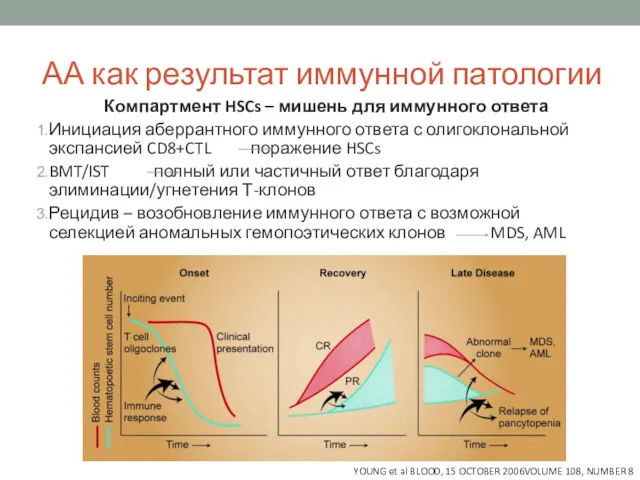
- 7. АА как результат иммунной патологии Компартмент HSCs – мишень для иммунного ответа Инициация аберрантного иммунного ответа
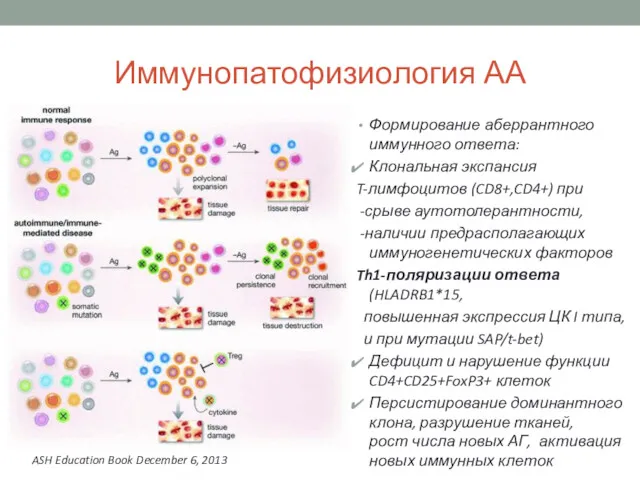
- 8. Иммунопатофизиология АА Формирование аберрантного иммунного ответа: Клональная экспансия T-лимфоцитов (CD8+,CD4+) при -срыве аутотолерантности, -наличии предрасполагающих иммуногенетических
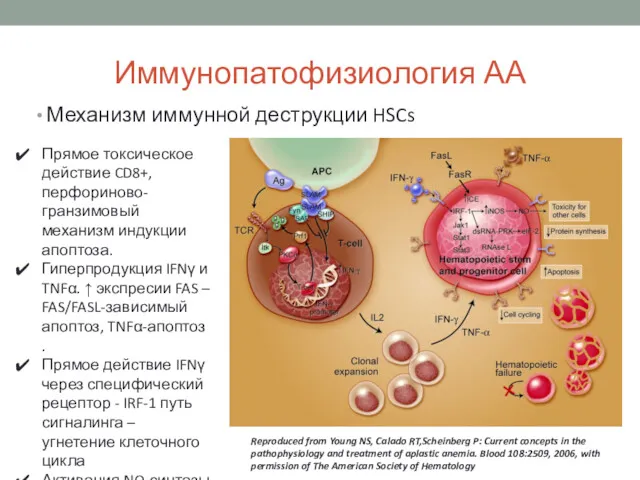
- 9. Иммунопатофизиология АА Механизм иммунной деструкции HSCs Reproduced from Young NS, Calado RT,Scheinberg P: Current concepts in
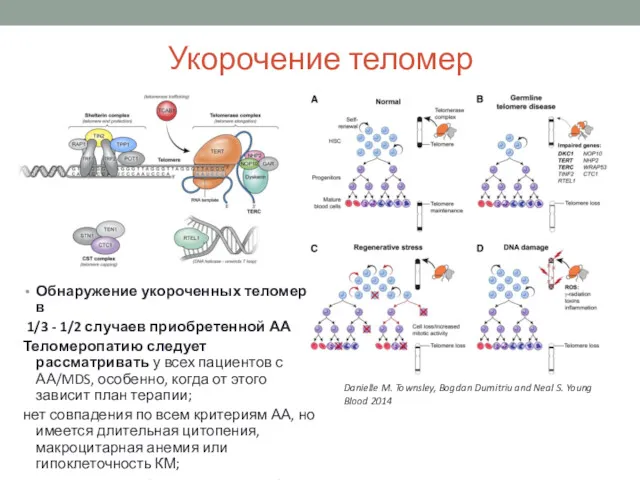
- 10. Укорочение теломер Обнаружение укороченных теломер в 1/3 - 1/2 случаев приобретенной АА Теломеропатию следует рассматривать у
- 11. Критерии диагноза АА (IAAAS) Панцитопения (не менее 2 из 3): гемоглобин ≤ 100 г/л или гематокрит
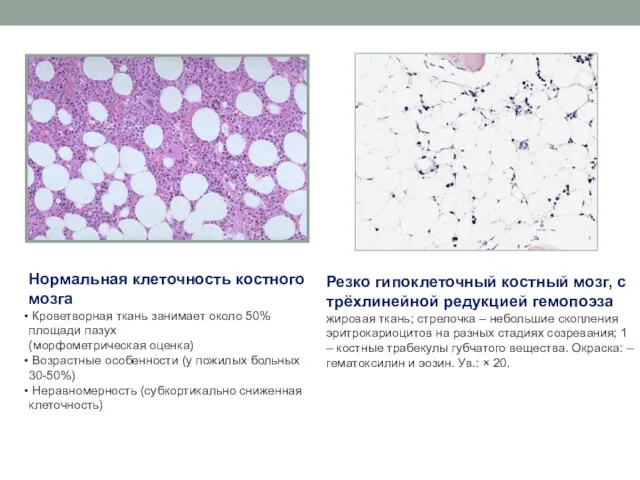
- 12. Нормальная клеточность костного мозга Кроветворная ткань занимает около 50% площади пазух (морфометрическая оценка) Возрастные особенности (у
- 13. Оценка тяжести АА Сверхтяжелая апластическая анемия (СТАА) Как для тяжелой АА при уровне нейтрофилов Тяжелая апластическая
- 14. Первичное обследование пациента Далее: исключение костномозговой недостаточности другой этиологии и конституциональной АА Цитогенетика клеток КМ (FISH-анализ
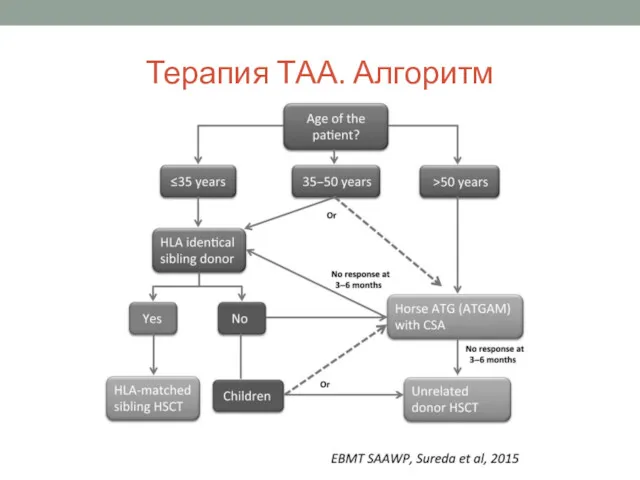
- 15. Терапия ТАА. Алгоритм
- 16. АТГ + ЦсA как первая линия ИСТ НТАА вне зависимости от выраженности цитопении и трансфузионного статуса
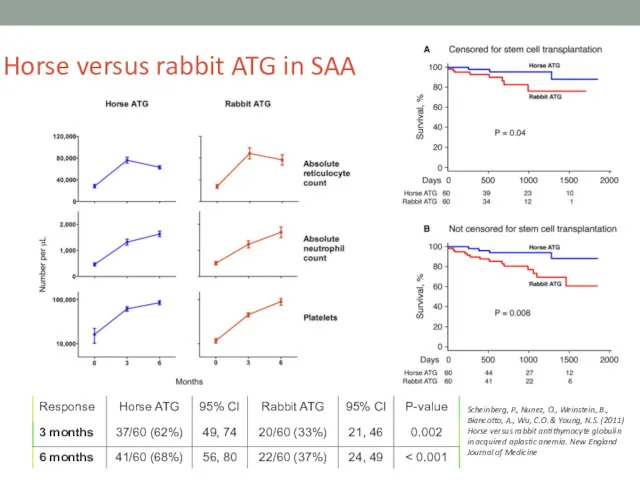
- 17. Horse versus rabbit ATG in SAA Scheinberg, P., Nunez, O., Weinstein, B., Biancotto, A., Wu, C.O.
- 18. Протокол первой линии ИСТ Атгам 40 мг/кг/д ГКС в/в с ATG, затем per os 1 2
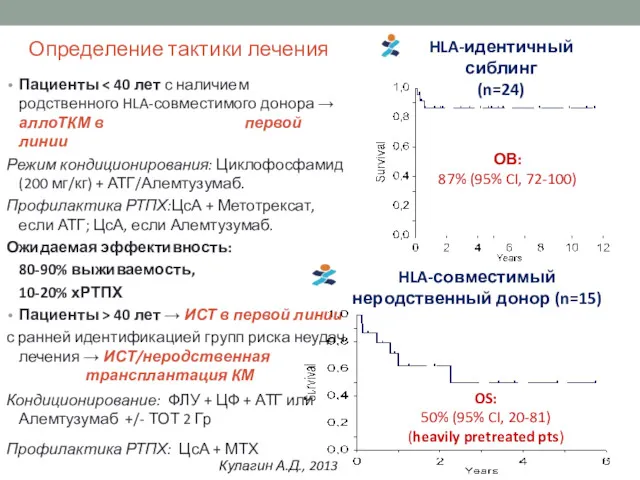
- 19. ТГСК в терапии АА АллоТГСК: Родственная Неродственная Альтернативный донор (гаплоидентичная, пуповинная кровь) Проведение аллоТГСК зависит от:
- 20. Пациенты Режим кондиционирования: Циклофосфамид(200 мг/кг) + АТГ/Алемтузумаб. Профилактика РТПХ:ЦсА + Метотрексат, если АТГ; ЦсА, если Алемтузумаб.
- 21. Поддерживающая терапия 1. Трансфузия эритроцитов и тромбоцитов Гемотрансфузия улучшает качество жизни (1А); Показания к трансфузии эритроцитов
- 22. 2. Профилактика инфекционных осложнений Инфекции – одна из частых причин смерти при АА (Marsh & Kulasekararaj,
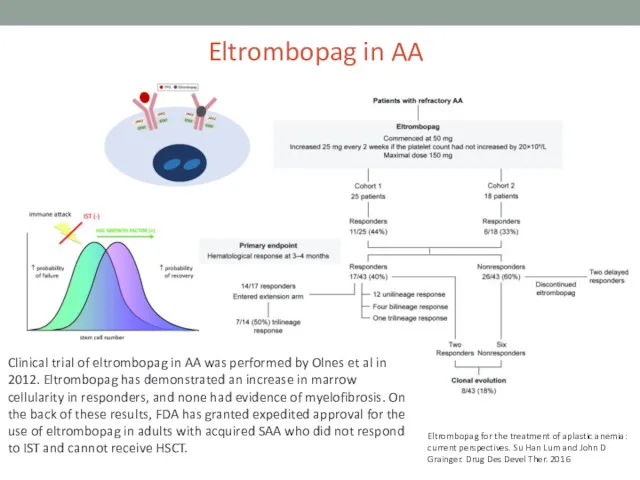
- 23. Eltrombopag in AA Clinical trial of eltrombopag in AA was performed by Olnes et al in
- 24. Выводы: Приобретенная АА – результат многокомпонентного иммунопатологического процесса с наличием конституциональной предрасположенности Изучение длины теломер –
- 26. Скачать презентацию













 Епідеміологічний метод дослідження, його структура і зміст. Система епідеміологічного нагляду. Епідеміологія туберкульозу
Епідеміологічний метод дослідження, його структура і зміст. Система епідеміологічного нагляду. Епідеміологія туберкульозу Синдром гострого запалення слизових оболонок дихальних шляхів. Грип
Синдром гострого запалення слизових оболонок дихальних шляхів. Грип Ас қорыту физиологиясы
Ас қорыту физиологиясы Физиология и методы исследования системы гемостаза
Физиология и методы исследования системы гемостаза Родовые повреждения новорожденных
Родовые повреждения новорожденных Ведение нормальных родов. Управление родовым актом
Ведение нормальных родов. Управление родовым актом Трансформация патологии населения. Основные социально-гигиенические проблемы современного общества
Трансформация патологии населения. Основные социально-гигиенические проблемы современного общества Профилактика ВИЧ - инфекций
Профилактика ВИЧ - инфекций Рефракция и аккомодация глаза
Рефракция и аккомодация глаза Негізгі психопатологиялық синдромдар
Негізгі психопатологиялық синдромдар Риски расстройств пищевого поведения у спортсменов
Риски расстройств пищевого поведения у спортсменов Дошкольный и преддошкольный возраст
Дошкольный и преддошкольный возраст Беременность при туберкулезе
Беременность при туберкулезе Введение в иммунологию. Иммунная система
Введение в иммунологию. Иммунная система Гіполіпідемічні лікарські засоби
Гіполіпідемічні лікарські засоби Анатомо-физиологические особенности спинального и эпидурального пространств у детей раннего возраста
Анатомо-физиологические особенности спинального и эпидурального пространств у детей раннего возраста История медицинского халата
История медицинского халата Кровь. Функции и состав крови. Группы крови
Кровь. Функции и состав крови. Группы крови Бронхообструктивный синдром
Бронхообструктивный синдром ВПР мочевыводящей системы
ВПР мочевыводящей системы Пороки развития ЦНС
Пороки развития ЦНС Equipment and instruments of dental clinic
Equipment and instruments of dental clinic Классификация острого панкреатита
Классификация острого панкреатита Виявлення хворих на туберкульоз. (Лекція 2)
Виявлення хворих на туберкульоз. (Лекція 2) Ведение пациентов с болью в спине в практике терапевта и семейного врача
Ведение пациентов с болью в спине в практике терапевта и семейного врача Перикардиты у детей
Перикардиты у детей Инвазивный мониторинг внутричерепного давления
Инвазивный мониторинг внутричерепного давления Несеп жыныс жүйесі
Несеп жыныс жүйесі