Содержание
- 2. Введение «все есть яд, и ничто не лишено ядовитости. Одна только доза делает яд незаметным» Парацельс
- 3. Фармакокинетика – раздел фармакологии, изучающий судьбу лекарственного вещества в организме: всасывание распределение биотрансформация выведение Клиническая фармакокинетика
- 4. Инструкция лекарственные препаратов
- 5. Всасывание – это процесс проникновения лекарственного вещества из места введения в системный кровоток. При всасывании лекарственные
- 6. пассивная диффузия (фильтрация) – прохождение низкомолекулярных соединений через биологические мембраны (или поры) по градиенту концентрации активный
- 7. Факторы, влияющие на абсорбцию А. Относящиеся к веществу размер молекулы липо/гидрофильность наличие/отсутствие электрического заряда зависимость заряда
- 8. Обычно лекарственные вещества проникают через мембраны путем диффузии. Чем выше растворимость вещества в липидах, тем быстрее
- 9. Большинство лекарственных веществ являются слабыми кислотами или основаниями. Степень ионизации таких молекул в биологических средах зависит
- 10. Пример Ацетилсалициловая кислота (аспирин), рН 4,5 будет мало диссоциировать, рКа аспирина= 3,5 кодеин — слабое основание
- 11. Лекарственные формы пролонгированного высвобождения как правило (но не всегда) обеспечивающих пролонгированное действие. После проглатывания в кишечнике
- 12. матриксный тип - это форма, содержащая полимерную матрицу, в которую включены гранулы ЛС. В зависимости от
- 13. резервуарный тип представлен так называемой гастроинтестинальной терапевтической системой (GITS). Внутри таблетки GITS с осмотической системой высвобождения
- 14. Распределение лекарственных средств Распределение лекарств в организме – это процессы их проникновения через гистогематические барьеры из
- 15. Физиологические Фармакологические Факторы, влияющие на распределение лекарственных веществ
- 16. интенсивность регионарного кровотока в физиологических условиях; проницаемость мембран и соответствующих барьеров (например, гематоэнцефалического, плацентарного) для данного
- 17. факторы, от которых зависит способность вещества к абсорбции (преодоление биологических барьеров в процессе распределения происходит по
- 18. Проникнув в системный кровоток, лекарственные вещества связываются с белками плазмы крови. При этом слабые кислоты связываются
- 19. Свободная и связанная фракции лекарственного вещества находятся в состоянии динамического равновесия, которое подчиняется закону действующих масс
- 20. Лекарственные вещества конкурируют друг с другом и метаболитами за места связывания с белками крови. При этом
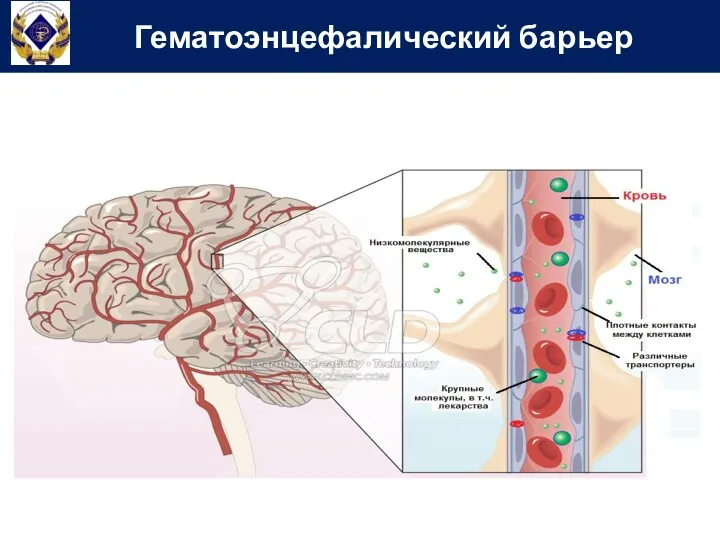
- 21. Через ГЭБ в ЦНС легко проникают липофильные неионизированные вещества путем диффузии. Гидрофильные ионизированные молекулы проникают в
- 22. Гематоэнцефалический барьер
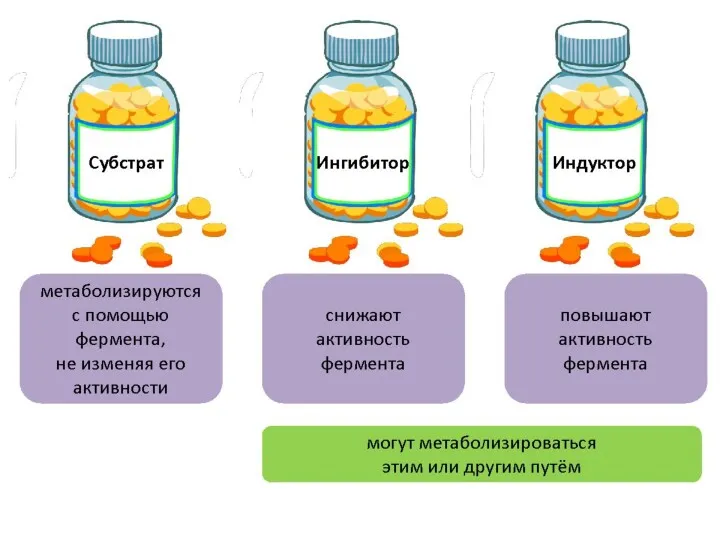
- 23. Биотрансформация Биотрансформация – процесс химического превращения лекарственных веществ в организме. В итоге биотрансформации обычно увеличивается растворимость
- 24. В реакциях биотрансформации можно выделить два этапа (две фазы), каждый из которых может иметь и самостоятельное
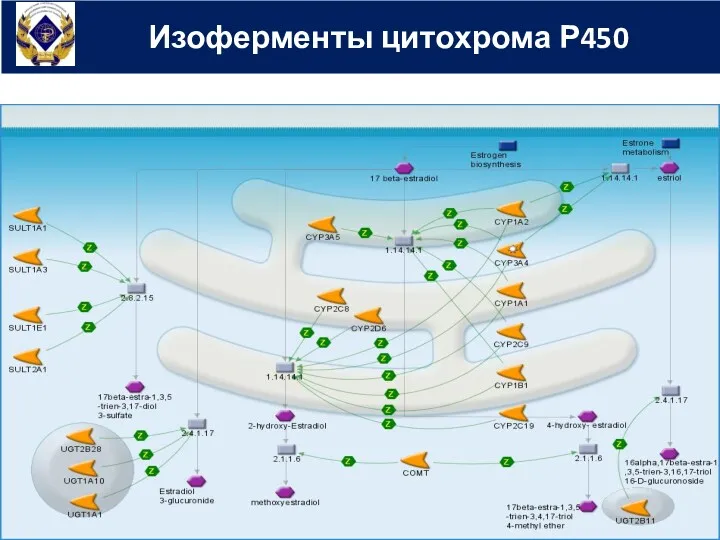
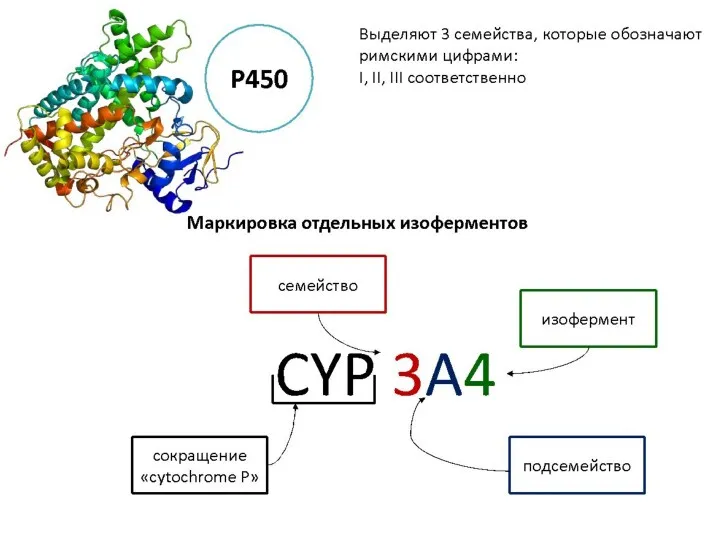
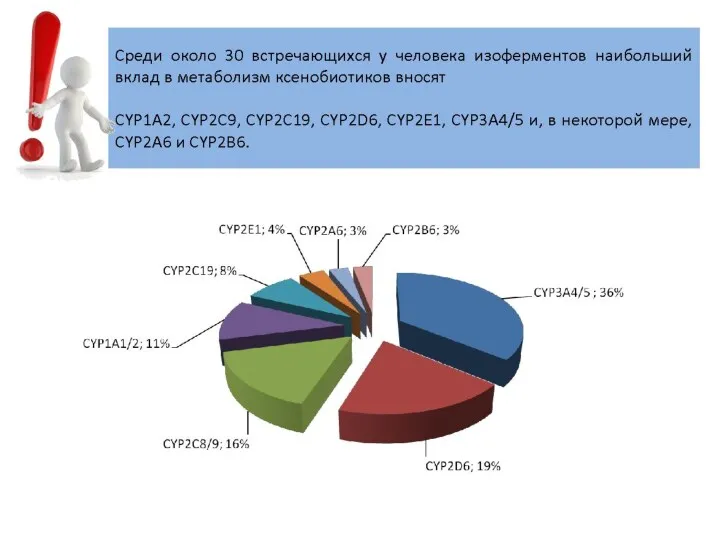
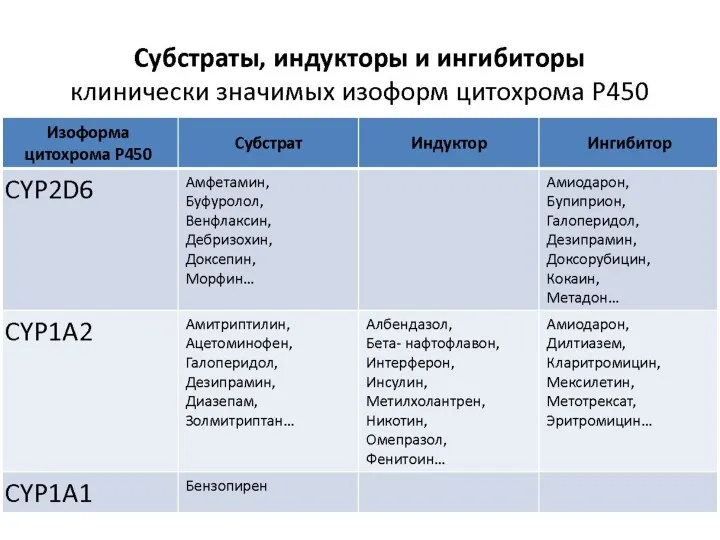
- 25. главная окисляющая система организма - система изоферментов цитохрома Р450 ее наибольшая активность отмечается в печени; она
- 26. Изоферменты цитохрома Р450
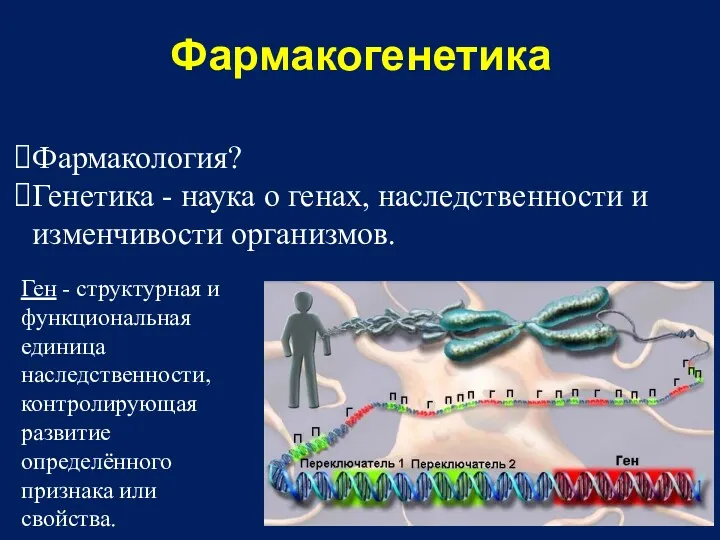
- 33. Фармакогенетика – раздел фармакологии, изучающий роль генетических факторов в формировании фармакологического ответа организма человека на лекарственное
- 34. Фармакогенетика Фармакология? Генетика - наука о генах, наследственности и изменчивости организмов. Ген - структурная и функциональная
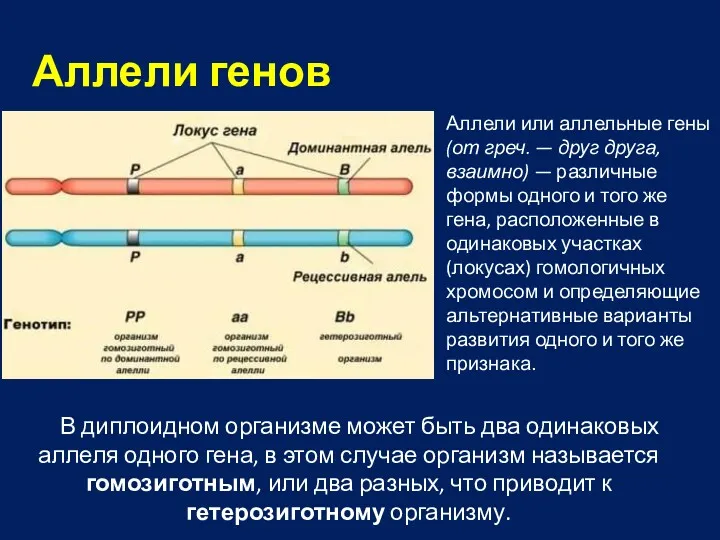
- 35. В диплоидном организме может быть два одинаковых аллеля одного гена, в этом случае организм называется гомозиготным,
- 36. Типы аллельного взаимодействия Полное доминирование — взаимодействие двух аллелей одного гена, когда доминантный аллель полностью исключает
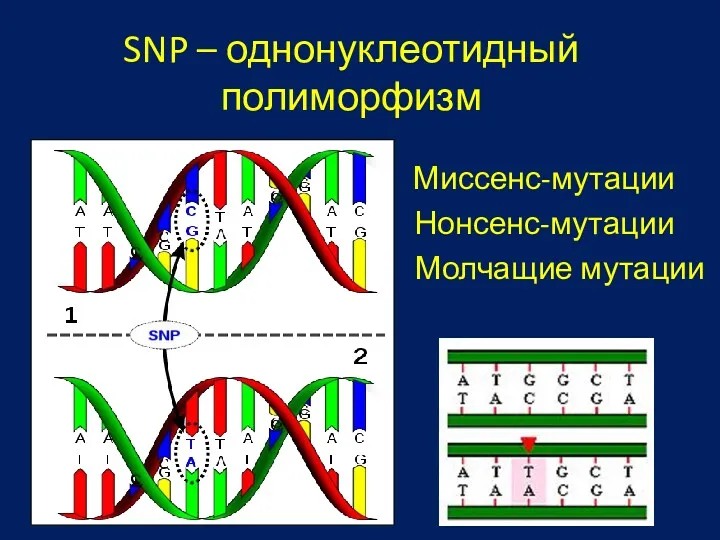
- 37. SNP – однонуклеотидный полиморфизм Молчащие мутации Нонсенс-мутации Миссенс-мутации
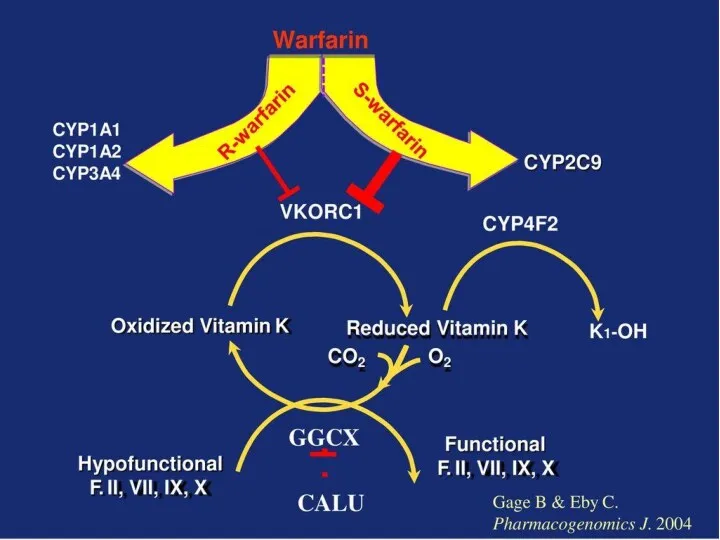
- 38. Оптимизация фармакотерапии с позиций 4П медицины Варфарин - антикоагулянт непрямого действия. Блокирует образование витамин-К-зависимых факторов свертывания
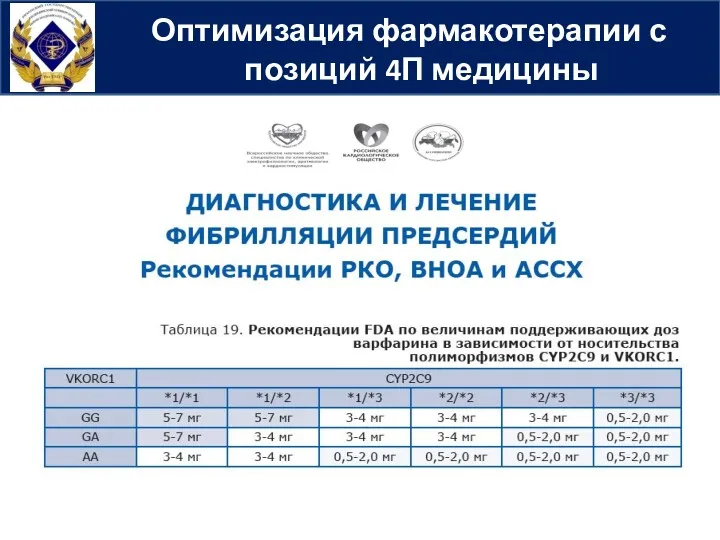
- 40. Оптимизация фармакотерапии с позиций 4П медицины
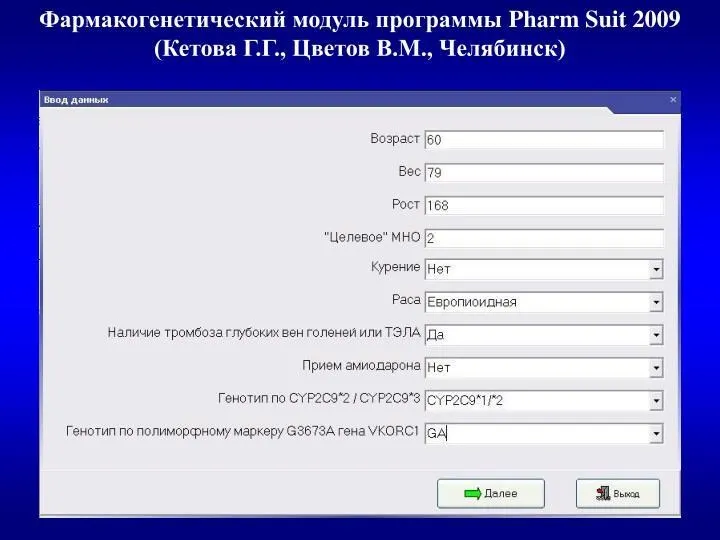
- 42. Рекомендованные фармакогенетические тесты
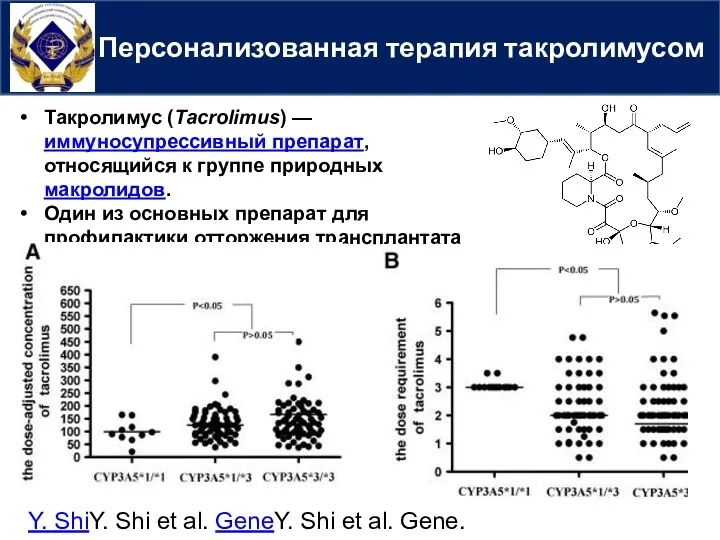
- 43. Персонализованная терапия такролимусом Такролимус (Tacrolimus) —иммуносупрессивный препарат, относящийся к группе природных макролидов. Один из основных препарат
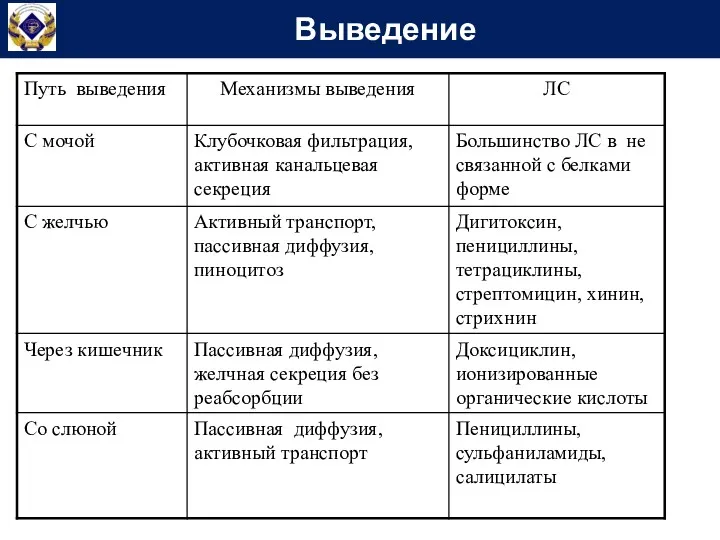
- 44. Выведение ЧЕРЕЗ ПОЧКИ ЧЕРЕЗ ЖКТ а) часть дозы, не всосавшаяся в ЖКТ (в неизмененном виде), б)
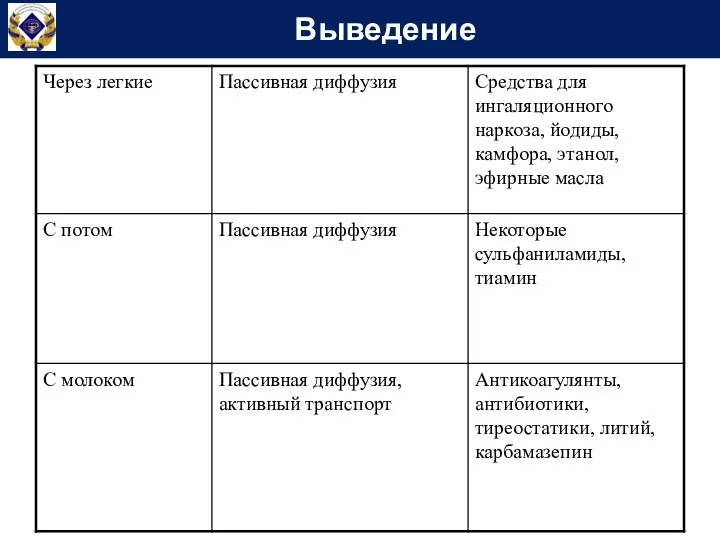
- 45. Выведение
- 46. Выведение
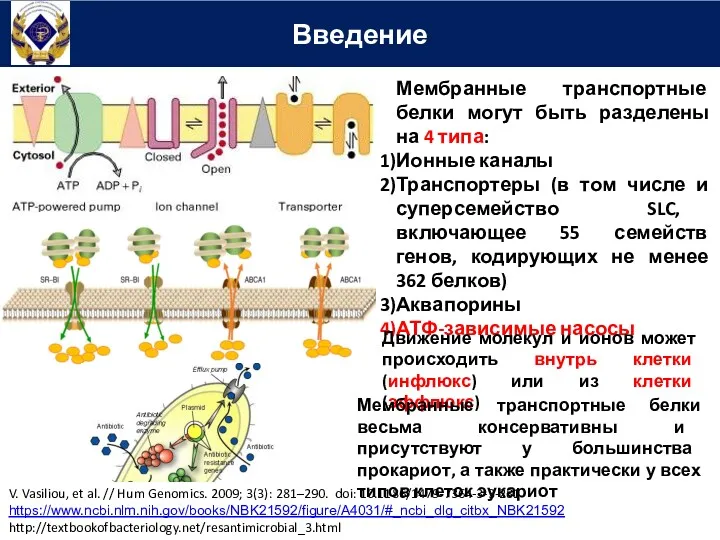
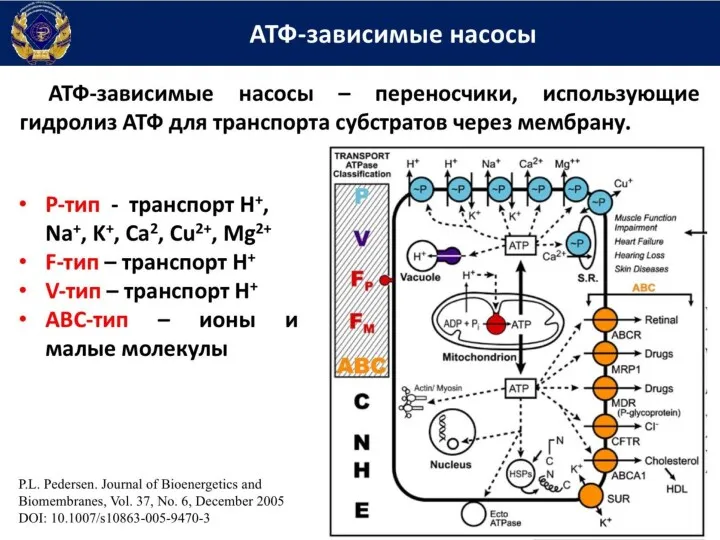
- 47. Введение Мембранные транспортные белки могут быть разделены на 4 типа: Ионные каналы Транспортеры (в том числе
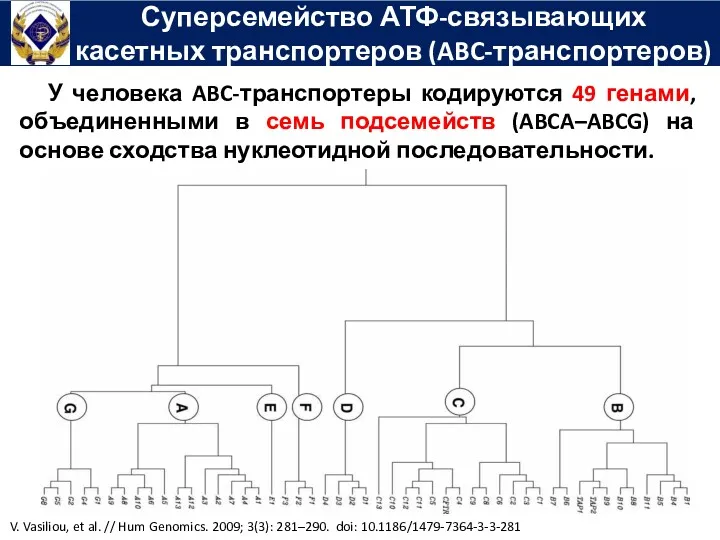
- 49. Суперсемейство АТФ-связывающих касетных транспортеров (ABC-транспортеров) У человека ABC-транспортеры кодируются 49 генами, объединенными в семь подсемейств (ABCA–ABCG)
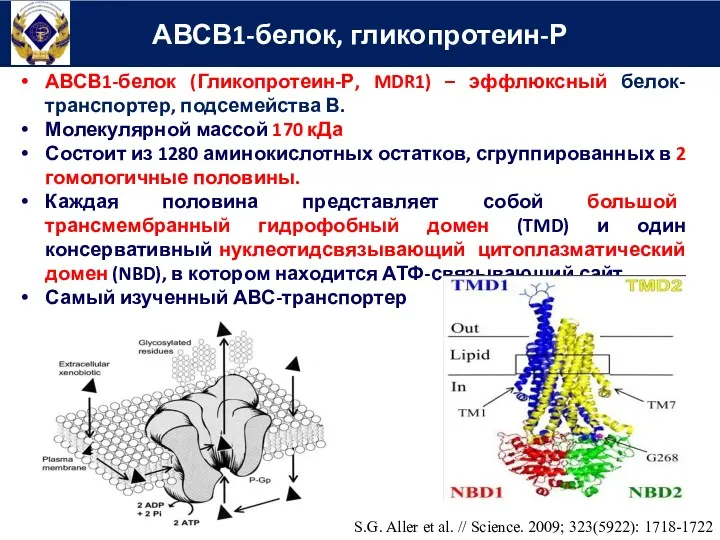
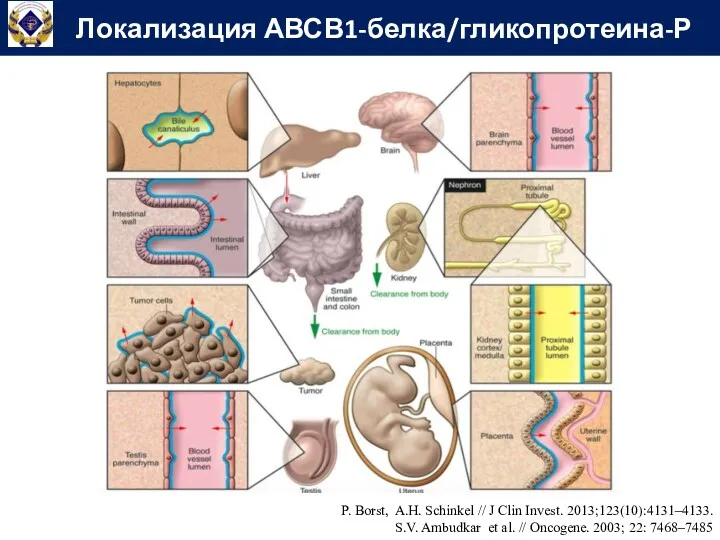
- 50. АВСВ1-белок (Гликопротеин-Р, MDR1) – эффлюксный белок-транспортер, подсемейства В. Молекулярной массой 170 кДа Состоит из 1280 аминокислотных
- 51. Локализация АВСВ1-белка/гликопротеина-Р P. Borst, A.H. Schinkel // J Clin Invest. 2013;123(10):4131–4133. S.V. Ambudkar et al. //
- 52. Резистентность опухолей к химиотерапии Транспорт эндогенных веществ (стероидные, тиреоидные гормоны) Участие в фармакокинетике (всасывании, распределении, выведении)
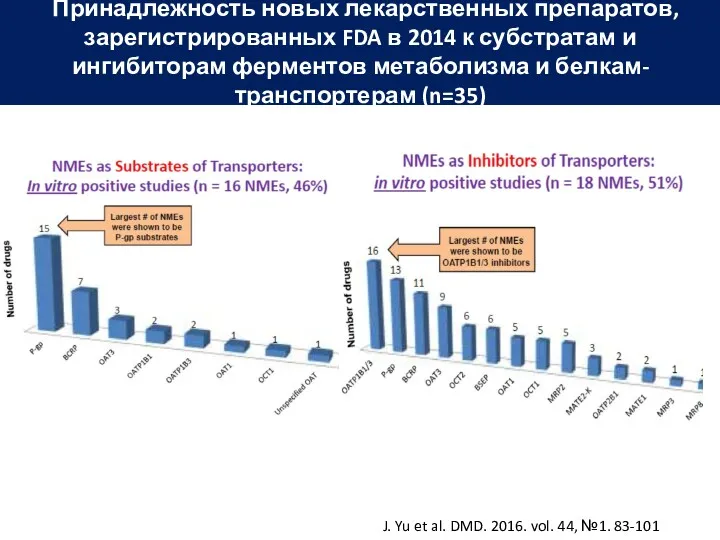
- 54. J. Yu et al. DMD. 2016. vol. 44, №1. 83-101 Принадлежность новых лекарственных препаратов, зарегистрированных FDA
- 55. Фармакокинетические параметры Для подбора индивидуальных доз и режимов дозирования лекарственных средств определяют показатели фармакокинетики. С этой
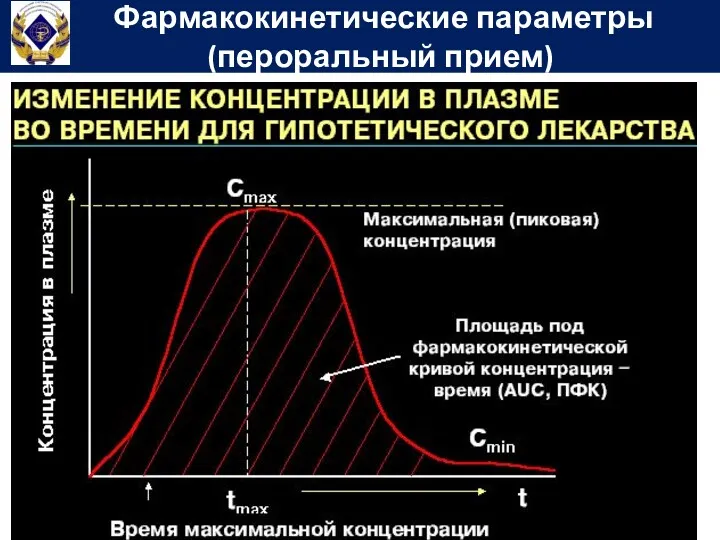
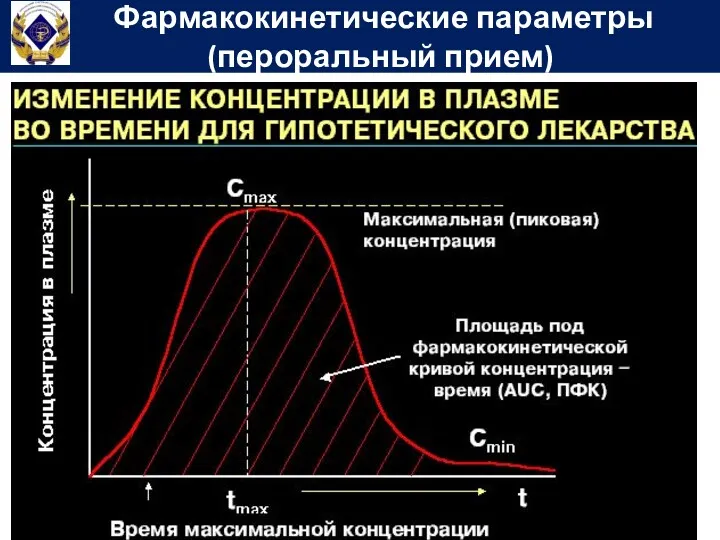
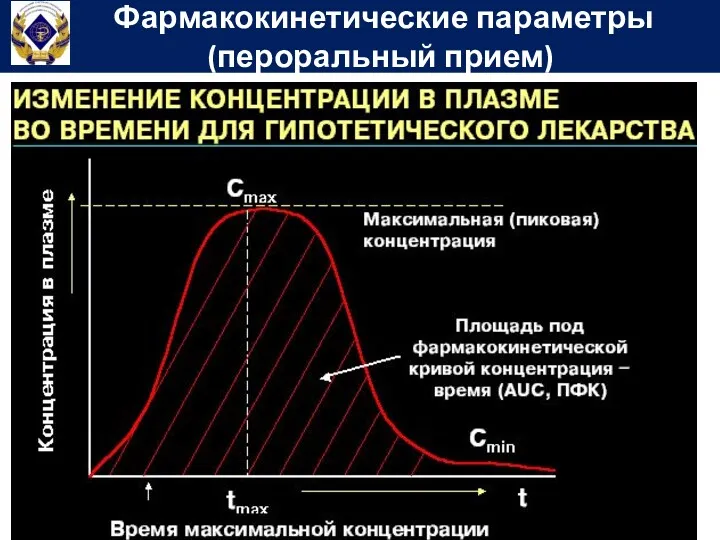
- 56. Фармакокинетические параметры (пероральный прием)
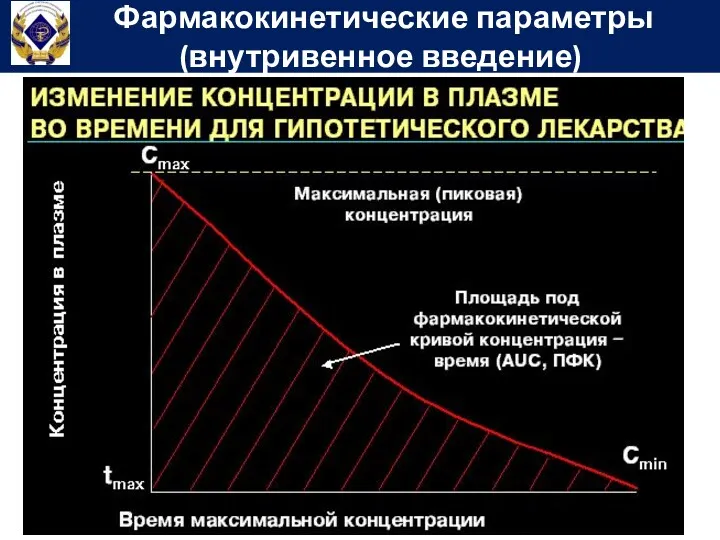
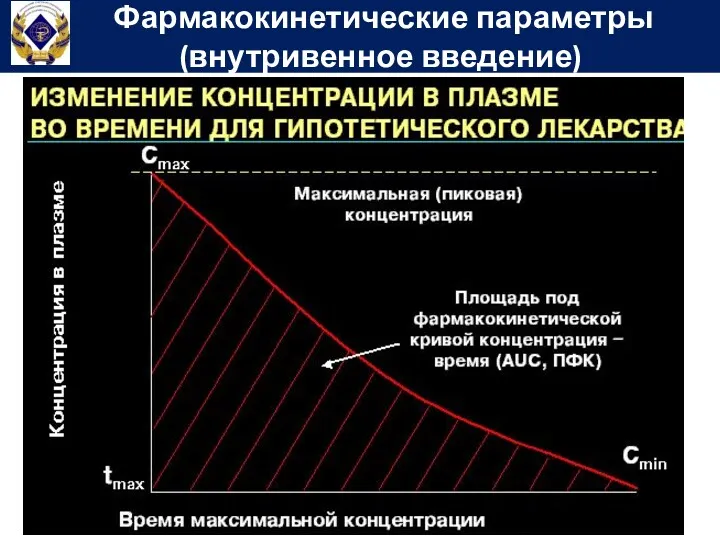
- 57. Фармакокинетические параметры (внутривенное введение)
- 58. Площадь под фармакокинетической кривой концентрация-время (Area under curve) – показывает общее количество лекарственного вещества, попавшего в
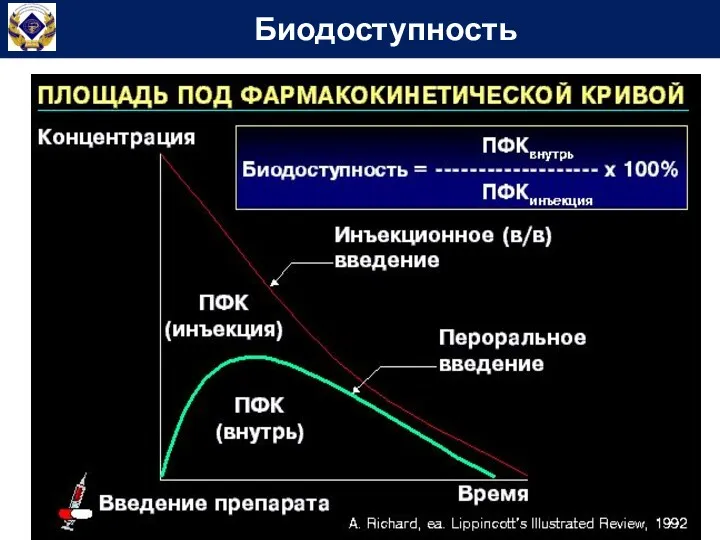
- 59. Биодоступность - часть дозы ЛС, выраженная в процентах, поступившая в системный кровоток после внесосудистого введения. Эта
- 60. Биодоступность
- 61. Константа скорости элиминации Кеl = tg α Размерность : час -1 Кеl отражает скорость элиминации (удаления)
- 62. Фармакокинетические параметры (внутривенное введение)
- 63. Фармакокинетические параметры (пероральный прием)
- 64. Начальная концентрация лекарственного вещества в крови Со Размерность: мкг/л Это условный параметр, который равен той концентрации
- 65. Фармакокинетические параметры (пероральный прием)
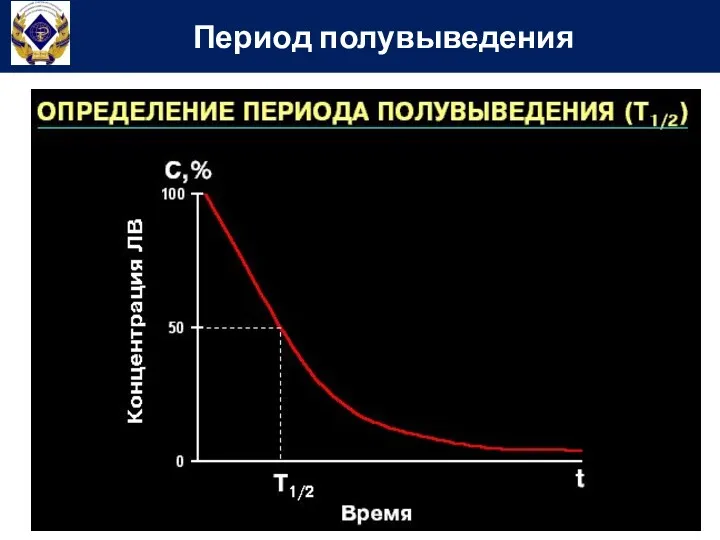
- 66. Период полувыведения – Т1/2 (период полуэлиминации, период полужизни) время, за которое плазменная концентрация вещества снижается в
- 67. Период полувыведения
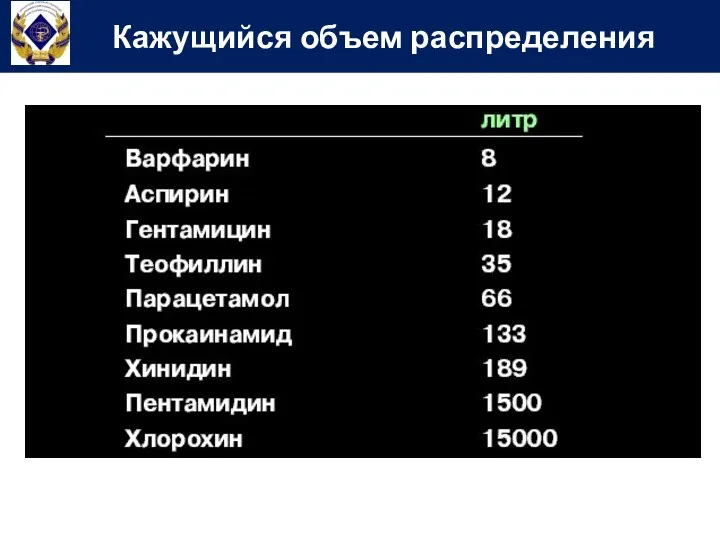
- 68. Кажущийся объем распределения
- 69. Кажущийся объем распределения
- 70. Кажущийся объем распределения
- 71. Кажущийся объем распределения
- 72. Клиренс характеризует скорость очищения организма от лекарственного вещества. Условно равен части объема распределения (Vd), которая очищается
- 73. Равновесная стационарная концентрация (Css) Для достижения оптимального терапевтического эффекта ЛВ необходимо постоянно поддерживать его терапевтическую концентрацию
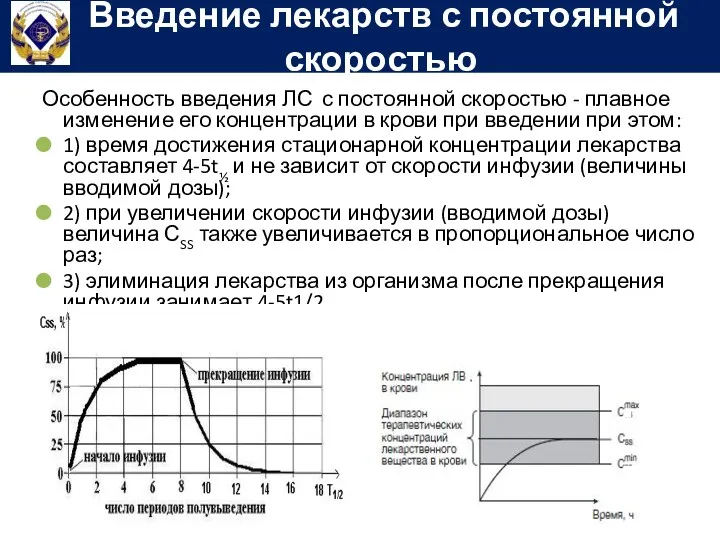
- 74. Особенность введения ЛС с постоянной скоростью - плавное изменение его концентрации в крови при введении при
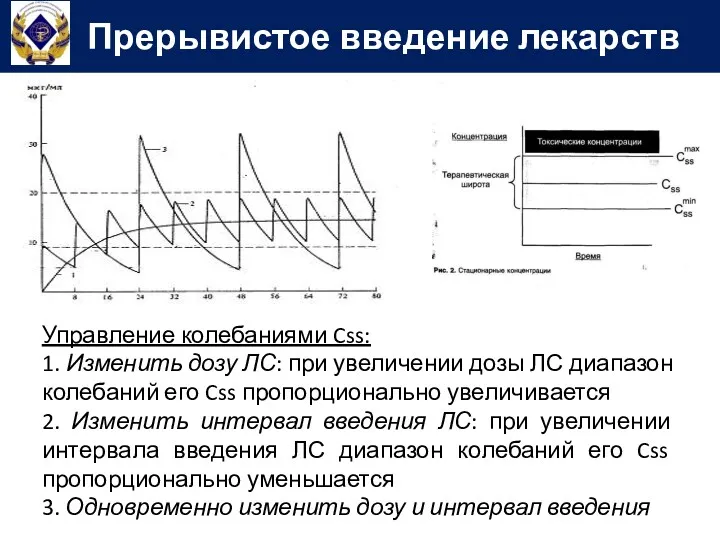
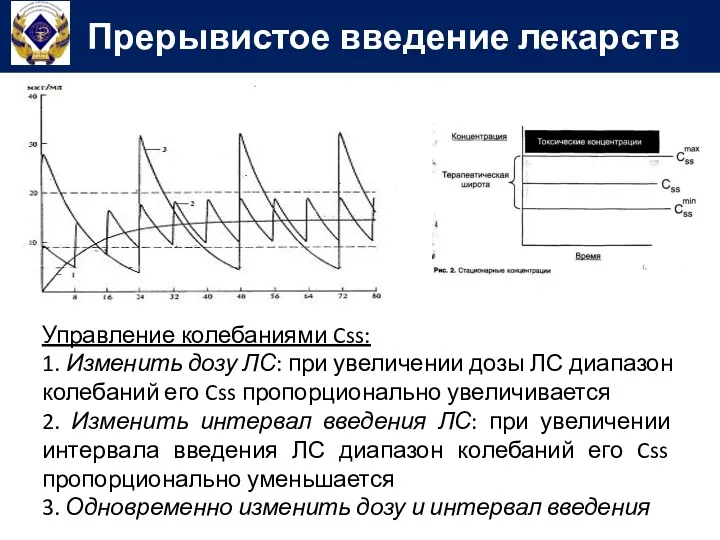
- 75. Управление колебаниями Css: 1. Изменить дозу ЛС: при увеличении дозы ЛС диапазон колебаний его Css пропорционально
- 76. Управление колебаниями Css: 1. Изменить дозу ЛС: при увеличении дозы ЛС диапазон колебаний его Css пропорционально
- 77. Вводная (загрузочная) доза – доза, вводимая за один прием и заполняющая весь объем распределения в действующей
- 78. доза ЛС, вводимая систематически, которая заполняет объем клиренса, т.е. тот фрагмент объема распределения (Vd), который очищается
- 79. У взрослого человека средней массы скорость метаболизма этанола составляет 10 г/час 45 мл виски содержит 14
- 80. Биоэквивалентность Согласно ФЗ от 22.12.2014 No 429-ФЗ (ред. от 13.07.2015) «О внесении изменений в ФЗ «Об
- 81. Воспроизведенный лекарственный препарат – это лекарственный препарат, который имеет такой же качественный и количественный состав действующих
- 82. Актуальность По данным статистики доля дженериков в РФ составляет 77% и лишь 23% приходятся на оригинальные
- 83. Фармацевтическая Фармакокинетическая (биоэквивалентность) Терапевтическая Виды эквивалентности
- 84. Лекарственные препараты считаются фармацевтическими эквивалентами, если они не отличаются по составу активных ингредиентов, имеют одинаковые лекарственную
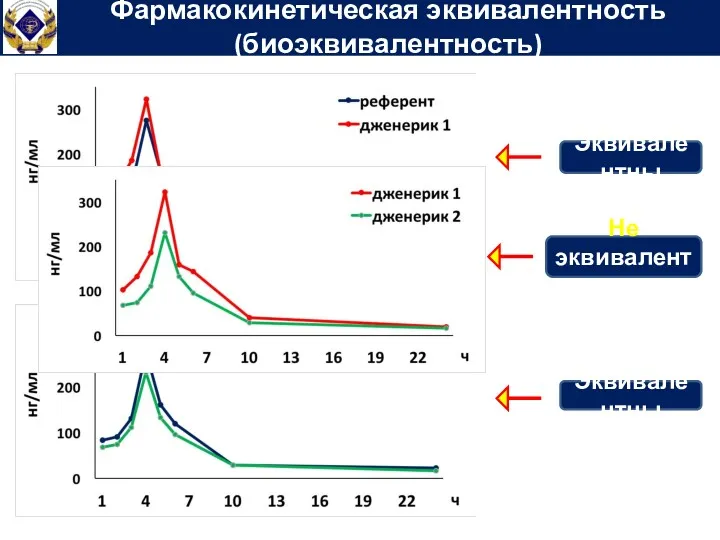
- 85. Фармакокинетическая эквивалентность (биоэквивалентность) клиническое исследование, заключающееся в сравнении скорости и степени всасывания дженерика и референтного препарата
- 86. Фармакокинетическая эквивалентность (биоэквивалентность) Эквивалентны Эквивалентны Не эквивалентны
- 87. Дженерики могут и не быть биоэквивалентны между собой
- 88. Недостатки исследований по биоэквивалентности Исследование биоэквивалентности выполняется на здоровых добровольцах, а не на пациентах. Фармакокинетика больных
- 89. Терапевтическая эквивалентность клинические исследования, проведение которого осуществляется для выявления одинаковых свойств лекарственных препаратов, показателей безопасности и
- 90. Orange book A Drug products that FDA considers to be therapeutically equivalent to other pharmaceutically equivalent
- 92. Скачать презентацию























































 Острая и хроническая почечная недостаточность
Острая и хроническая почечная недостаточность Бронхиальная астма у взрослых
Бронхиальная астма у взрослых Группа антибиотиков макролиды
Группа антибиотиков макролиды Нестабильная стенокардия
Нестабильная стенокардия Сосудистая деменция
Сосудистая деменция Стрептококковые пиодермиты
Стрептококковые пиодермиты Созылмалы аурулары бар науқастардың тістерін жұлу ерекшеліктері
Созылмалы аурулары бар науқастардың тістерін жұлу ерекшеліктері Кан кету
Кан кету Материалы для пломбирования корневых каналов
Материалы для пломбирования корневых каналов Особенности течения заболеваний у беременных. Тактика ВОП
Особенности течения заболеваний у беременных. Тактика ВОП Phylogenetic disorders of respiratory system
Phylogenetic disorders of respiratory system Лечебная физкультура как метод комплексной профилактики и лечения детей с ЗЧА
Лечебная физкультура как метод комплексной профилактики и лечения детей с ЗЧА Biochimie du foie et du sang
Biochimie du foie et du sang Мүгедектік
Мүгедектік Chronic pancreatitis and pancreonecro sis
Chronic pancreatitis and pancreonecro sis Первая помощь при ранениях
Первая помощь при ранениях Анализ применения кардиологических маркеров в диагностике сердечно-сосудистых заболеваний
Анализ применения кардиологических маркеров в диагностике сердечно-сосудистых заболеваний Қант диабеті
Қант диабеті Микробиология сибирской язвы и иерсиниозов
Микробиология сибирской язвы и иерсиниозов Хирургические заболевания желчевыводящих путей. Холецистит
Хирургические заболевания желчевыводящих путей. Холецистит Перелом костей средней зоны лица по Ле Фор III
Перелом костей средней зоны лица по Ле Фор III hypothyroidism & Diffuse toxic goiter (Graves' disease, Basedow disease)
hypothyroidism & Diffuse toxic goiter (Graves' disease, Basedow disease) Болезни органов дыхания пневмомикозы
Болезни органов дыхания пневмомикозы Ревматоидный артрит
Ревматоидный артрит Всероссийский конкурс: Лучший специалист со средним медицинским и фармацевтическим образованием. Паллиативная медицинская помощь
Всероссийский конкурс: Лучший специалист со средним медицинским и фармацевтическим образованием. Паллиативная медицинская помощь Рецепт: структура, правила выписывания и отпуска лекарственных средств
Рецепт: структура, правила выписывания и отпуска лекарственных средств Клинические случаи в практике врача стоматолога
Клинические случаи в практике врача стоматолога Cent ans de phagothérapie: de la découverte de Félix D’Hérelle à nos jours
Cent ans de phagothérapie: de la découverte de Félix D’Hérelle à nos jours