Коллоидные растворы. Устойчивость коллоидных систем. Коагуляция. Лиофильные системы. (Часть 3) презентация
Содержание
- 2. Различают кинетическую и агрегативную устойчивость коллоидных растворов. Устойчивость коллоидных растворов
- 3. Под кинетической устойчивостью понимают способность дисперсной фазы находится во взвешенном состоянии. Устойчивость коллоидных систем
- 4. Устойчивость коллоидных систем Коллоидные системы кинетически устойчивы. Для них характерно состояние седиментационного равновесия.
- 5. Агрегативная устойчивость – это способность системы сохранять определенную степень дисперсности, не объединяясь в более крупные агрегаты.
- 6. Устойчивость коллоидных систем К факторам агрегативной устойчивости относят: Наличие электрического заряда на частицах дисперсной фазы -
- 7. Устойчивость коллоидных систем 2) Наличие сольватной (гидратной) оболочки на коллоидных частицах. При этом упругие силы сольватных
- 8. Устойчивость коллоидных систем 3)Адсорбционно-структурирующие свойства коллоидных систем. На хорошо развитой поверхности частиц дисперсной фазы обычно легко
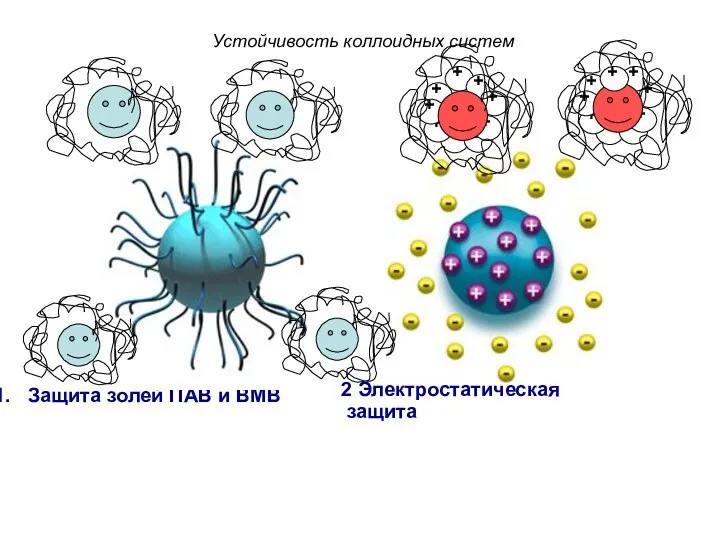
- 9. Устойчивость коллоидных систем Защита золей ПАВ и ВМВ 2 Электростатическая защита
- 10. Устойчивость коллоидных систем Способность ПАВ и ВМВ к образованию адсорбционно-сольватных слоев на поверхности коллоидных частиц называется
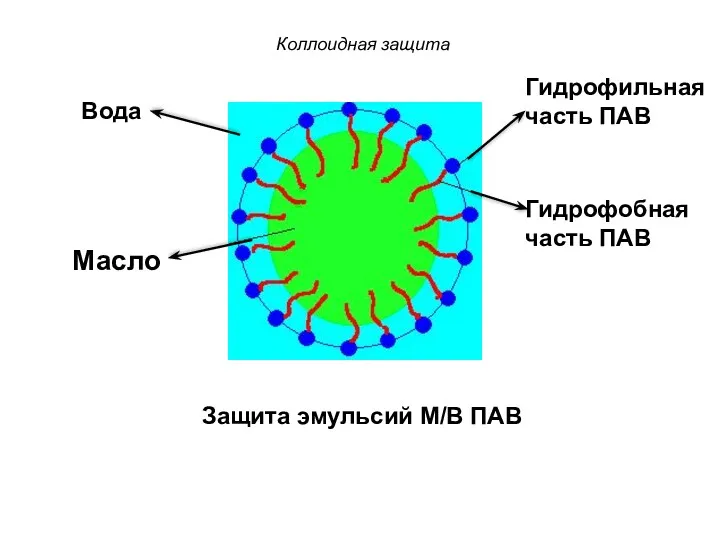
- 11. Коллоидная защита Защита эмульсий М/В ПАВ Масло Гидрофильная часть ПАВ Гидрофобная часть ПАВ Вода
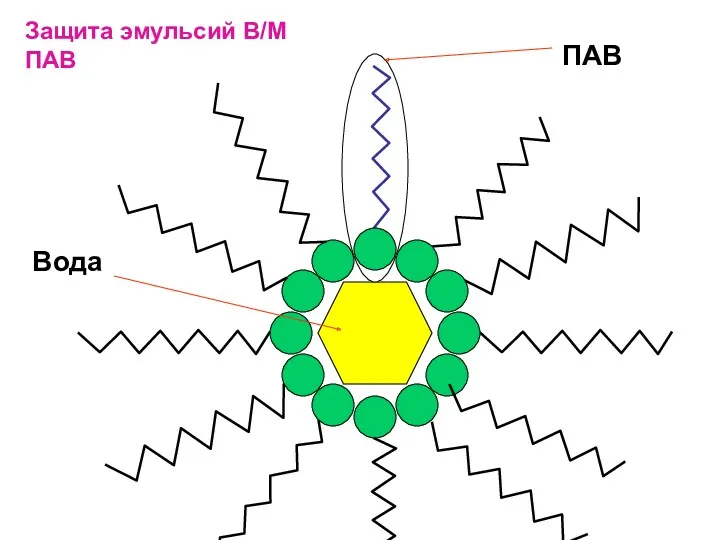
- 12. Защита эмульсий В/М ПАВ Вода ПАВ
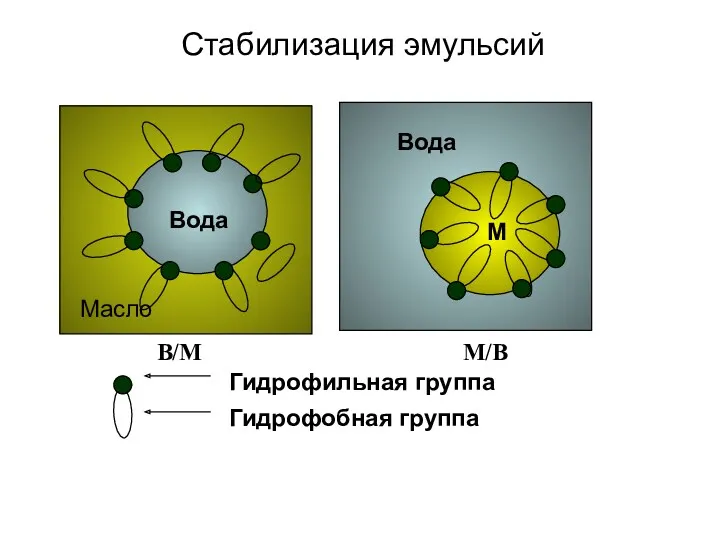
- 13. Стабилизация эмульсий Масло Вода М В/М М/В Гидрофильная группа Гидрофобная группа Вода
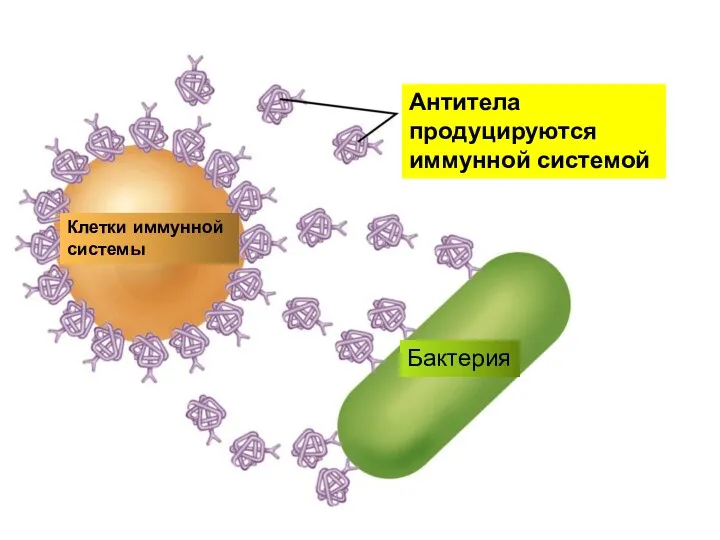
- 14. Коллоидная защита Большое значение коллоидная защита имеет для животных организмов. Белки, нуклеиновые кислоты, полисахариды и др.
- 15. Антитела продуцируются иммунной системой Клетки иммунной системы Бактерия
- 16. Коллоидная защита При патологии и старении организма защитные свойства белков и других соединений снижаются. Следствием этого
- 17. Коллоидная защита Желчные камни
- 18. Коллоидная защита Явление коллоидной защиты используют в фармации при изготовлении лекарственных препаратов, например золей серебра и
- 19. Коллоидная защита Препараты колларгола и протаргола представляют собой концентрированные золи металлического серебра, защищенные от коагуляции добавкой
- 20. Коагуляция Снижение устойчивости коллоидных систем приводит к их коагуляции (от лат. coagulum – сгусток) – укрупнению
- 21. Коагуляция Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к
- 22. Коагуляция Различают две стадии коагуляции. Первая стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но
- 23. Коагуляция Коагуляция происходит под влиянием различных факторов: температуры, встряхивании, перемешивании, облучении, добавлении электролитов.
- 24. Коагуляция Правила электролитной коагуляции: 1. Коагулирующим действием обладает ион электролита, имеющий заряд, противоположный заряду гранулы. Какой
- 25. Устойчивость коллоидных систем 2. Чем выше степень окисления иона, тем выше его коагулирующая способность (правило Шульце-Гарди):
- 26. Коагуляция Какой ион (хлорид-ион, сульфат- ион, фосфат-ион) оказывает большее коагулирующее действие на мицеллу иодида серебра в
- 27. Устойчивость коллоидных систем 3. При одинаковой степени окисления ионов коагулирующая способность возрастает с уменьшением степени гидратированности
- 28. Коагуляция Какой ион (хлорид-, бромид-, иодид-, роданид-ион) оказывает большее коагулирующее действие на мицеллу иодида серебра в
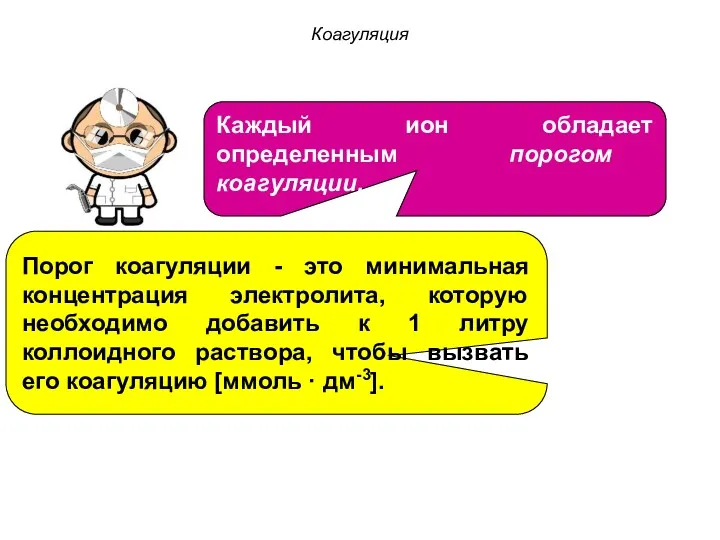
- 29. Коагуляция Каждый ион обладает определенным порогом коагуляции. Порог коагуляции - это минимальная концентрация электролита, которую необходимо
- 30. Коагуляция Расчет порога коагуляции проводят по формуле: где V0 - объем золя, V1 -минимальный объем раствора
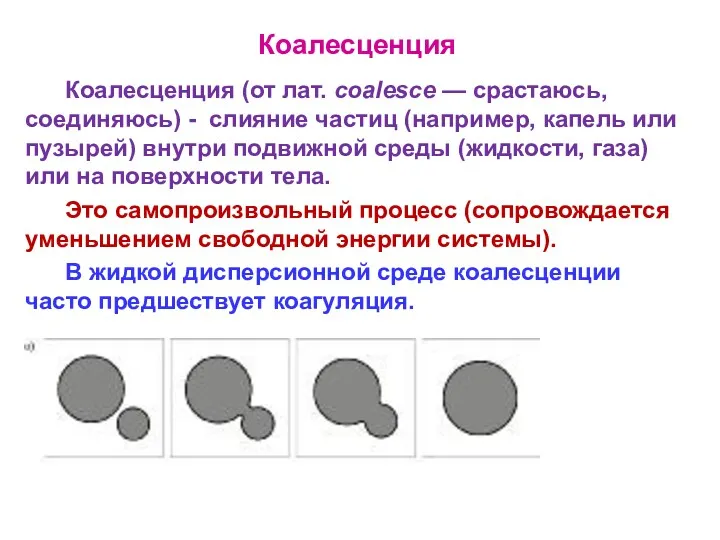
- 31. Коалесценция Коалесценция (от лат. coalesce — срастаюсь, соединяюсь) - слияние частиц (например, капель или пузырей) внутри
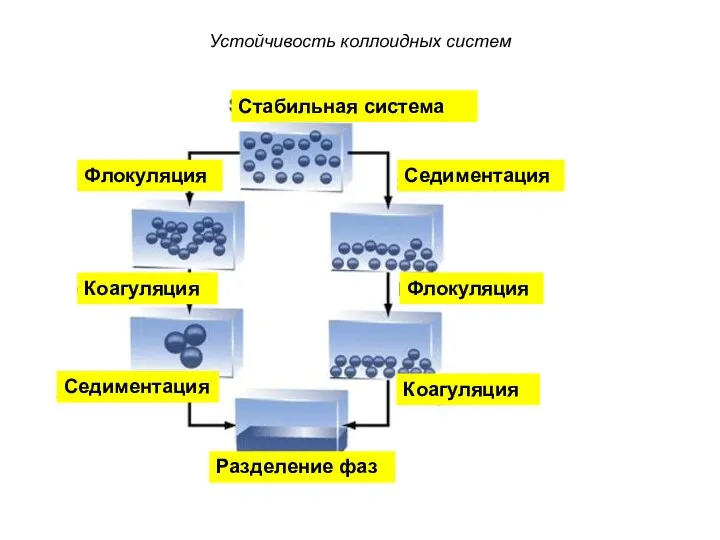
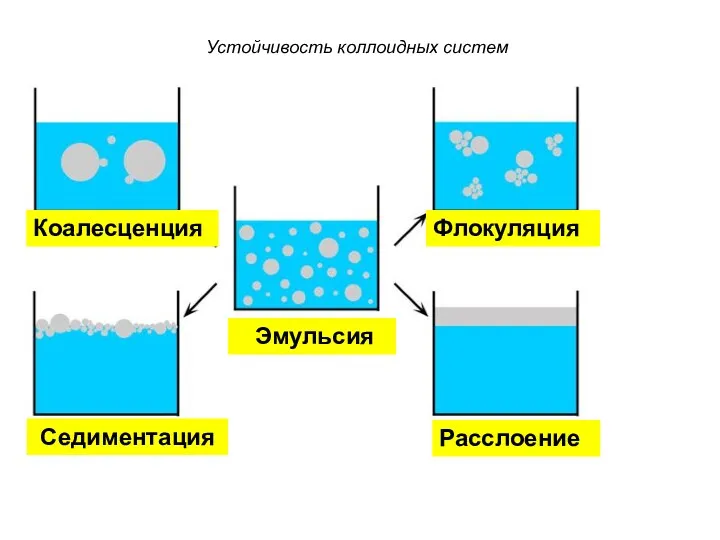
- 32. Устойчивость коллоидных систем Стабильная система Седиментация Седиментация Флокуляция Коагуляция Разделение фаз Флокуляция Коагуляция
- 33. Устойчивость коллоидных систем Расслоение Флокуляция Коалесценция Эмульсия Седиментация
- 34. Молекулярные коллоиды (обратимые и лиофильные) Их образуют природные и синтетические ВМВ. Очень разбавленные растворы гомогенны (истинные
- 35. Молекулярные коллоиды При достижении критической концентрации мицеллообразования (С ккм белка = 10-10 моль/л) в зависимости от
- 36. Молекулярные коллоиды Другой особенностью растворов молекулярных коллоидов является обратимость, то есть способность мицелл самопроизвольно переходить в
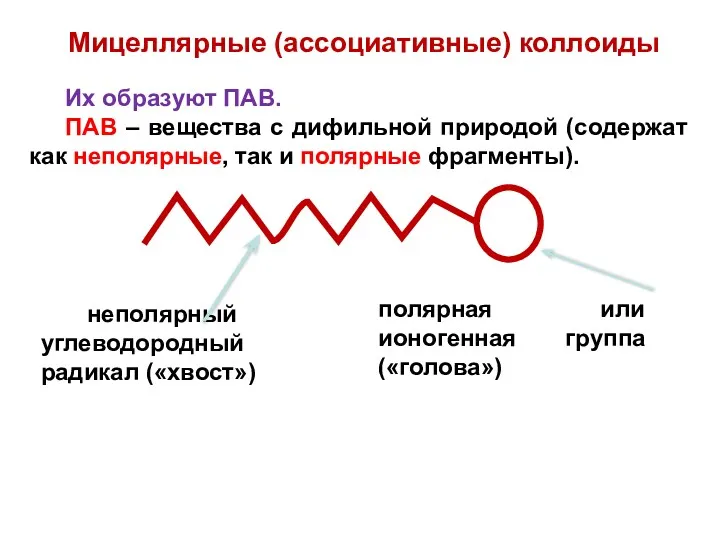
- 37. Мицеллярные (ассоциативные) коллоиды Их образуют ПАВ. ПАВ – вещества с дифильной природой (содержат как неполярные, так
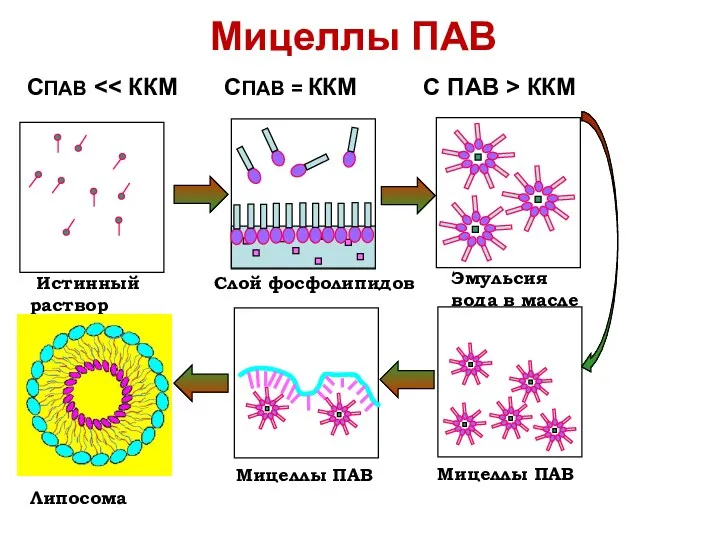
- 38. Мицеллы ПАВ При небольшой концентрации ПАВ образуют истинные молекулярные растворы. С увеличением концентрации отдельные молекулы начинают
- 39. Мицеллярные коллоиды Мицеллы ПАВ образуются самопроизвольно при достижении критической концентрации мицеллообразования (ККМ). Величина ККМ зависит от
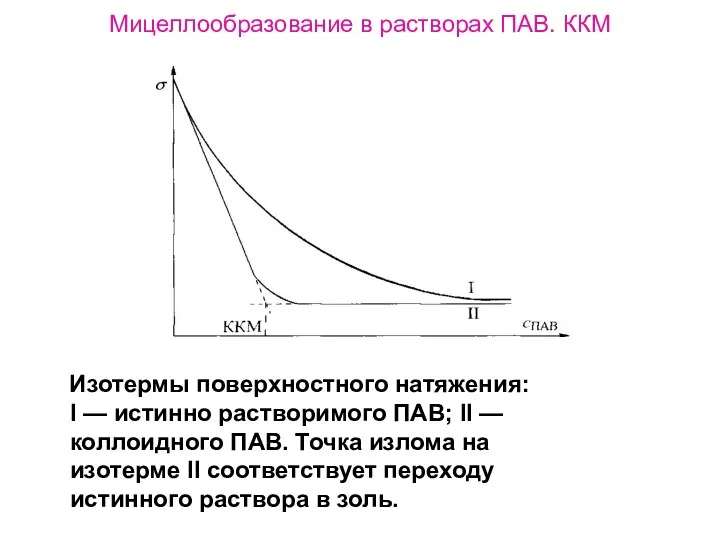
- 40. Мицеллообразование в растворах ПАВ. ККМ Изотермы поверхностного натяжения: I — истинно растворимого ПАВ; II — коллоидного
- 41. Мицеллы ПАВ Истинный раствор СПАВ ˂˂ ККМ СПАВ = ККМ С ПАВ ˃ ККМ
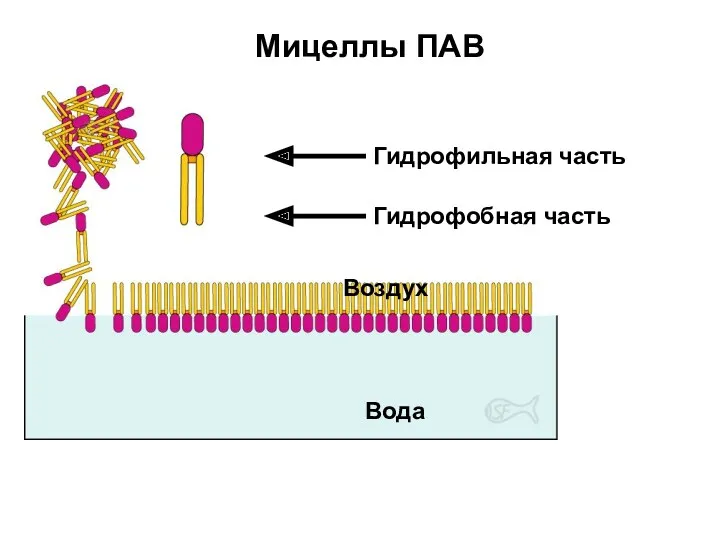
- 42. Мицеллы ПАВ Воздух Вода
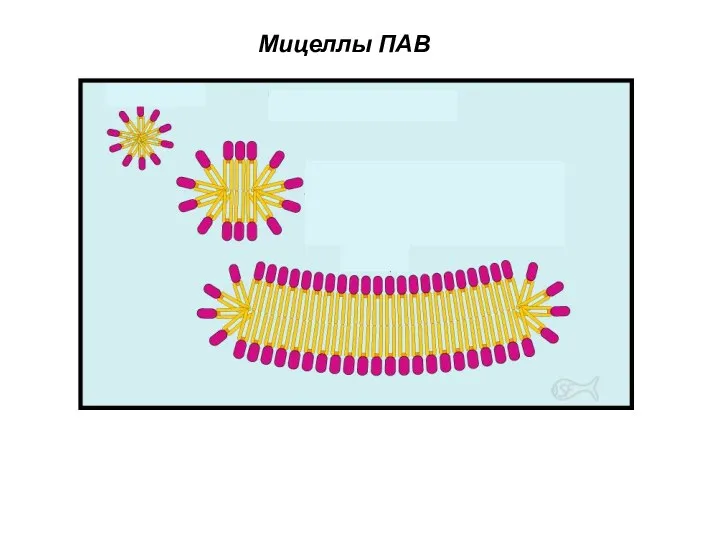
- 43. Мицеллы ПАВ
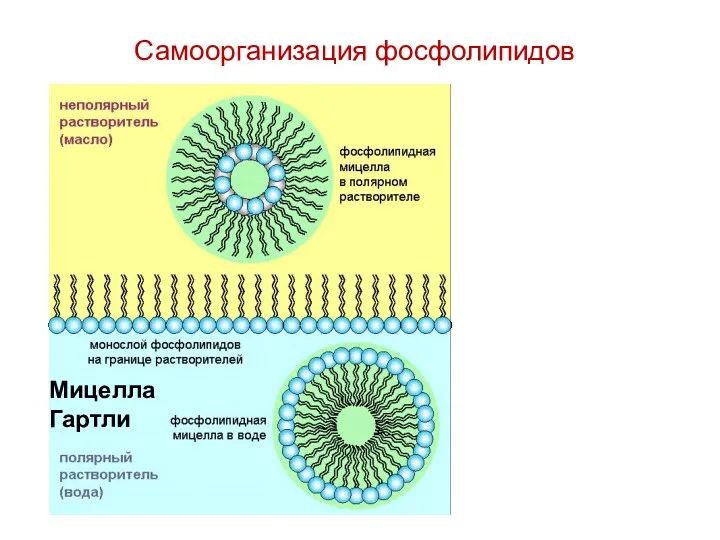
- 44. Самоорганизация фосфолипидов Мицелла Гартли
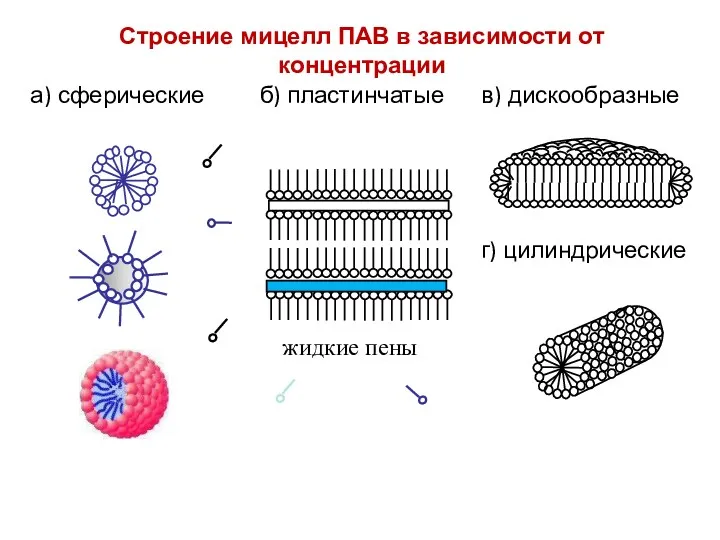
- 45. Строение мицелл ПАВ в зависимости от концентрации а) сферические б) пластинчатые в) дискообразные г) цилиндрические жидкие
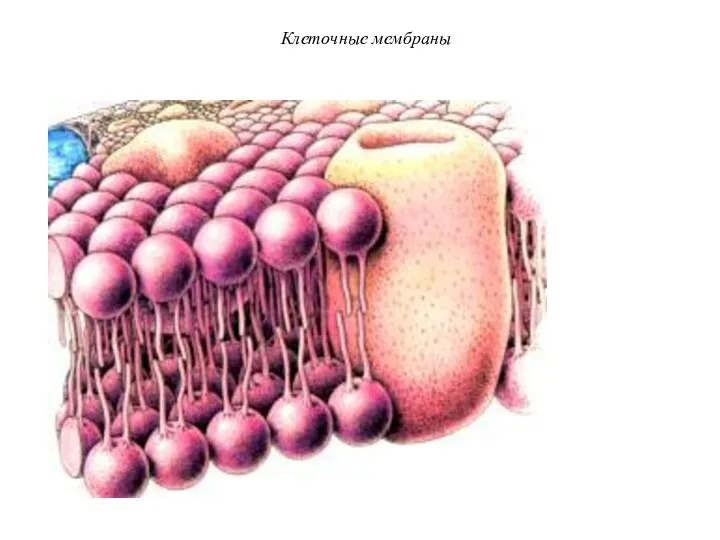
- 46. Клеточные мембраны
- 47. Мицеллообразование в растворах ПАВ. ККМ Значение ККМ зависит от различных факторов: природы коллоидного ПАВ: установлено, что
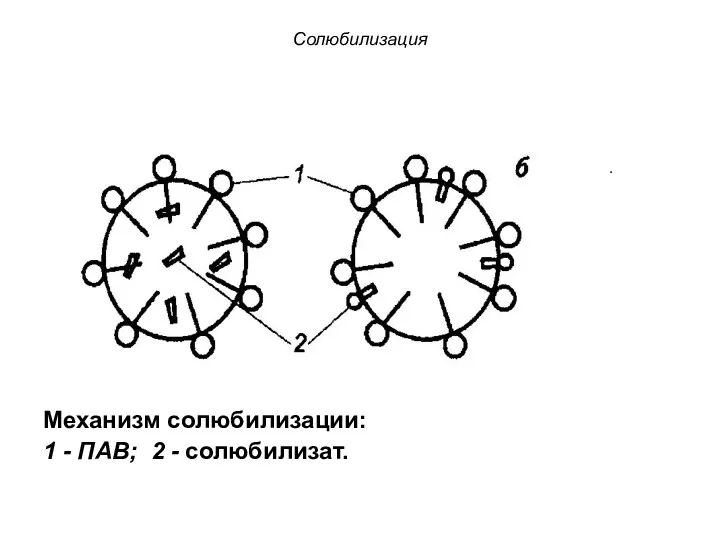
- 48. Солюбилизация Солюбилизацией (или коллоидным растворением) называется явление проникновения молекул низкомолекулярных веществ в мицеллы ПАВ. Вещество, растворяющееся
- 49. Солюбилизация Способ включения молекул солюбилизата в мицеллы зависит от их природы. Неполярные углеводороды, внедряясь в мицеллы,
- 50. Солюбилизация Механизм солюбилизации: 1 - ПАВ; 2 - солюбилизат.
- 51. Солюбилизация Процесс солюбилизации является самопроизвольным и обратимым. Солюбилизация приводит к набуханию мицелл и, соответственно, к увеличению
- 52. Солюбилизация Количественной характеристикой солюбилизации является относительная солюбилизация – отношение числа моль солюбилизированного вещества к числу моль
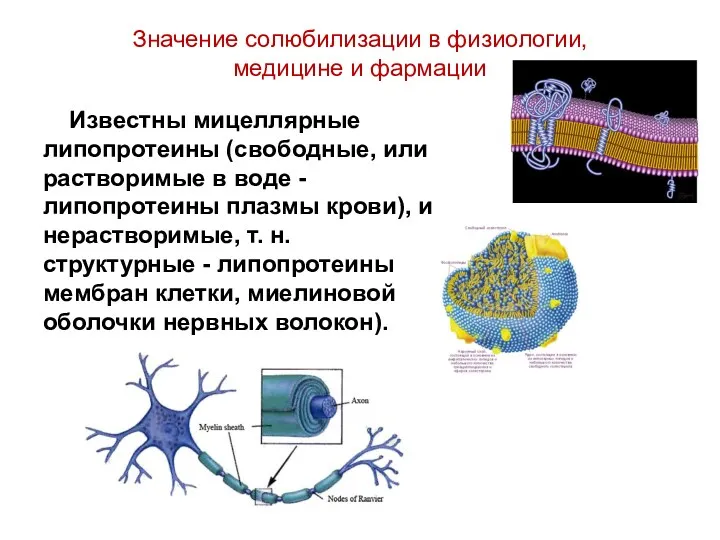
- 53. Значение солюбилизации в физиологии, медицине и фармации Известны мицеллярные липопротеины (свободные, или растворимые в воде -
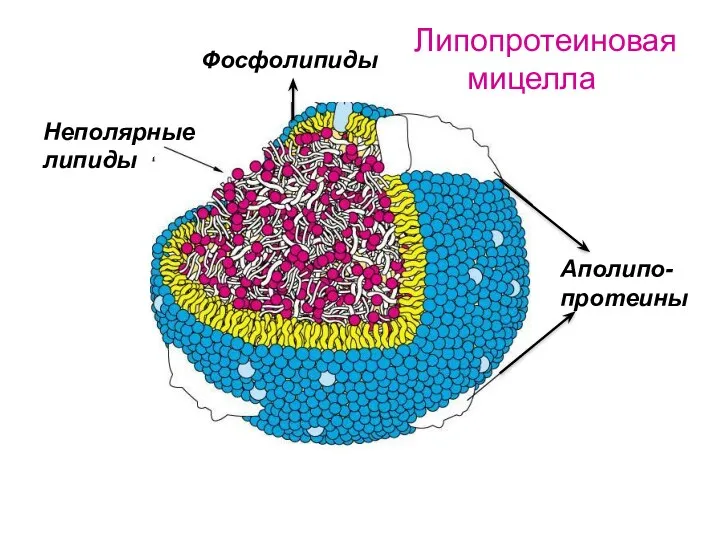
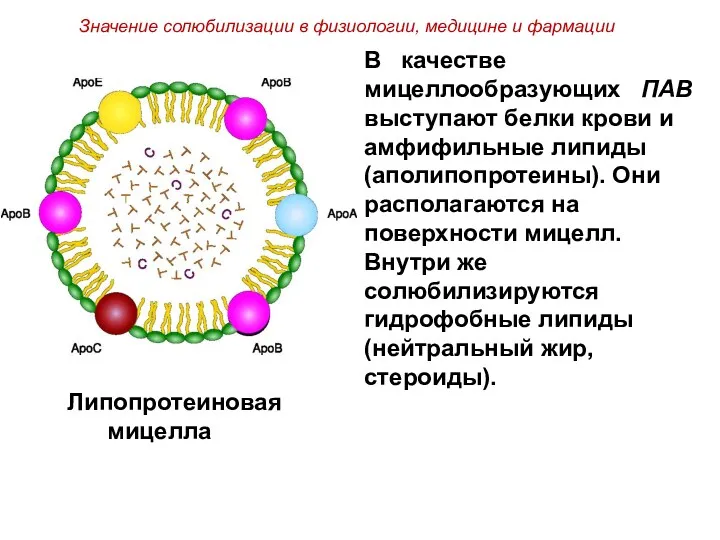
- 54. Аполипо- протеины Фосфолипиды Неполярные липиды Липопротеиновая мицелла
- 55. Липопротеиновая мицелла В качестве мицеллообразующих ПАВ выступают белки крови и амфифильные липиды (аполипопротеины). Они располагаются на
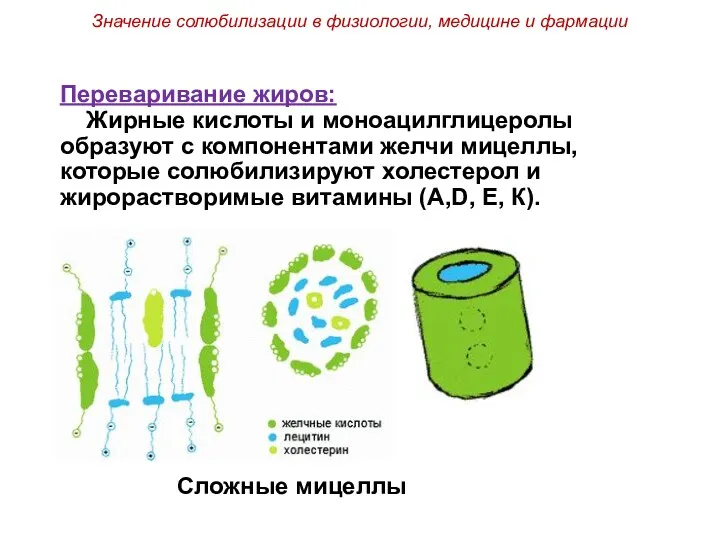
- 56. Значение солюбилизации в физиологии, медицине и фармации Переваривание жиров: Жирные кислоты и моноацилглицеролы образуют с компонентами
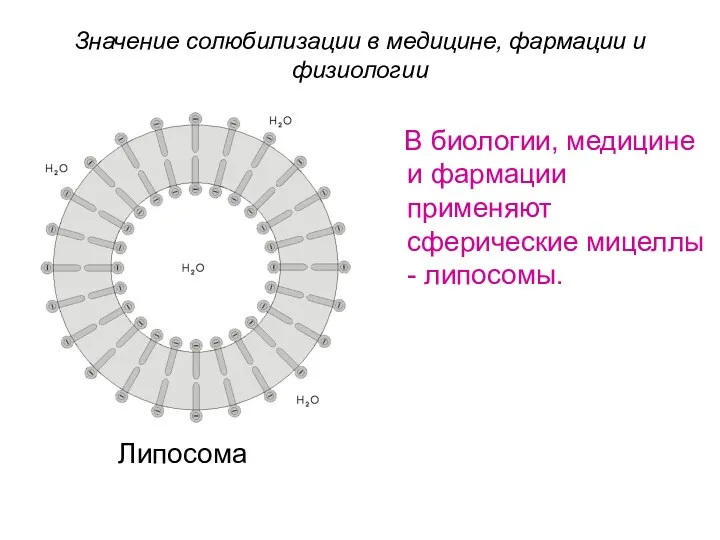
- 57. Значение солюбилизации в медицине, фармации и физиологии Липосома В биологии, медицине и фармации применяют сферические мицеллы
- 58. Значение солюбилизации в медицине, фармации и физиологии Липосомы рассматривают как модель биологических мембран. С их помощью
- 59. Известны препараты иода, распределенного в ПАВ (иодофоры). Введение ПАВ позволяет получать препараты стероидов для парентерального и
- 60. Вопросы для самоконтроля Сформулируйте правила коагуляции золей электролитами. Какие процессы происходят в растворах коллоидных ПАВ по
- 62. Скачать презентацию




































 Патология сердечно-сосудистой системы
Патология сердечно-сосудистой системы Методы обследования больных с заболеваниями органов дыхания: расспрос, осмотр, пальпация, перкуссия
Методы обследования больных с заболеваниями органов дыхания: расспрос, осмотр, пальпация, перкуссия Филярииодозы. Клинические симптомы
Филярииодозы. Клинические симптомы Теории медицины и здравоохранения
Теории медицины и здравоохранения Методы определения доброкачественности лекарственного растительного сырья
Методы определения доброкачественности лекарственного растительного сырья Гипотиреоз. Определение, эпидемиология, этиология, классификация
Гипотиреоз. Определение, эпидемиология, этиология, классификация Трансмиссивті инфекциялар
Трансмиссивті инфекциялар Lung cancer epidemiology, aetiology, clinical presentation, diagnosis and treatment
Lung cancer epidemiology, aetiology, clinical presentation, diagnosis and treatment Жизненная сила морской соли
Жизненная сила морской соли Chemistry, food & health
Chemistry, food & health Переломы костей конечностей
Переломы костей конечностей Никотиновая зависимость и как от нее избавится
Никотиновая зависимость и как от нее избавится Шок. Определение шока
Шок. Определение шока Реабилитационные мероприятия при лечении перенесенного ишемического инсульта
Реабилитационные мероприятия при лечении перенесенного ишемического инсульта Создание новой модели медицинской организации, оказывающей первичную медико-санитарную помощь
Создание новой модели медицинской организации, оказывающей первичную медико-санитарную помощь Імунна система. Органи імунної системи
Імунна система. Органи імунної системи Организация работы органов, осуществляющих медицинскую помощь гражданам. Тема 8
Организация работы органов, осуществляющих медицинскую помощь гражданам. Тема 8 Композиционные пломбировочные материалы при лечении кариеса и некариозных поражений твердых тканей зубов
Композиционные пломбировочные материалы при лечении кариеса и некариозных поражений твердых тканей зубов Наркология. Психоактивные вещества
Наркология. Психоактивные вещества Стоматологическое просвещение населения
Стоматологическое просвещение населения Снотворные препараты
Снотворные препараты Туберкулез животных
Туберкулез животных Средства, действующие на периферическую нервную систему
Средства, действующие на периферическую нервную систему Рак лёгкого
Рак лёгкого Туннельные невропатии нижних конечностей
Туннельные невропатии нижних конечностей Ребенок с низкой массой тела. Уход направленный на развитие
Ребенок с низкой массой тела. Уход направленный на развитие Реактивные состояния, психические расстройства в экстремальных ситуациях. Принципы терапии и профилактики психогений
Реактивные состояния, психические расстройства в экстремальных ситуациях. Принципы терапии и профилактики психогений Нейропатии рук (локтевой, лучевой, срединый.)
Нейропатии рук (локтевой, лучевой, срединый.)