Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания о координационной теории строения, классификации, номенклатуре, изомерии и устойчивости комплексных соединений.
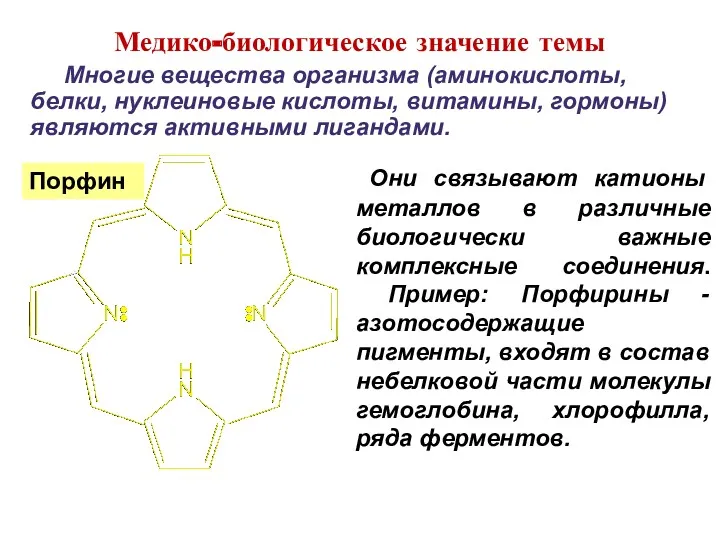
- 3. [Fe(C5H5)2] [Ni(CO)4] Медико-биологическое значение темы
- 4. Они связывают катионы металлов в различные биологически важные комплексные соединения. Пример: Порфирины - азотосодержащие пигменты, входят
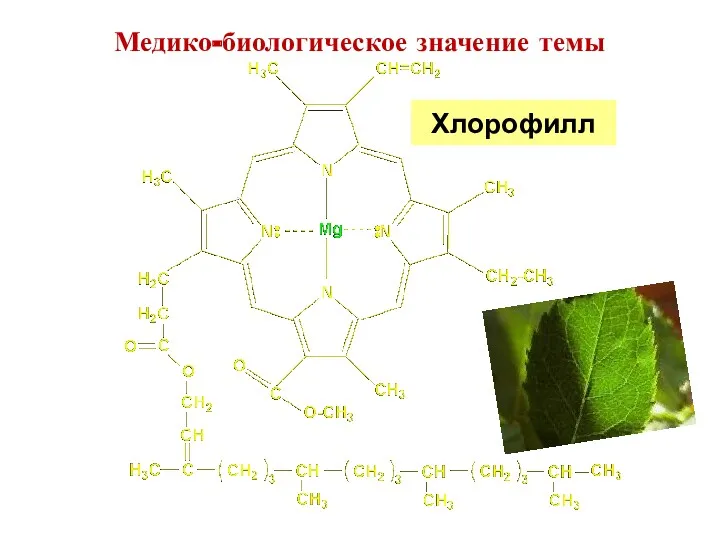
- 5. Хлорофилл Медико-биологическое значение темы
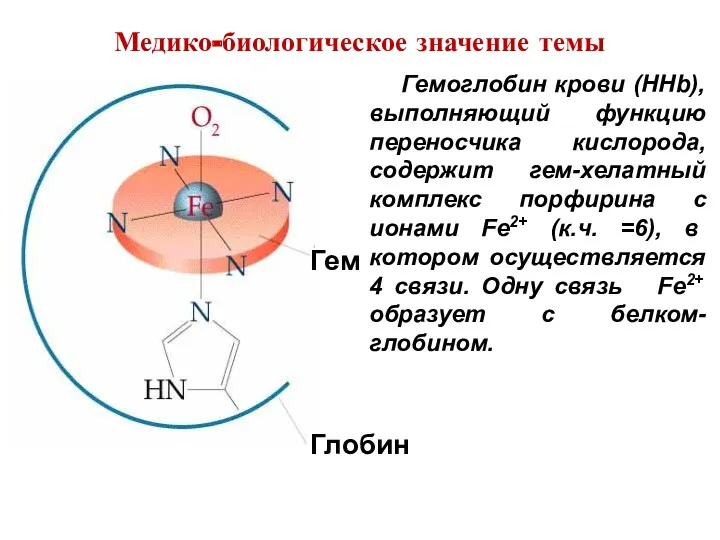
- 6. Гемоглобин крови (HHb), выполняющий функцию переносчика кислорода, содержит гем-хелатный комплекс порфирина с ионами Fe2+ (к.ч. =6),
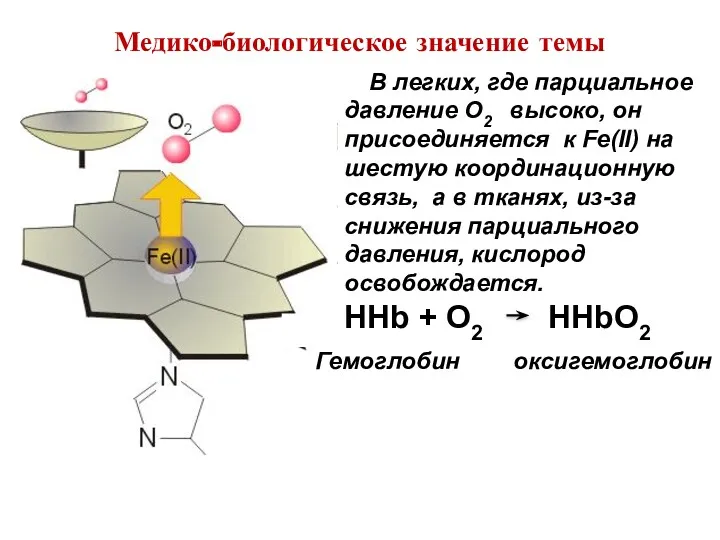
- 7. В легких, где парциальное давление O2 высоко, он присоединяется к Fe(II) на шестую координационную связь, а
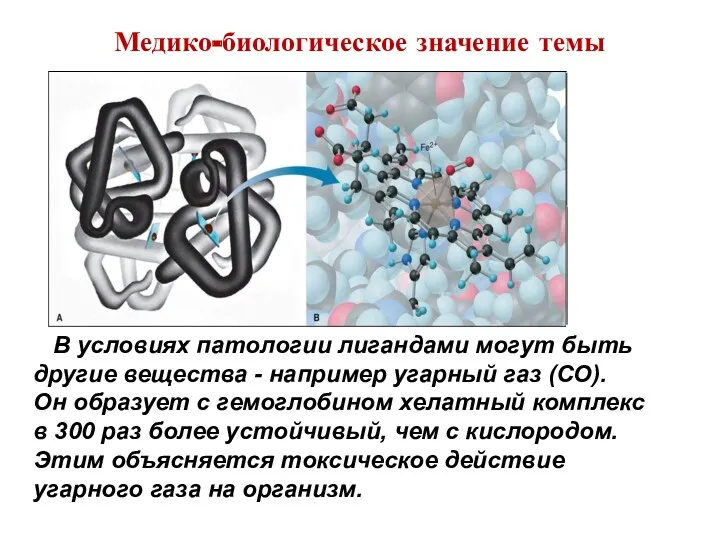
- 8. Медико-биологическое значение темы В условиях патологии лигандами могут быть другие вещества - например угарный газ (CO).
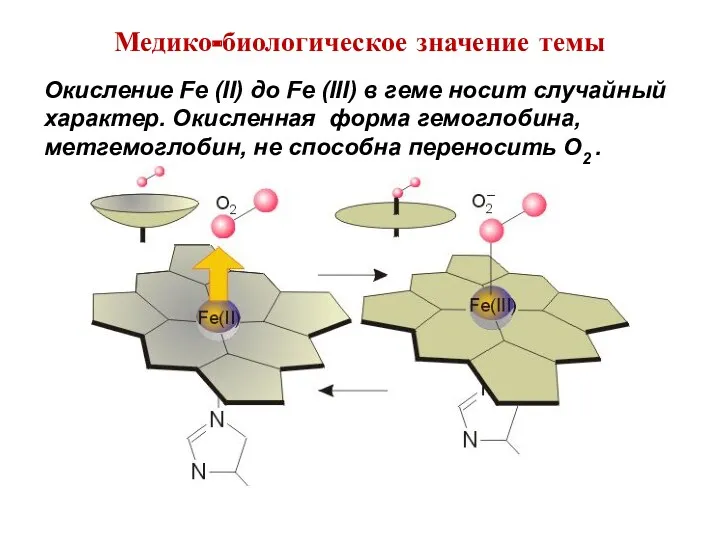
- 9. Медико-биологическое значение темы Окисление Fe (II) до Fe (III) в геме носит случайный характер. Окисленная форма
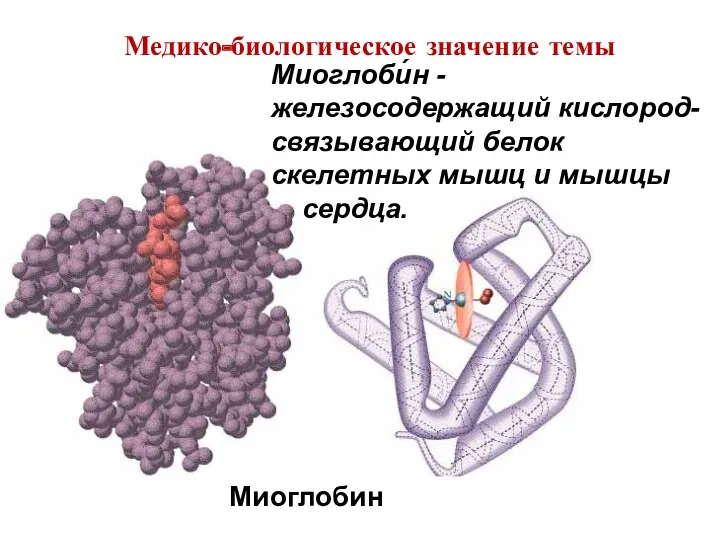
- 10. Миоглобин Миоглоби́н - железосодержащий кислород-связывающий белок скелетных мышц и мышцы сердца. Медико-биологическое значение темы
- 11. B12 (Co[C62H88N13O14P])CN B12 - это хелат Co3+ c порфирином Медико-биологическое значение темы
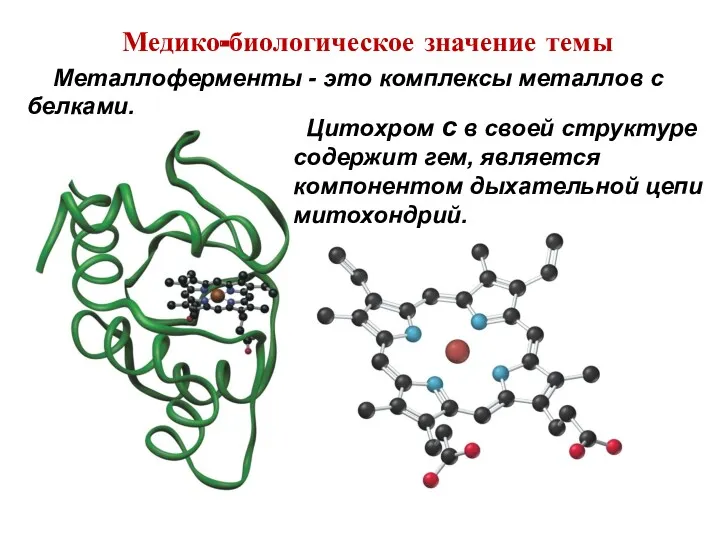
- 12. Медико-биологическое значение темы Цитохром с в своей структуре содержит гем, является компонентом дыхательной цепи митохондрий. Металлоферменты
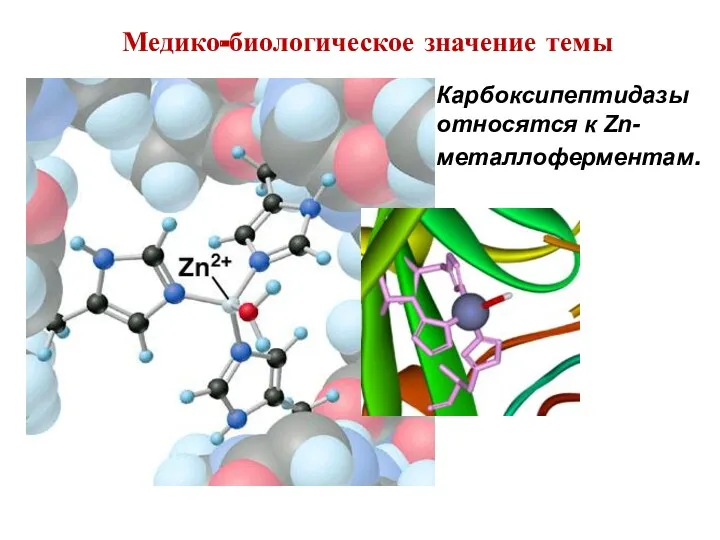
- 13. Медико-биологическое значение темы Карбоксипептидазы относятся к Zn-металлоферментам.
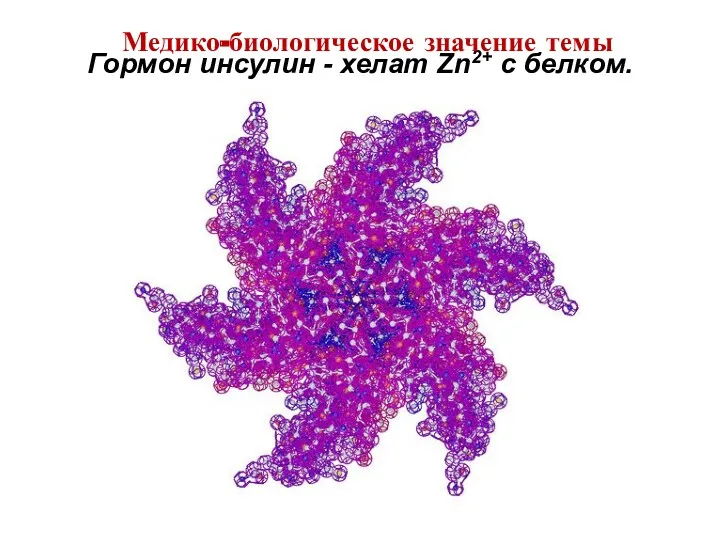
- 14. Гормон инсулин - хелат Zn2+ c белком. Медико-биологическое значение темы
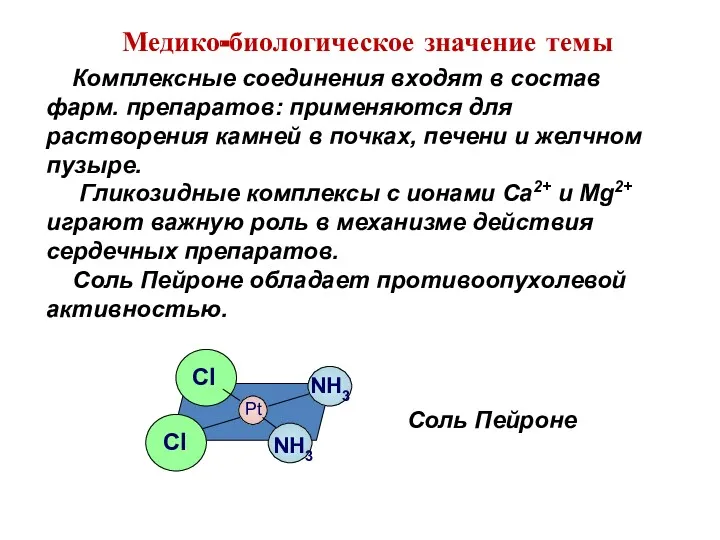
- 15. Комплексные соединения входят в состав фарм. препаратов: применяются для растворения камней в почках, печени и желчном
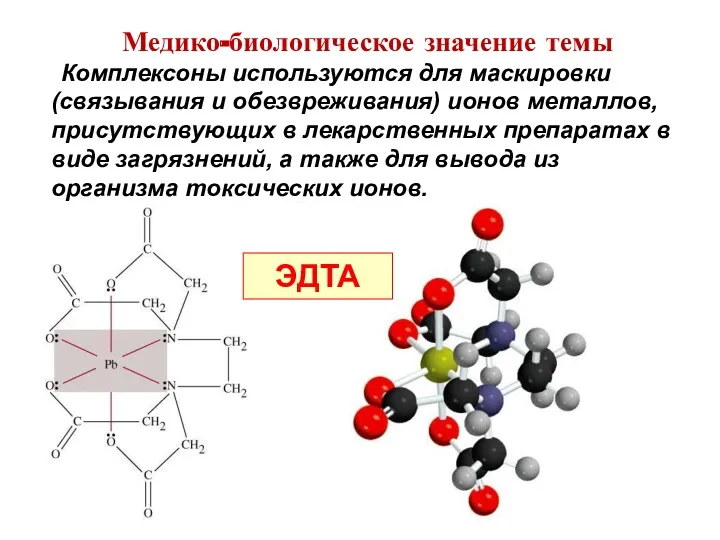
- 16. Комплексоны используются для маскировки (связывания и обезвреживания) ионов металлов, присутствующих в лекарственных препаратах в виде загрязнений,
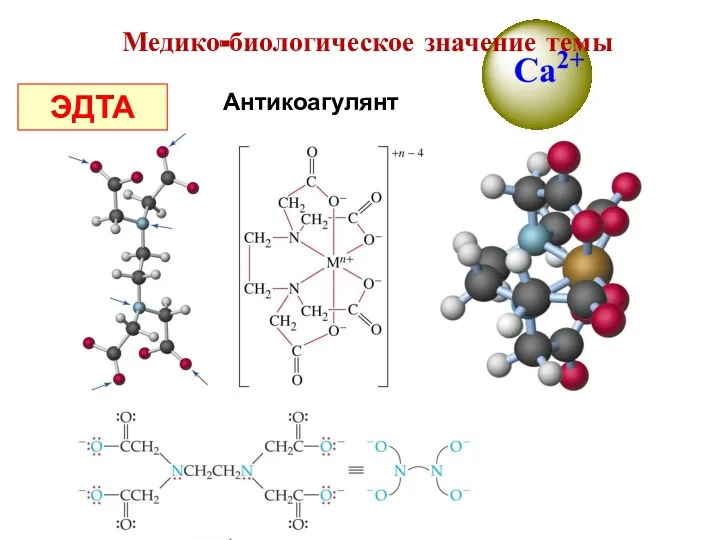
- 17. Антикоагулянт ЭДТА Медико-биологическое значение темы
- 18. Комплексные соединения часто имеют яркую окраску, поэтому их используют для проведения качественных реакций CuSO4 · 5
- 19. Комплексные соединения Комплексными называются соединения, в узлах кристаллической решетки которых находятся комплексные ионы, способные к самостоятельному
- 20. Координационная теория А. Вернера (1893 г. ) "Меня часто охватывает экстаз пред красотой моей науки. Чем
- 21. Строение комплексных соединений. Классификация. Номенклатура K3[Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число Внутренняя сфера Внешняя сфера
- 22. [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение. Комплекс - центральный атом или ион (чаще всего металла),
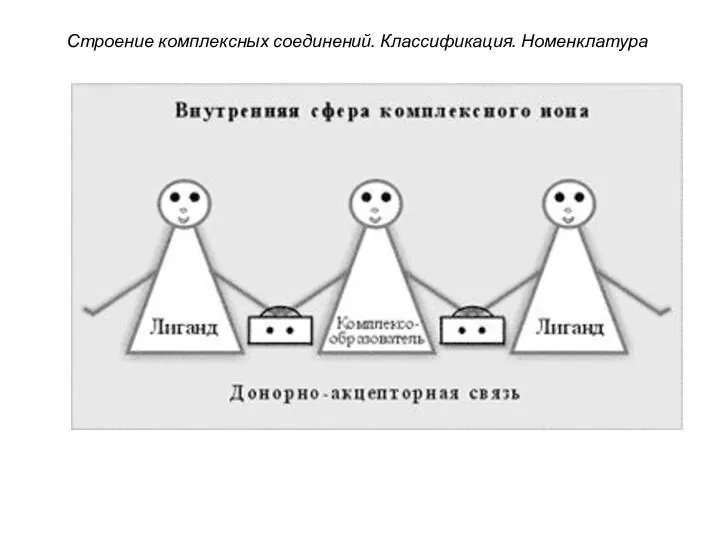
- 23. Строение комплексных соединений. Классификация. Номенклатура 1. Внутренняя сфера комплекса включает центральный атом или ион-комплексообразователя, вокруг которого
- 24. Строение комплексных соединений. Классификация. Номенклатура 2. Внешняя сфера - это совокупность ионов, непосредственно не связанных с
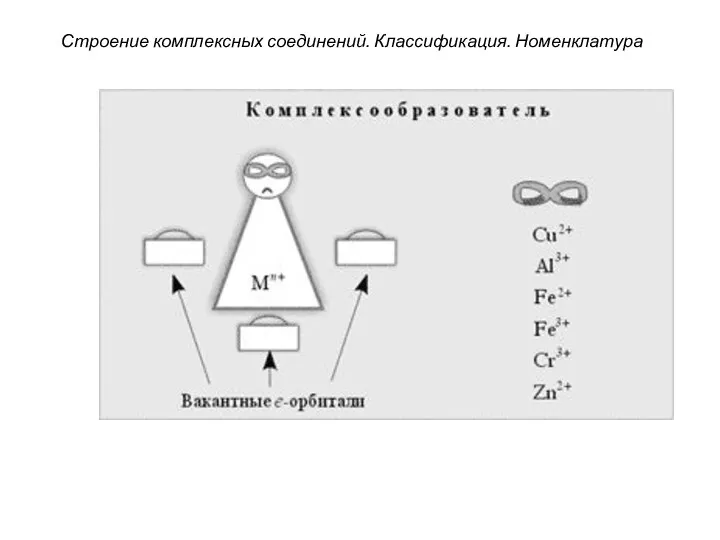
- 25. Строение комплексных соединений. Классификация. Номенклатура 3. Комплексообразователями являются атомы или ионы металлов, имеющие свободные орбитали (чаще
- 26. Периодическая таблица f-блок переходные элементы d-блок переходные элементы Строение комплексных соединений. Классификация. Номенклатура
- 27. d-Блок переходные элементы
- 28. Электронные конфигурации Sc [Ar]3d14s2 Ti [Ar]3d24s2 V [Ar]3d34s2 Cr [Ar]3d54s1 Mn [Ar]3d54s2 Элемент Конфигурация [Ar] =
- 29. Электронные конфигурации Fe [Ar] 3d64s2 Co [Ar] 3d74s2 Ni [Ar] 3d84s2 Cu [Ar]3d104s1 Zn [Ar]3d104s2 Элемент
- 30. Строение комплексных соединений. Классификация. Номенклатура
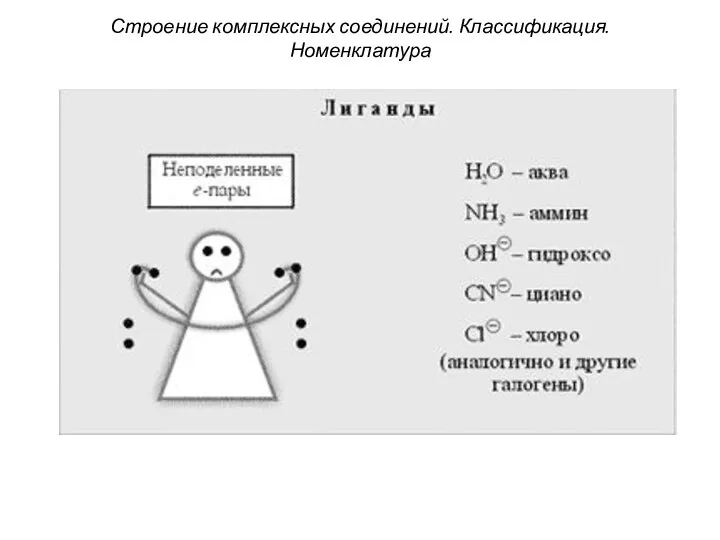
- 31. Строение комплексных соединений. Классификация. Номенклатура 4. Лиганды (от лат. ligo – привязываю) имеют неподеленные электронные пары,
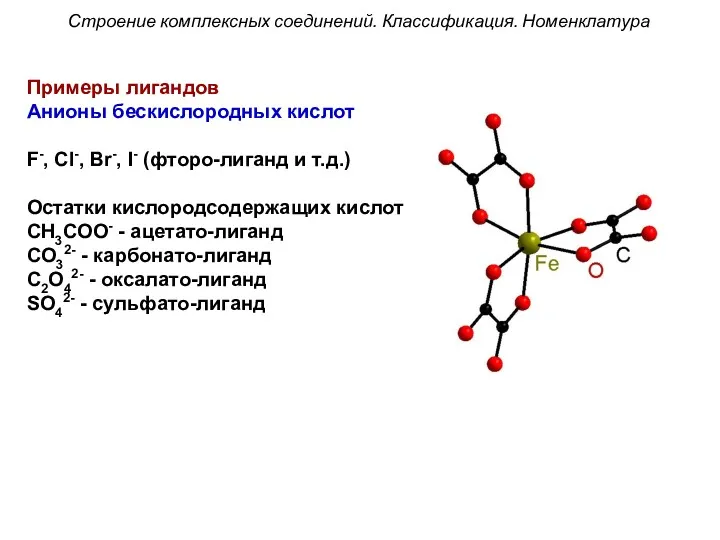
- 32. Строение комплексных соединений. Классификация. Номенклатура Примеры лигандов Анионы бескислородных кислот F-, Cl-, Br-, I- (фторо-лиганд и
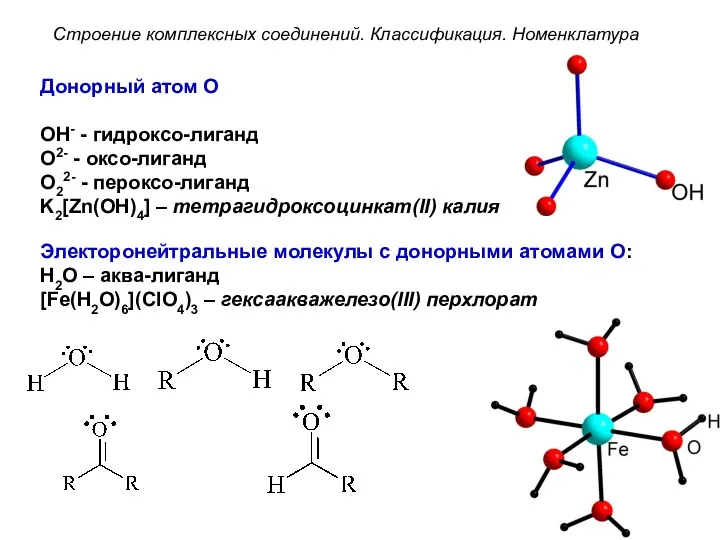
- 33. Донорный атом O OH- - гидроксо-лиганд O2- - оксо-лиганд O22- - пероксо-лиганд K2[Zn(OH)4] – тетрагидроксоцинкат(II) калия
- 34. Строение комплексных соединений. Классификация. Номенклатура
- 35. Строение комплексных соединений. Классификация. Номенклатура 5. Механизм комплексообразования связан с межионным, межмолекулярным взаимодействиями, но основной вклад
- 36. Механизм образования комплексного иона [Al(OH)4]-
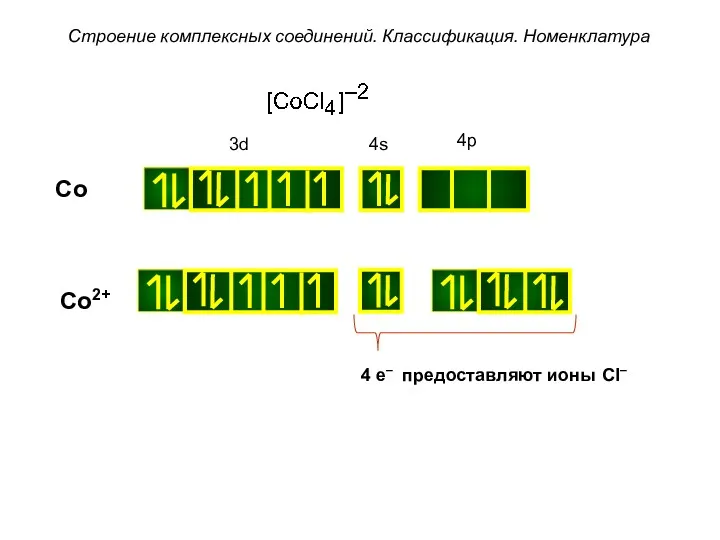
- 37. Строение комплексных соединений. Классификация. Номенклатура Co Co2+ 4 e– предоставляют ионы Cl–
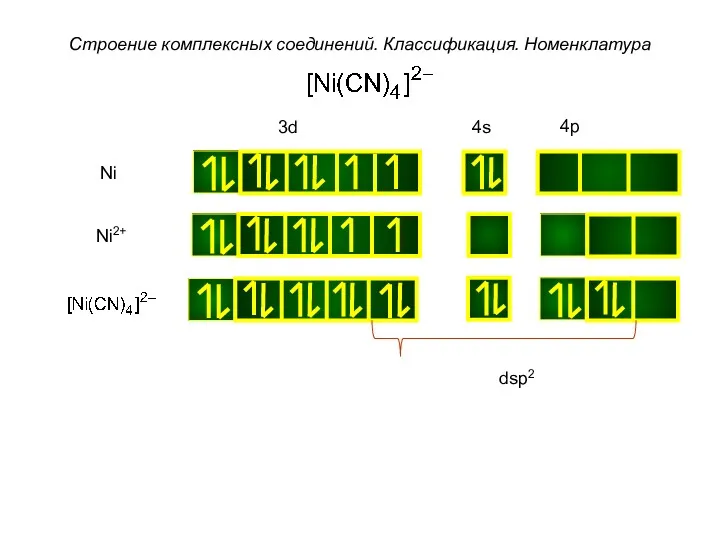
- 38. Строение комплексных соединений. Классификация. Номенклатура Ni Ni2+ dsp2
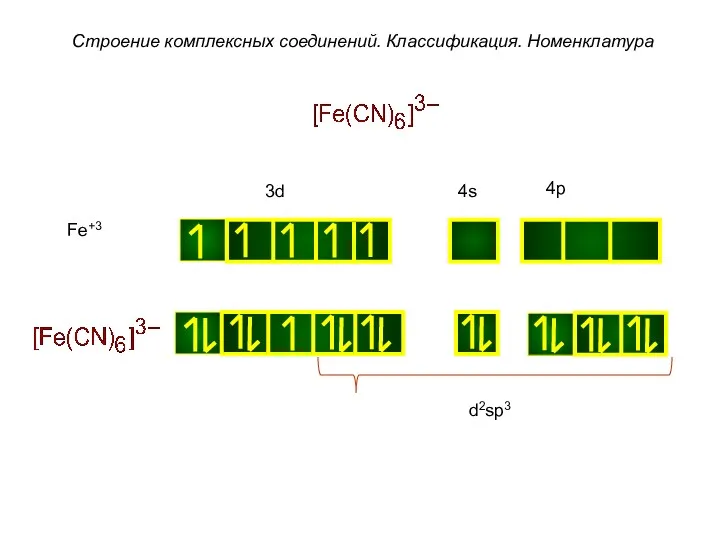
- 39. Строение комплексных соединений. Классификация. Номенклатура Fe+3 d2sp3
- 40. Строение комплексных соединений. Классификация. Номенклатура
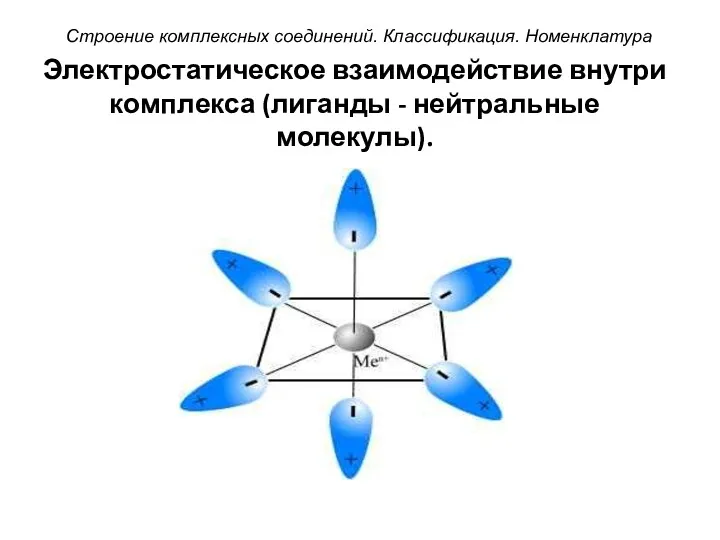
- 41. Электростатическое взаимодействие внутри комплекса (лиганды - нейтральные молекулы). Строение комплексных соединений. Классификация. Номенклатура
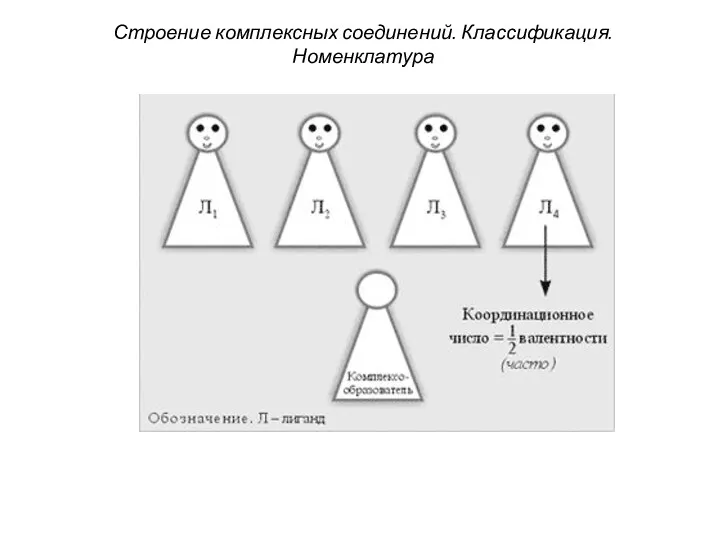
- 42. Строение комплексных соединений. Классификация. Номенклатура 6. Координационное число (к. ч.) комплексообразователя показывает, сколько связей образует комплексообразователь
- 43. Строение комплексных соединений. Классификация. Номенклатура
- 44. Строение комплексных соединений. Классификация. Номенклатура Координационные числа наиболее распространенных комплексообразователей:
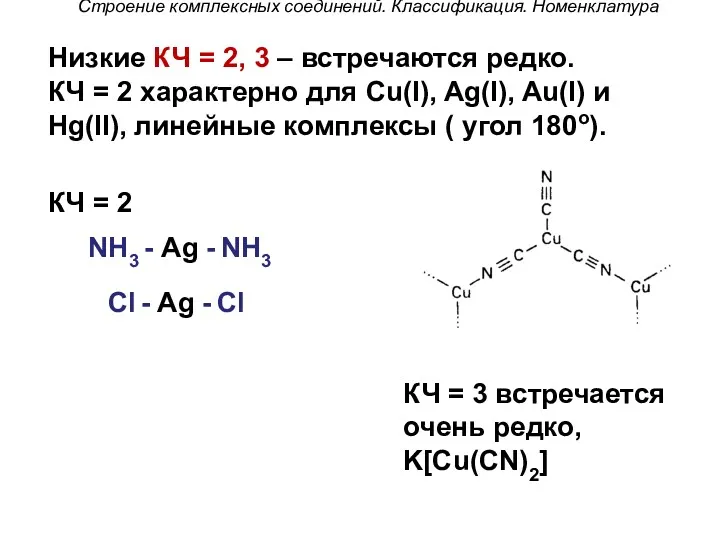
- 45. Строение комплексных соединений. Классификация. Номенклатура Низкие КЧ = 2, 3 – встречаются редко. КЧ = 2
- 46. Квадратный комплекс [Pt2+(NH3)2Cl2] КЧ = 4 (тетраэдр и плоский квадрат). Строение комплексных соединений. Классификация. Номенклатура [Ni(CO)4]
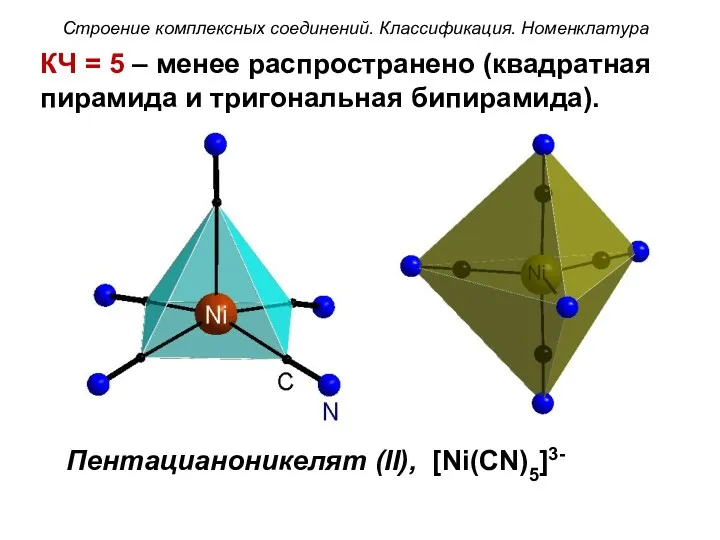
- 47. КЧ = 5 – менее распространено (квадратная пирамида и тригональная бипирамида). Пентацианоникелят (II), [Ni(CN)5]3- Строение комплексных
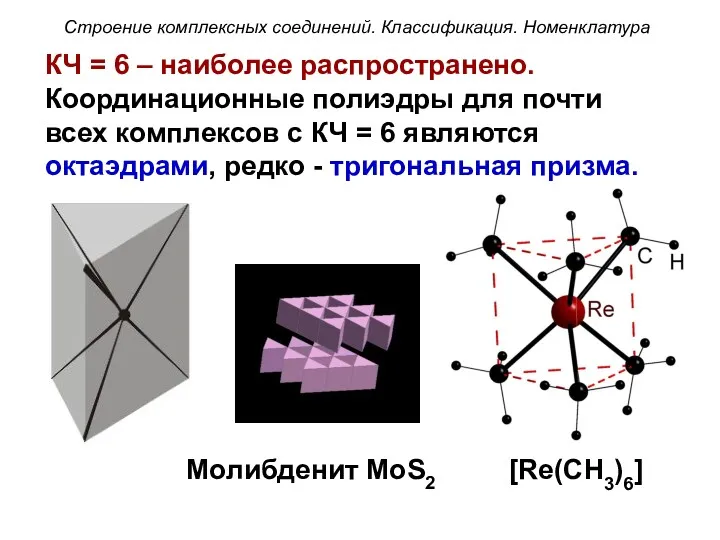
- 48. КЧ = 6 – наиболее распространено. Координационные полиэдры для почти всех комплексов с КЧ = 6
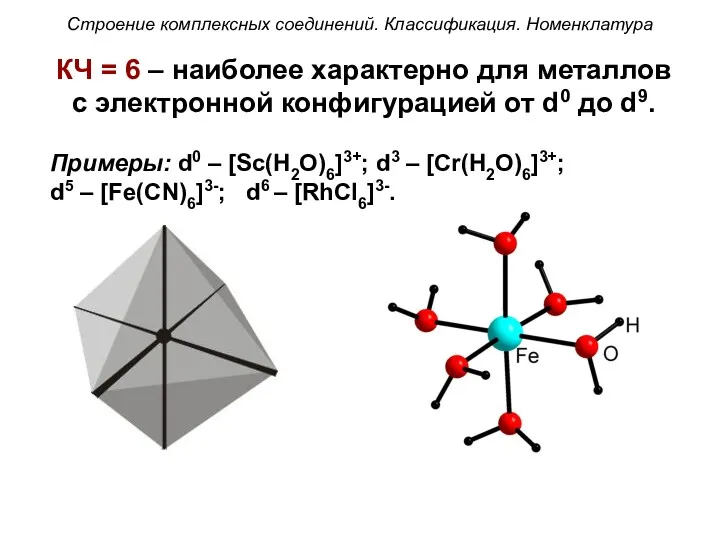
- 49. КЧ = 6 – наиболее характерно для металлов с электронной конфигурацией от d0 до d9. Примеры:
- 50. КЧ = 7 Пентагональная бипирамида [UO2(H2O)5]2+ Тригональная призма с одной шапкой [NbF7]2- Октаэдр с одной шапкой
- 51. КЧ = 8 додекаэдр [Hf(ox)4]4- квадратная антипризма [Mo(CN)8]3- Строение комплексных соединений. Классификация. Номенклатура
- 52. КЧ = 8, [СoF8]5- квадратная антипризма Строение комплексных соединений. Классификация. Номенклатура
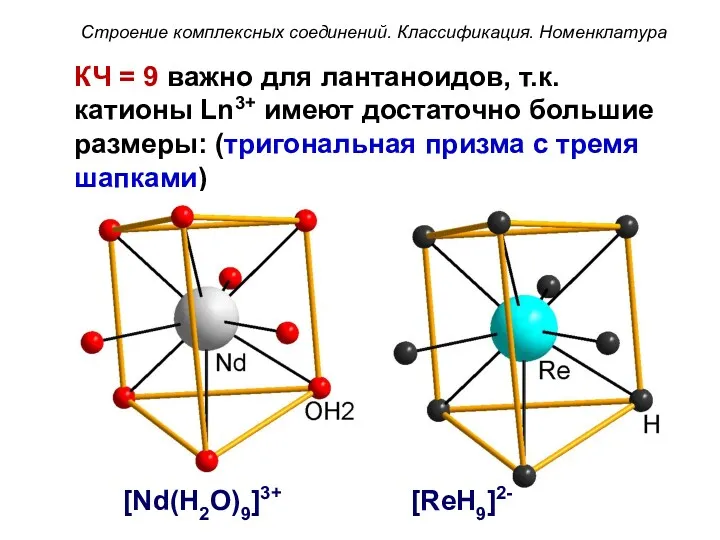
- 53. КЧ = 9 важно для лантаноидов, т.к. катионы Ln3+ имеют достаточно большие размеры: (тригональная призма с
- 54. КЧ = 10, 12 КЧ=12, [Ce(NO3)6]2- КЧ = 10, [Bi(NO3)5]2- Строение комплексных соединений. Классификация. Номенклатура
- 55. Строение комплексных соединений. Классификация. Номенклатура Пример: Заряд внутренней сферы комплексного соединения Z равен алгебраической сумме зарядов
- 56. Строение комплексных соединений. Классификация. Номенклатура Пример: Комплексообразователь – Со3+ Лиганды- Сl- , Н2О КЧ (Со3+) =
- 57. Классификация и номенклатура комплексных соединений По характеру заряда внутренней сферы различают катионные, анионные и нейтральные комплексы.
- 58. Строение комплексных соединений. Классификация. Номенклатура Число лигандов – греч. числит. 1 – (моно) 2 – ди
- 59. I. Номенклатура катионных комплексов Греческим числительным называют число лигандов: 1-моно, 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса Называют
- 60. Строение комплексных соединений. Классификация. Номенклатура Примеры: [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) I I H2O – аква NH3 –
- 61. Строение комплексных соединений. Классификация. Номенклатура Примеры: [AgI(NH3)2]OH – гидроксид диамминсеребра(I); [CoIII(NH3)6]Cl3 – хлорид гексаамминкобальта(III); [Cr2III(OH)(NH3)2]Cl4 –
- 62. II. Номенклатура анионных комплексов Греческим числительным называют число лигандов. Называют лиганды. Называют комплексообразователь латинским наименованием с
- 63. Строение комплексных соединений. Классификация. Номенклатура Примеры: K3[Fe(CN)6] Гексацианоферрат(III) калия III H2O – аква NH3 – аммин
- 64. Строение комплексных соединений. Классификация. Номенклатура Ag – аргент- Au – аур- Cu – купр- Fe –
- 65. III. Номенклатура нейтральных комплексов Греческим числительным называют число лигандов. Называют лиганды. Называют комплексообразователь русским наименованием. Валентность
- 66. Строение комплексных соединений. Классификация. Номенклатура Примеры: [Ni(CO)4] – тетракарбонилникель; [Co2(CO)8] – октакарбонилдикобальт; [Al2Cl6] – гексахлородиалюминий; [CoIIICl3(NH3)3]
- 67. Типы комплексных соединений 1. Аквакомплексы В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3 [K(H2O)6][Cr(H2O)6](SO4)2
- 68. Аквакомплексы Кристаллогидраты [Cu(H2O)4]SO4·H2O («медный купорос»)
- 69. Аквакомплексы [Fe(H2O)6]SO4·H2O («железный купорос»)
- 70. 2. Гидроксокомплексы [Zn(OH)4]2– : OH–
- 71. 3. Аммины (аммиакаты) [Ag(NH3)2]+ : NH3
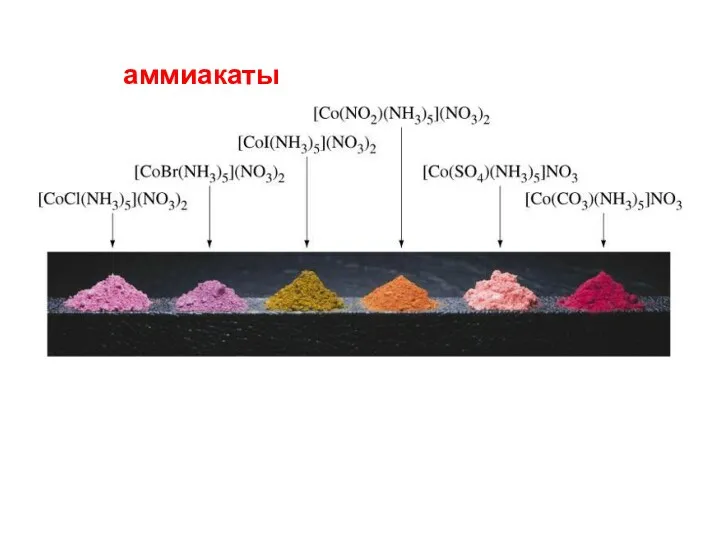
- 72. аммиакаты
- 73. [HgI4]2– [Fe(NCS)6]3− 4. Ацидокомплексы : Х–
- 74. Na[BH4] Al[BH4]3 5. Гидридокомплексы : H–
- 75. Устойчивость комплексных соединений Различают первичную и вторичную диссоциацию комплексных соединений. а) Первичная диссоциация – это диссоциация
- 76. [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3 [Ag(NH3)2]+ Ag+ + 2NH3 Она протекает незначительно. б)
- 77. Устойчивость комплексных соединений Устойчивость комплексных ионов характеризуется константой нестойкости (Кнест), которая определяется на основании закона действующих
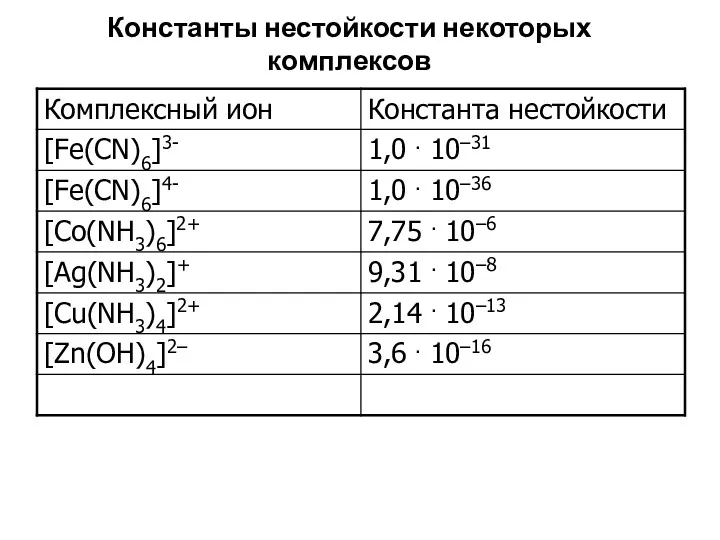
- 78. Константы нестойкости некоторых комплексов
- 79. Устойчивость комплексных соединений Константа нестойкости характеризует термодинамическую устойчивость комплекса, которая зависит от прочности связей между центральным
- 80. Устойчивость комплексных соединений Мерой прочности комплекса является энергия разрыва связей, величина которой характеризуется изменением энергии Гиббса
- 81. Изомерия комплексных соединений Для комплексных соединений характерны следующие виды изомерии: сольватная (в водных средах гидратная), ионизационная,
- 82. Геометрическая изомерия цис- (cis-) транс- (trans-) cis-[CoCl2(NH3)4]+ trans-[CoCl2(NH3)4]+
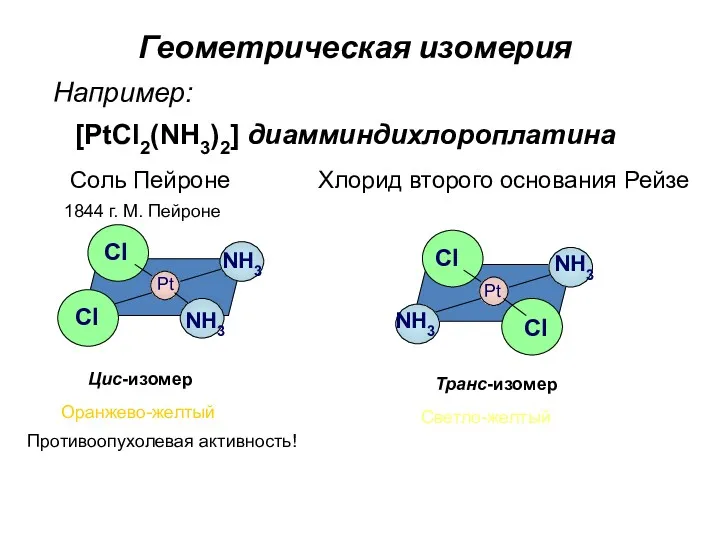
- 83. Геометрическая изомерия Например: Pt Pt Cl Cl Cl Cl NH3 NH3 NH3 NH3 Соль Пейроне Хлорид
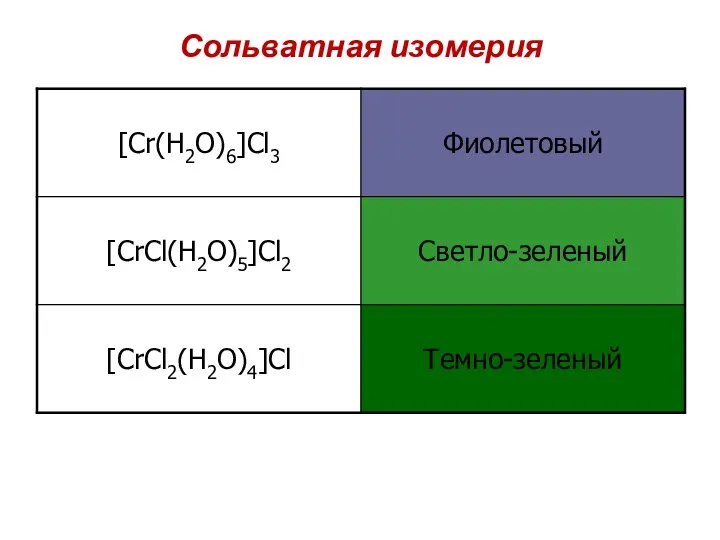
- 84. Сольватная изомерия
- 85. Оптическая изомерия Отражение Отражение [Co(En)2]3+
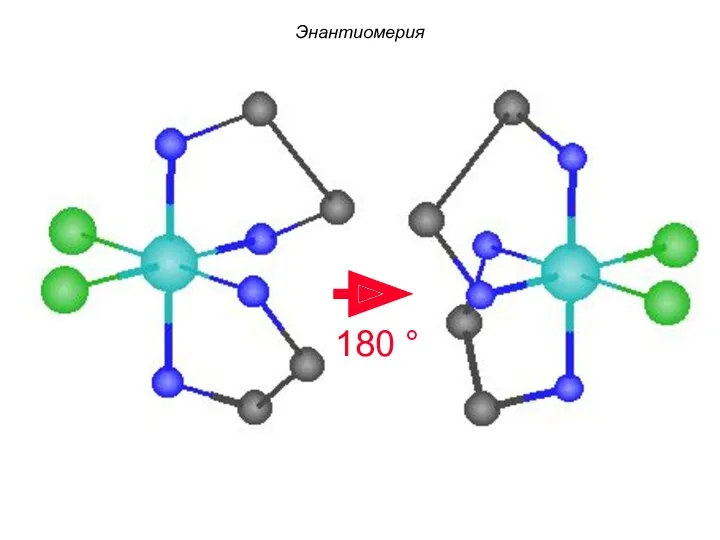
- 86. mirror plane cis-[Co(En)2Cl2]+ Пример: Энантиомерия
- 87. 180 ° Энантиомерия
- 88. enantiomers cis-[Co(En)2Cl2]+ Энантиомерия
- 89. Лиганды могут присоединяться к комплексообразователю посредством одного или нескольких атомов, т.е. лиганды обладают координационной емкостью -
- 90. Полидентатные лиганды присоединяются к комплексообразователю посредством нескольких атомов. Например: функциональные органические соединения. Большое практическое значение имеют
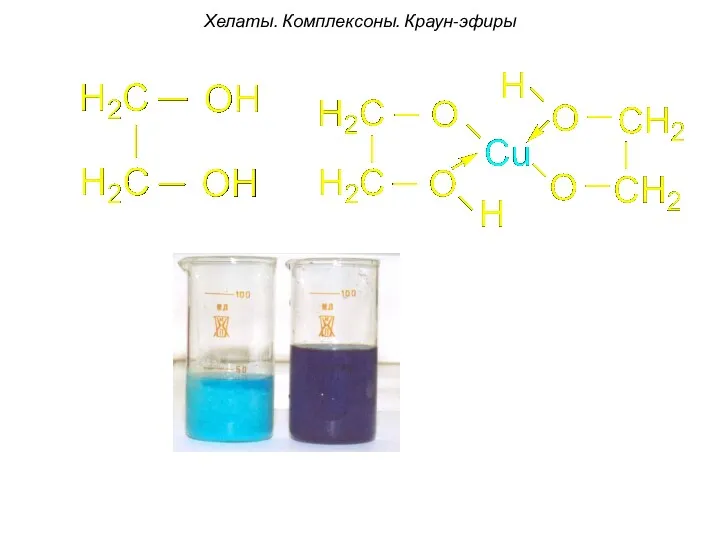
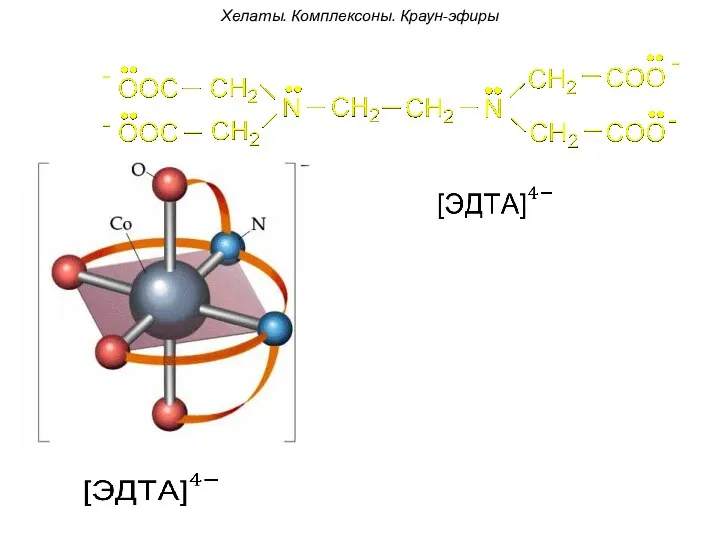
- 91. Хелаты. Комплексоны. Краун-эфиры Н-р, комплексон -I: содержит два атома азота. За счет электронных пар этих атомов
- 92. [Pt2+(Еn)4]2+ этилендиаминплатина (II) Хелаты. Комплексоны. Краун-эфиры
- 93. [Co3+(Еn)4]3+ этилендиаминкобальт(II) Хелаты. Комплексоны. Краун-эфиры
- 94. Хелаты. Комплексоны. Краун-эфиры Для удобства координации молекулы полидентатных лигандов сворачиваются в циклы. В таких комплексах комплексообразователь
- 95. Хелаты. Комплексоны. Краун-эфиры
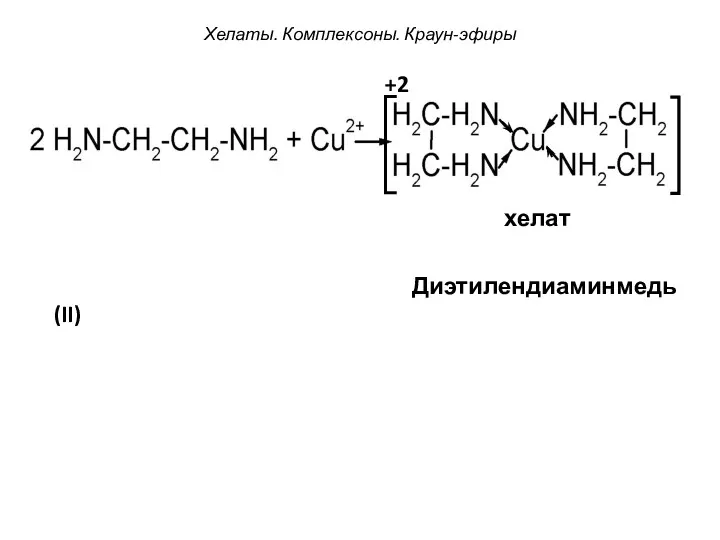
- 96. Хелаты. Комплексоны. Краун-эфиры +2 хелат Диэтилендиаминмедь(II)
- 97. Хелаты. Комплексоны. Краун-эфиры Обычно хелаты гораздо устойчивее комплексных соединений, содержащих монодентатные лиганды, т.к. комплексообразователь связан с
- 98. Хелаты. Комплексоны. Краун-эфиры
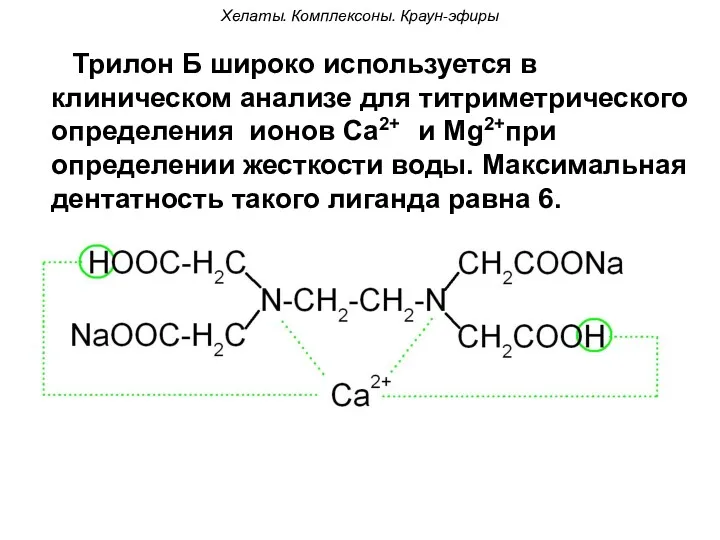
- 99. Хелаты. Комплексоны. Краун-эфиры Трилон Б широко используется в клиническом анализе для титриметрического определения ионов Са2+ и
- 100. Хелаты. Комплексоны. Краун-эфиры Особый тип полидентатных лигандов представляет собой циклические эфиры или краун-эфиры (от анг. crown
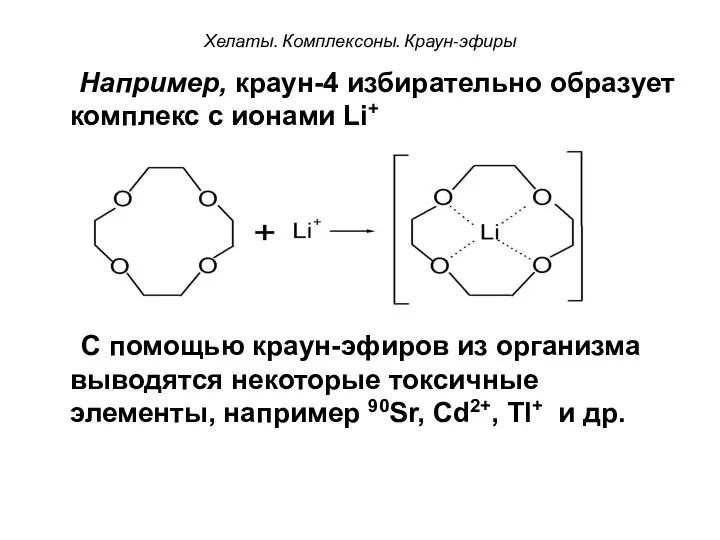
- 101. Хелаты. Комплексоны. Краун-эфиры Например, краун-4 избирательно образует комплекс с ионами Li+ + С помощью краун-эфиров из
- 103. Скачать презентацию

![[Fe(C5H5)2] [Ni(CO)4] Медико-биологическое значение темы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-2.jpg)
![B12 (Co[C62H88N13O14P])CN B12 - это хелат Co3+ c порфирином Медико-биологическое значение темы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-10.jpg)



![Строение комплексных соединений. Классификация. Номенклатура K3[Fe(CN)6] Ион- Комплексо- образователь Лиганды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-20.jpg)
![[Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение. Комплекс - центральный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-21.jpg)




![Электронные конфигурации Sc [Ar]3d14s2 Ti [Ar]3d24s2 V [Ar]3d34s2 Cr [Ar]3d54s1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-27.jpg)
![Электронные конфигурации Fe [Ar] 3d64s2 Co [Ar] 3d74s2 Ni [Ar]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-28.jpg)


![Механизм образования комплексного иона [Al(OH)4]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-35.jpg)


![Квадратный комплекс [Pt2+(NH3)2Cl2] КЧ = 4 (тетраэдр и плоский квадрат).](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-45.jpg)
![КЧ = 7 Пентагональная бипирамида [UO2(H2O)5]2+ Тригональная призма с одной](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-49.jpg)
![КЧ = 8 додекаэдр [Hf(ox)4]4- квадратная антипризма [Mo(CN)8]3- Строение комплексных соединений. Классификация. Номенклатура](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-50.jpg)
![КЧ = 8, [СoF8]5- квадратная антипризма Строение комплексных соединений. Классификация. Номенклатура](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-51.jpg)
![КЧ = 10, 12 КЧ=12, [Ce(NO3)6]2- КЧ = 10, [Bi(NO3)5]2- Строение комплексных соединений. Классификация. Номенклатура](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-53.jpg)





![Строение комплексных соединений. Классификация. Номенклатура Примеры: [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) I](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-59.jpg)
![Строение комплексных соединений. Классификация. Номенклатура Примеры: [AgI(NH3)2]OH – гидроксид диамминсеребра(I);](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-60.jpg)

![Строение комплексных соединений. Классификация. Номенклатура Примеры: K3[Fe(CN)6] Гексацианоферрат(III) калия III](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-62.jpg)


![Строение комплексных соединений. Классификация. Номенклатура Примеры: [Ni(CO)4] – тетракарбонилникель; [Co2(CO)8]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-65.jpg)
![Типы комплексных соединений 1. Аквакомплексы В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-66.jpg)
![Аквакомплексы Кристаллогидраты [Cu(H2O)4]SO4·H2O («медный купорос»)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-67.jpg)
![Аквакомплексы [Fe(H2O)6]SO4·H2O («железный купорос»)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-68.jpg)
![2. Гидроксокомплексы [Zn(OH)4]2– : OH–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-69.jpg)
![3. Аммины (аммиакаты) [Ag(NH3)2]+ : NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-70.jpg)
![[HgI4]2– [Fe(NCS)6]3− 4. Ацидокомплексы : Х–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-72.jpg)
![Na[BH4] Al[BH4]3 5. Гидридокомплексы : H–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-73.jpg)

![[Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3 [Ag(NH3)2]+ Ag+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-75.jpg)




![Геометрическая изомерия цис- (cis-) транс- (trans-) cis-[CoCl2(NH3)4]+ trans-[CoCl2(NH3)4]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-81.jpg)
![Оптическая изомерия Отражение Отражение [Co(En)2]3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-84.jpg)
![mirror plane cis-[Co(En)2Cl2]+ Пример: Энантиомерия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-85.jpg)
![enantiomers cis-[Co(En)2Cl2]+ Энантиомерия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-87.jpg)



![[Pt2+(Еn)4]2+ этилендиаминплатина (II) Хелаты. Комплексоны. Краун-эфиры](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-91.jpg)
![[Co3+(Еn)4]3+ этилендиаминкобальт(II) Хелаты. Комплексоны. Краун-эфиры](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/8850/slide-92.jpg)



 Доброкачественные и злокачественные опухоли почек
Доброкачественные и злокачественные опухоли почек Юношеские депрессии
Юношеские депрессии Менингококки и гонококки
Менингококки и гонококки Современные возможности фитотерапии артериальной гипертензии
Современные возможности фитотерапии артериальной гипертензии Увеальная меланома
Увеальная меланома Аневризмы
Аневризмы Основные зрительные функции, особенности их развития у детей. Центральное зрение: характеристика и методы исследования
Основные зрительные функции, особенности их развития у детей. Центральное зрение: характеристика и методы исследования Equipment and instruments of dental clinic. Passive voice
Equipment and instruments of dental clinic. Passive voice Ведение пациентов с внебольничной пневмонией на амбулаторном этапе
Ведение пациентов с внебольничной пневмонией на амбулаторном этапе ОРВИ и грипп
ОРВИ и грипп Нарушения водно-солевого обмена
Нарушения водно-солевого обмена Вопросы безопасности в анестезиологии и реаниматологии. Или как анестезиологу выжить самому и сохранить жизнь пациенту
Вопросы безопасности в анестезиологии и реаниматологии. Или как анестезиологу выжить самому и сохранить жизнь пациенту Наборы инструментов для операций
Наборы инструментов для операций Вирусология. Клиническая и экологическая микробиология. Инфекция и иммунитет при вирусных заболеваниях. (Модуль 3.22)
Вирусология. Клиническая и экологическая микробиология. Инфекция и иммунитет при вирусных заболеваниях. (Модуль 3.22) Адам ағзасының қалыпты микрофлорасы. Дисбактериоз
Адам ағзасының қалыпты микрофлорасы. Дисбактериоз Грипп и его профилактика
Грипп и его профилактика Мышцы живота и спины, паховый канал
Мышцы живота и спины, паховый канал Правила личной гигиены и здоровье
Правила личной гигиены и здоровье Приобретенные (вторичные) иммунодефициты
Приобретенные (вторичные) иммунодефициты Қаңқа сүйектерінің жастық ерекшеліктерін тану
Қаңқа сүйектерінің жастық ерекшеліктерін тану Группы крови. Резус-фактор
Группы крови. Резус-фактор Статистические показатели оценки деятельности учреждений здравоохранения
Статистические показатели оценки деятельности учреждений здравоохранения Общая патофизиология
Общая патофизиология Особенности оказания сестринской помощи пациентам с хроническим бронхитом в поликлинических условиях
Особенности оказания сестринской помощи пациентам с хроническим бронхитом в поликлинических условиях Окружающая среда и здоровье человека
Окружающая среда и здоровье человека Цитомегаловирус CMV (ЦМВ)
Цитомегаловирус CMV (ЦМВ) Физиология микроциркуляции. Особенности кровообращения в различных сосудистых областях
Физиология микроциркуляции. Особенности кровообращения в различных сосудистых областях 2. Морфология нарушений обмена белков и липидо
2. Морфология нарушений обмена белков и липидо