Механизм приобретенной резистентности микроорганизмов к антибиотикам – модификация мишени действия презентация
Содержание
- 2. Виды резистентности микроорганизмов к АБ Природная характеризуется отсутствием у микроорганизмов мишени действия антибиотика, недоступности мишени вследствие
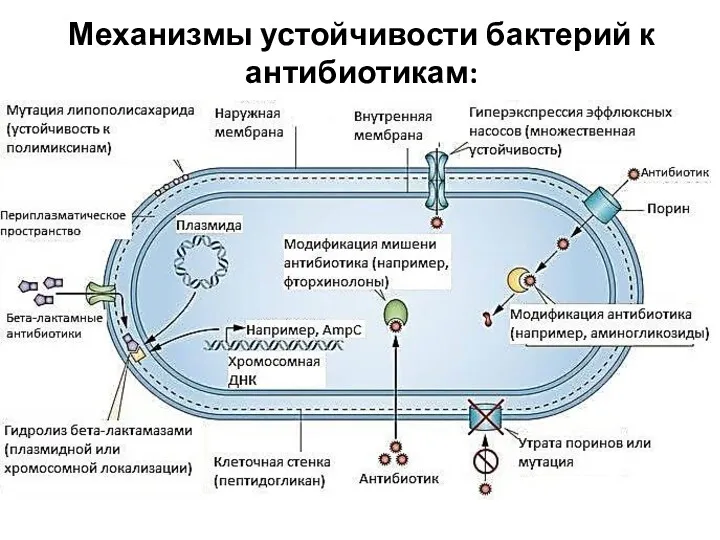
- 3. Модификация мишени действия. Инактивация антибиотика. Активное выведение антибиотика из микробной клетки (эффлюкс). Нарушение проницаемости внешних структур
- 4. Механизмы устойчивости бактерий к антибиотикам:
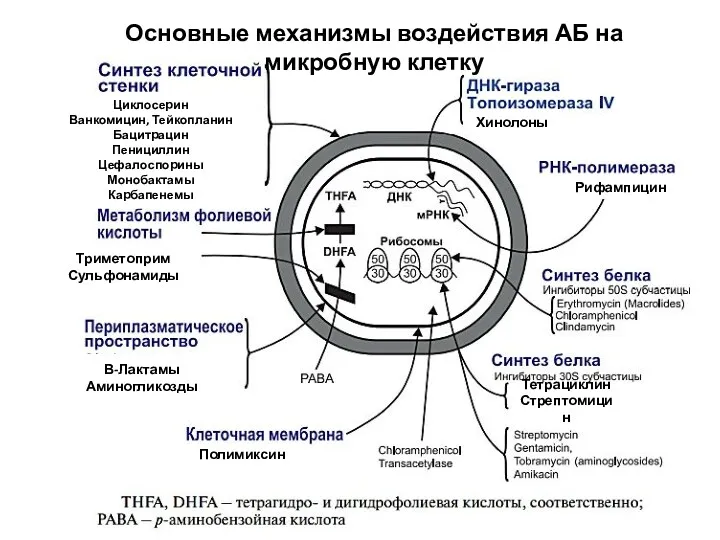
- 5. Основные механизмы воздействия АБ на микробную клетку Триметоприм Сульфонамиды Циклосерин Ванкомицин, Тейкопланин Бацитрацин Пенициллин Цефалоспорины Монобактамы
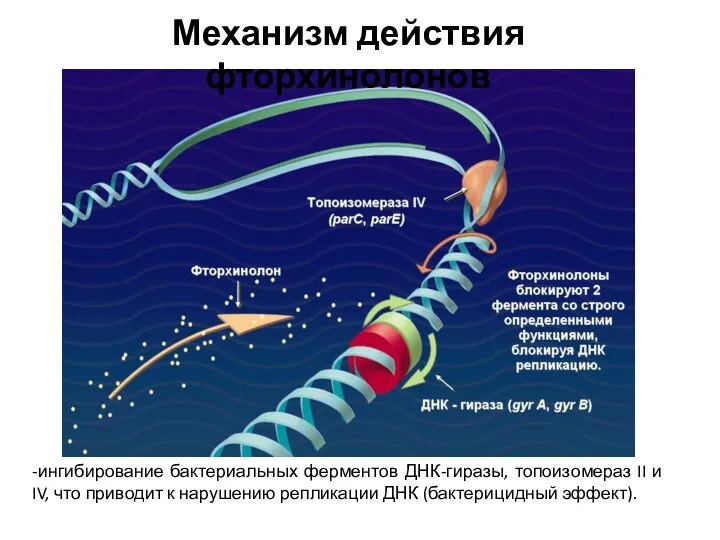
- 6. Устойчивость к фторхинолонам мишень действия: ДНК-гираза и топоизомераза IV
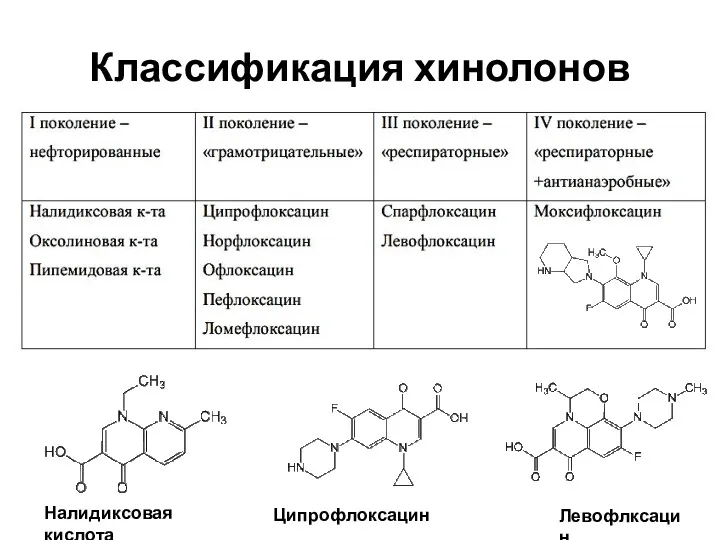
- 7. Классификация хинолонов Налидиксовая кислота Ципрофлоксацин Левофлксацин
- 8. -ингибирование бактериальных ферментов ДНК-гиразы, топоизомераз II и IV, что приводит к нарушению репликации ДНК (бактерицидный эффект).
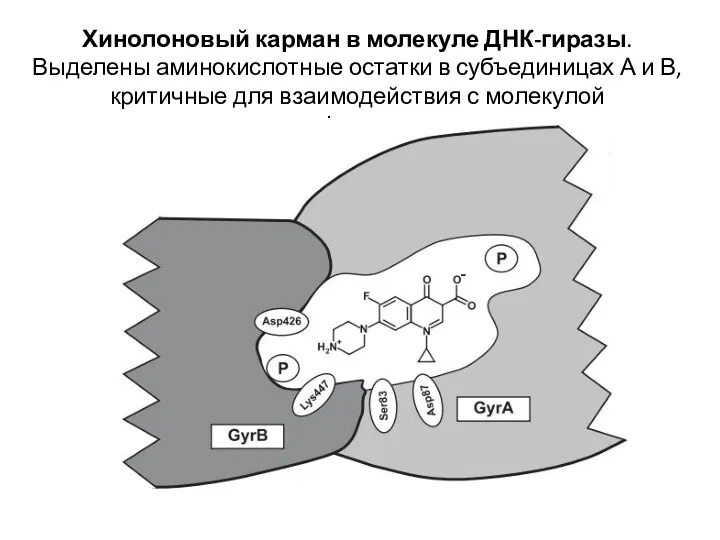
- 9. Хинолоновый карман в молекуле ДНК-гиразы. Выделены аминокислотные остатки в субъединицах А и В, критичные для взаимодействия
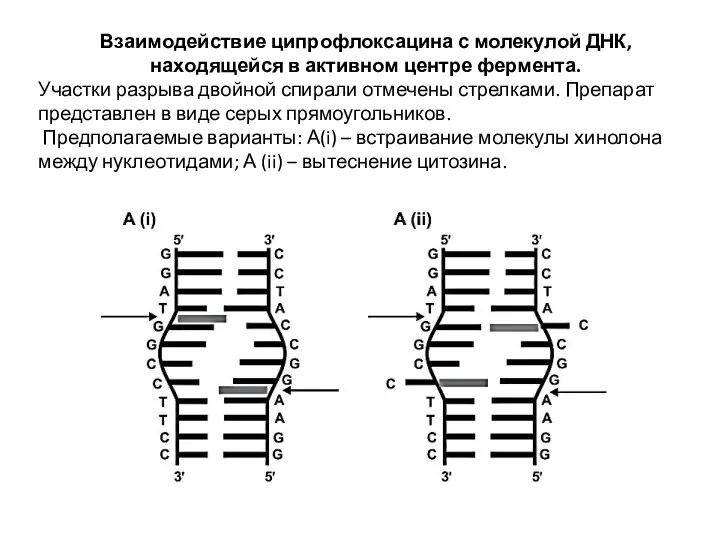
- 10. Взаимодействие ципрофлоксацина с молекулой ДНК, находящейся в активном центре фермента. Участки разрыва двойной спирали отмечены стрелками.
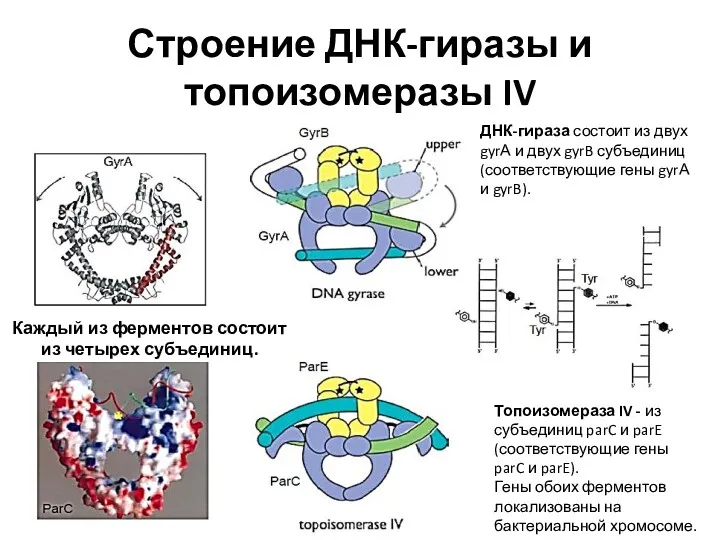
- 11. Строение ДНК-гиразы и топоизомеразы IV Каждый из ферментов состоит из четырех субъединиц. ДНК-гираза состоит из двух
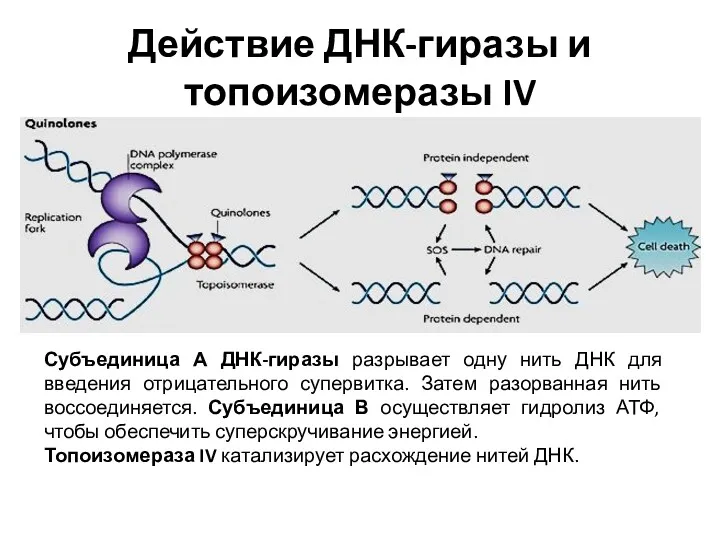
- 12. Субъединица А ДНК-гиразы разрывает одну нить ДНК для введения отрицательного супервитка. Затем разорванная нить воссоединяется. Субъединица
- 13. Устойчивость к ФХ развивается в результате спонтанных мутаций, приводящих к аминокислотным заменам в полипептидных цепях ДНК-гиразы
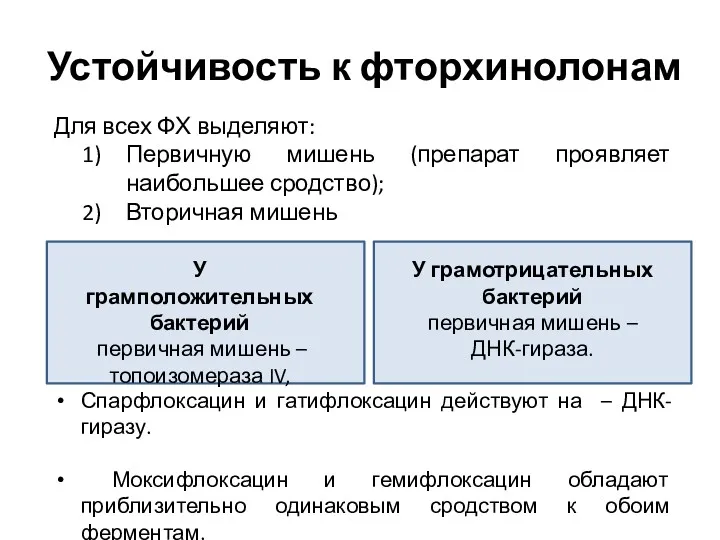
- 14. Для всех ФХ выделяют: Первичную мишень (препарат проявляет наибольшее сродство); Вторичная мишень Устойчивость к фторхинолонам Спарфлоксацин
- 15. Устойчивость к фторхинолонам После возникновения мутаций в генах фермента (первичной мишени действия) МПК препаратов обычно повышается
- 16. Имитация молекулы-мишени Интересный механизм устойчивости к хинолонам обнаружен у Mycobacterium smegmatis и Mycobacterium bovis. У этих
- 17. Приобретение генов менее чувствительной молекулы-мишени от других видов. Подобный механизм устойчивости к пенициллину распространен среди устойчивых
- 18. Механизм действия антибиотиков данной группы основан на ингибировании биосинтеза белка в результате связывания с 50S cубъединицей
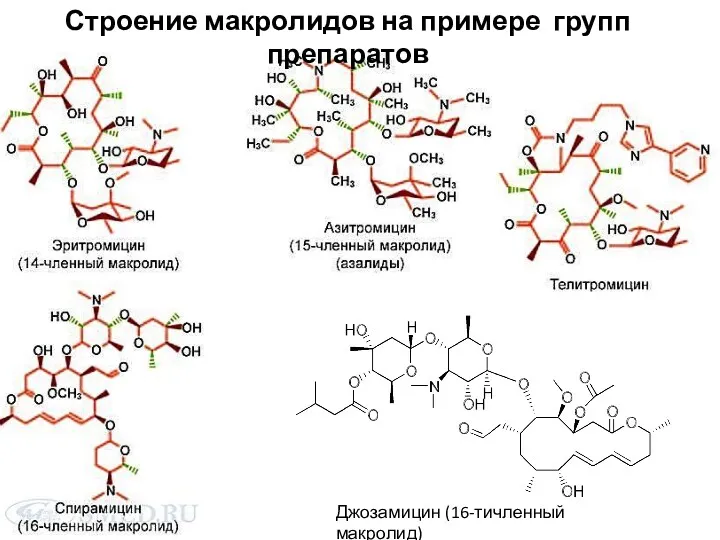
- 19. Джозамицин (16-тичленный макролид) Строение макролидов на примере групп препаратов
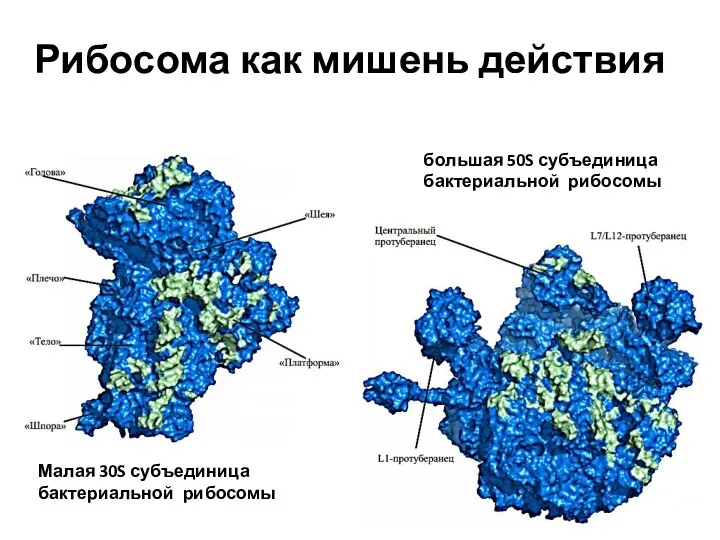
- 20. Малая 30S субъединица бактериальной рибосомы большая 50S субъединица бактериальной рибосомы Рибосома как мишень действия
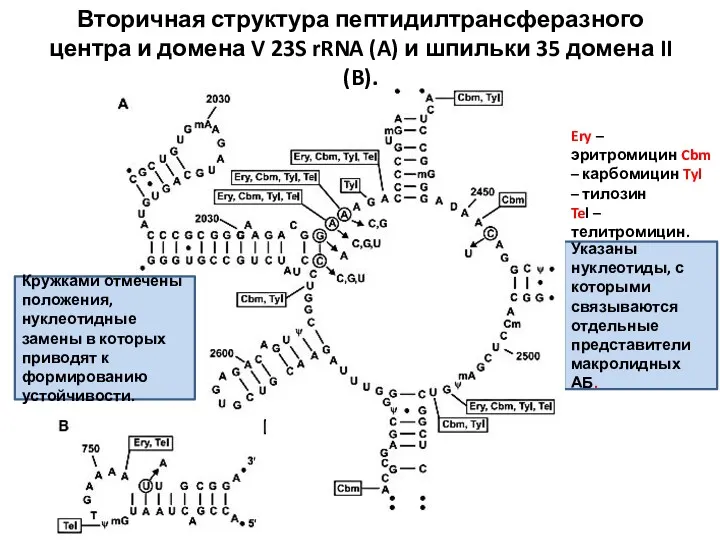
- 21. АБ связывается с доменами II и V рРНК. Основным участком связывания является домен V, причем основные
- 22. 2 варианта синтеза метилазы: При конститутивном типе синтез фермента не зависит от внешних условий. Соответственно, бактерии
- 23. Вторым механизмом развития устойчивости являются мутации в генах рРНК и рибосомальных белков, приводящие к конформационным изменениям
- 24. Указаны нуклеотиды, с которыми связываются отдельные представители макролидных АБ. Вторичная структура пептидилтрансферазного центра и домена V
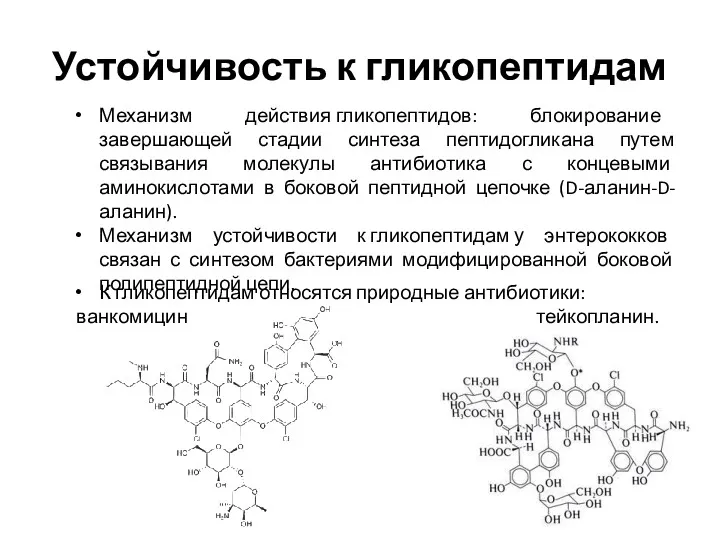
- 25. Устойчивость к гликопептидам Механизм действия гликопептидов: блокирование завершающей стадии синтеза пептидогликана путем связывания молекулы антибиотика с
- 26. Мишень действия: фермент ДНК-зависимая РНК-полимераза (ген rpoB). Устойчивость к рифамицинам (рифампицину, рифабутину и др.) (более 95%
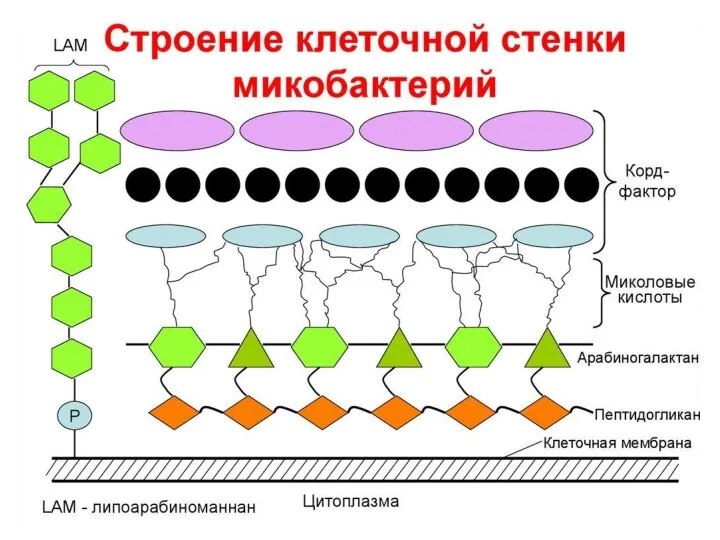
- 27. Устойчивость микобактерий к изониазиду Изониазид представляет собой пролекарство. При монотерапии изониазидом к нему быстро (в 70%
- 29. Устойчивость микобактерий к этамбутолу Мишень действия: белок embB (арабинозилотрансфераза), участвующий в биосинтезе компонента клеточной стенки микобактерий
- 30. Устойчивость к β-лактамным АБ Мишень действия β-лактамов: ферменты – ПСБ, участвующие в синтезе клеточной стенки бактерий.
- 31. Выводы Модификация молекулы-мишени обусловлена разными механизмами: Возникновением спонтанных генных мутаций, приводящих к структурным изменениям кодируемых им
- 32. - Staphylococcus spp.: резистентность к природным и полусинтетическим пенициллинам (за счет продукции бета-лактамаз); - S.aureus (метициллинорезистентные):
- 34. Скачать презентацию
















 Сопутствующие заболевания и вторичные нарушения при ДЦП. Речевые и психические отклонения
Сопутствующие заболевания и вторичные нарушения при ДЦП. Речевые и психические отклонения Этические проблемы генной инженерии
Этические проблемы генной инженерии Методика имплантации. Возможные осложнения, их профилактика и лечение
Методика имплантации. Возможные осложнения, их профилактика и лечение Малярия. Этиология. Классификация. Клиника
Малярия. Этиология. Классификация. Клиника Нуклеопротеидттер алмасуының бұзылуы. Подагра
Нуклеопротеидттер алмасуының бұзылуы. Подагра Изучение влияния громкой музыки на слух, работоспособность и физиологические состояние организма
Изучение влияния громкой музыки на слух, работоспособность и физиологические состояние организма Профилактика наркомании и формирование установок на ведение здорового образа жизни среди молодежи
Профилактика наркомании и формирование установок на ведение здорового образа жизни среди молодежи Микробиологическая диагностика сальмонеллёзов
Микробиологическая диагностика сальмонеллёзов Medical Education in Czech Republic
Medical Education in Czech Republic Гортань и методы ее исследования
Гортань и методы ее исследования Трахеостомия
Трахеостомия Анализ затрат на лекарственные средства с помощью ABC/VEV методологии
Анализ затрат на лекарственные средства с помощью ABC/VEV методологии Особенности мочевыделительной системы у детей
Особенности мочевыделительной системы у детей Диспансеризация и диспансерное наблюдение
Диспансеризация и диспансерное наблюдение Научные статьи в электронных базах о влиянии климатических изменений у детей с атопической экземой
Научные статьи в электронных базах о влиянии климатических изменений у детей с атопической экземой Psoriasis and lichen
Psoriasis and lichen Бүйректе тас түзілудің себептері мен даму механизмдері
Бүйректе тас түзілудің себептері мен даму механизмдері Кровотеча
Кровотеча Алгоритм швидкого виявлення випадків туберкульозу
Алгоритм швидкого виявлення випадків туберкульозу Кампилобактериоз
Кампилобактериоз Полктың (бр) қорғаныстағы медициналық қамтамасыз етуін ұйымдастыру
Полктың (бр) қорғаныстағы медициналық қамтамасыз етуін ұйымдастыру Сифилис. Исторические аспекты
Сифилис. Исторические аспекты Анатомия и физиология мочевой системы
Анатомия и физиология мочевой системы Ятрогендік аурулар
Ятрогендік аурулар Грыжи живота
Грыжи живота Сепсис. Этиологиясы. Патогенезі. Дагностикасы. Емделуі
Сепсис. Этиологиясы. Патогенезі. Дагностикасы. Емделуі Аномалии развития половых органов у мальчиков
Аномалии развития половых органов у мальчиков Онкология. Обзорная информация
Онкология. Обзорная информация