Содержание
- 2. Розвиток пухлин Відбувається із залученням імунних механізмів Динаміка пухлинного росту визначається рівновагою між факторами імунного нагляду
- 3. Етіологія пухлин (канцерогени) Хімічні: Канцерогенні хімічні речовини Харчові канцерогени Канцерогени-гормони (ГКС, естрогени) Фізичні (УФ, рентгенівське, радіоізотопне
- 4. Теорії розвитку пухлин Теорія моноклонального походження – канцероген викликає мутацію 1 клітини, з якої виростає пухлинний
- 5. Концепції розвитку пухлин Концепція генетичних мутацій – активація протоонкогенів (мутація, транслокація в активну частину геному, ампліфікація,
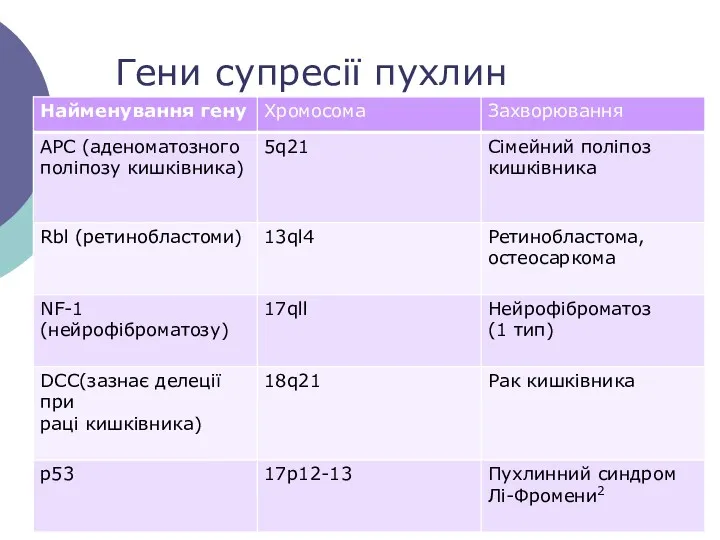
- 6. Гени супресії пухлин
- 7. Стадии канцерогенеза: Стадия 1. Первичная мутация гена — активизирует ростовые факторы, стимулирующие деление клетки, а также
- 8. Стадия 4. Появление множественных злокачественных клонов в результате дополнительных генных мутаций, обеспечивающих ещё большую автономию от
- 9. Механізми виникнення онкогенів Вбудовування вірусного онкогену Активація клітинного онкогену вбудованим вірусом Транслокація генетичного матеріалу з активацією
- 10. Фактори розвитку пухлини Антибластомні імунні фактори: Клітинні: Т-кілери ПК- і К-лімфоцити Активовані макрофаги Гуморальні: Специфічні антитіла
- 11. Фактори розвитку пухлини Фактори імунорезистентності пухлин: Слабка імуногенність пухлинних антигенів Постійна модифікація антигенів Селекція імунологічно стійких
- 12. Фактори розвитку пухлини Пробластомні фактори, що пригнічують імунітет: Супресивні речовини, продуковані лімфоцитами і макрофагами Блокуючі антитіла
- 13. Фактори розвитку пухлини Пробластомні фактори, що посилюють ріст пухлини: Фактор росту пухлини (продукують макрофаги) ІЛ-6 Фактор
- 14. Особливості поверхневих структур пухлинних клітин Онкофетальні антигени: α-фетопротеїн – первинний рак печінки, пухлини яєчок, рак простати,
- 15. Особливості поверхневих структур пухлинних клітин Специфічні пухлинні антигени: ПСА – рак простати Р-53 – рак сечового
- 16. Особливості поверхневих структур пухлинних клітин Розчинні пухлинні антигени – відволікають імунну систему, виснажуючи її резерви Токсинвивідний
- 17. Клітинні механізми протипухлинного імунного захисту Цитотоксичні Т-кілери: Індукція апоптозу пухлинної клітини Осмотичний лізис пухлинної клітини Т1-хелпери:
- 18. Гуморальні механізми протипухлинного імунного захисту Специфічні антитіла: Формування імунних комплексів на поверхні пухлинної клітини з активацією
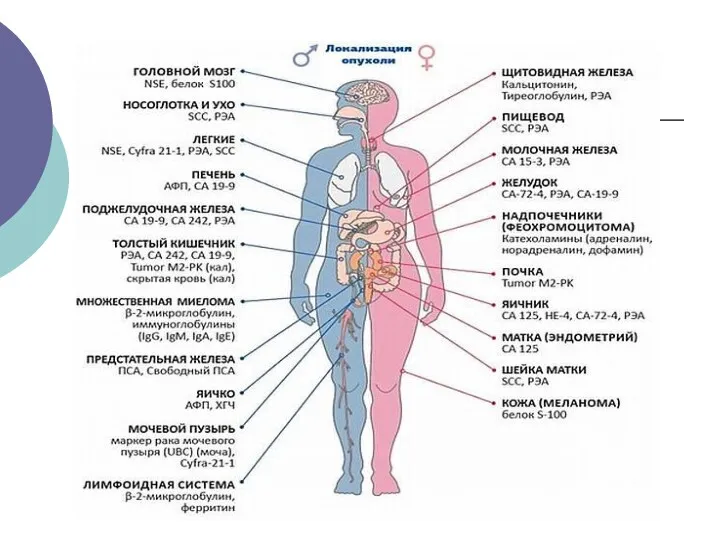
- 19. Онкомаркеры – вещества, содержание которых в крови коррелирует с наличием или прогрессирующим ростом злокачественной опухоли. Критерии,
- 20. Классификация онкомаркеров I.По химической структуре : гликопротеиды, липопротеиды, полипептиды, гликолипиды и т. д. II.По биологической функции
- 22. Імунотерапія пухлин Моноклональні антитіла Цитокінотерапія: Інтерферони Інтерлейкін-2 Фактор некрозу пухлин-α Генна терапія (протиракові вакцини). У клітини
- 23. Моноклональные антитела Это антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, то есть произошедшими из
- 24. Области применения моноклональных антител: идентификация субпопуляций лимфоцитов человека истощение клеточных популяций выделение клеток установление функций молекул
- 25. Как же получают моноклональные антитела???
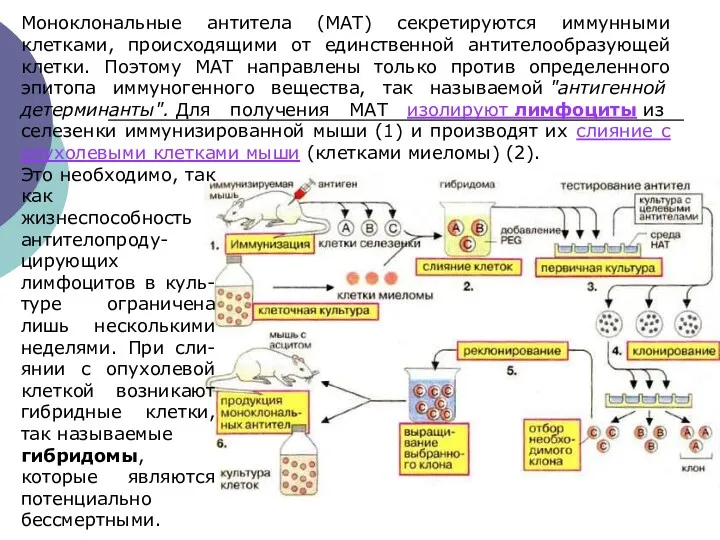
- 26. Моноклональные антитела (МАТ) секретируются иммунными клетками, происходящими от единственной антителообразующей клетки. Поэтому МАТ направлены только против
- 27. Гибридо́ма — гибридная клеточная линия, полученная в результате слияния клеток двух видов: способных к образованию антител
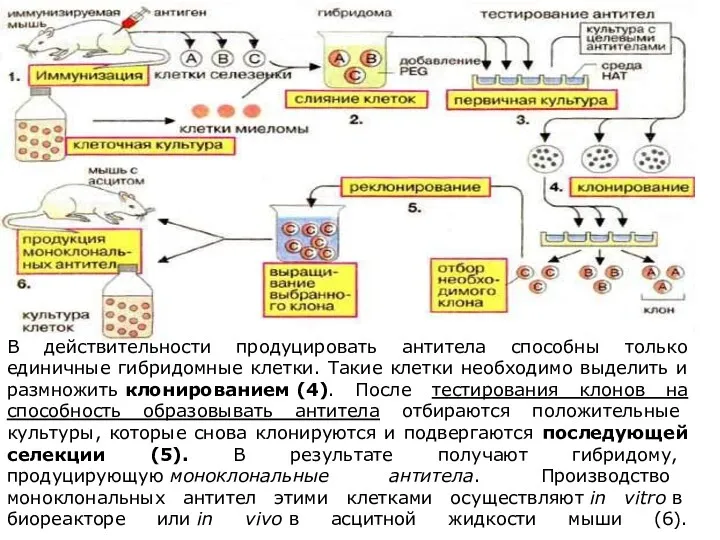
- 28. В действительности продуцировать антитела способны только единичные гибридомные клетки. Такие клетки необходимо выделить и размножить клонированием
- 29. Минусы и плюсы МАТ МАТ — слишком крупные молекулы, неспособные проникать внутрь клетки или глубоко в
- 30. Моноклональные антитела в лечении онкологических заболеваний В терапии опухолей используют два типа МАТ: простые, или неконъюгированные
- 31. Алемтузумаб (Мабкэмпас, Кэмпас) Антитела к CD52 были разработаны в Англии. После многочисленных исследований, алемтузумаб был одобрен
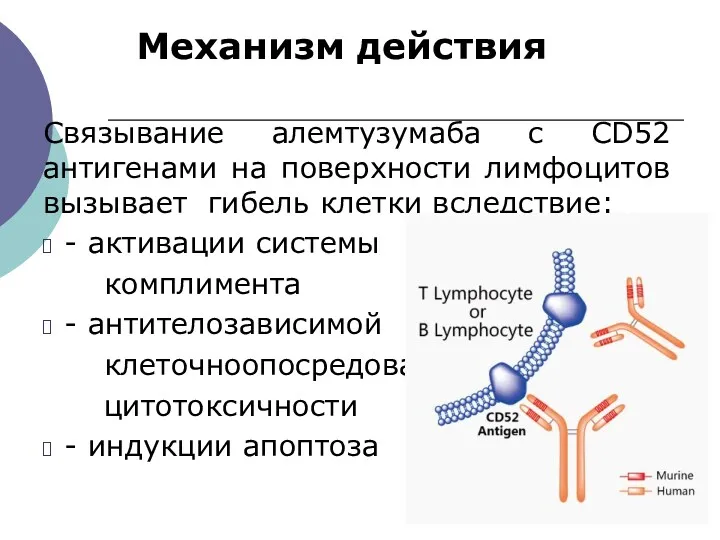
- 32. Механизм действия Связывание алемтузумаба с CD52 антигенами на поверхности лимфоцитов вызывает гибель клетки вследствие: - активации
- 33. Простые моноклональные антитела Ритуксимаб (Ритуксан, Мабтера) стал первым МАТ, одобренным для применения в онкологии. Изначально разработанный
- 34. Трастузумаб (Герцептин) стал первым гуманизированным антителом, зарегистрированным для лечения солидных опухолей в 1998 г. Трастузумаб —
- 35. Моноклональные антитела как носители активных веществ В последние годы МАТ стали применяться для доставки цитотоксических веществ
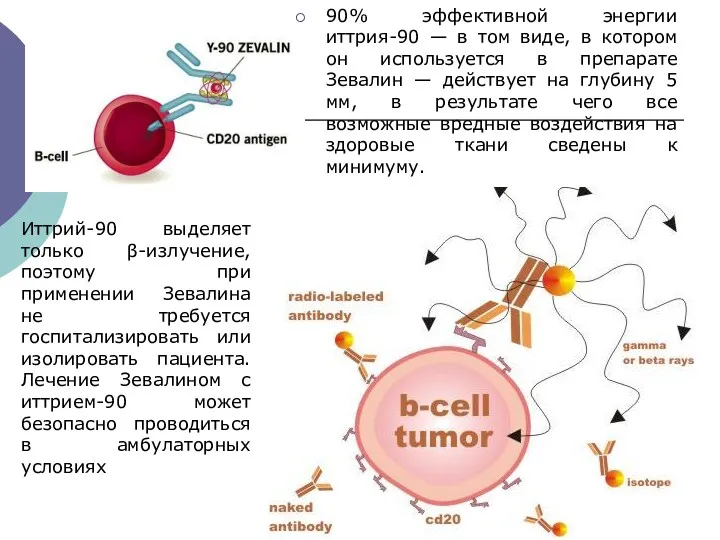
- 36. МАТ с радиоактивными частицами Ибритумомаб тиуксетан (Зевалин) — МАТ против CD20, соединенное с иттрием-90. Сочетанное действие
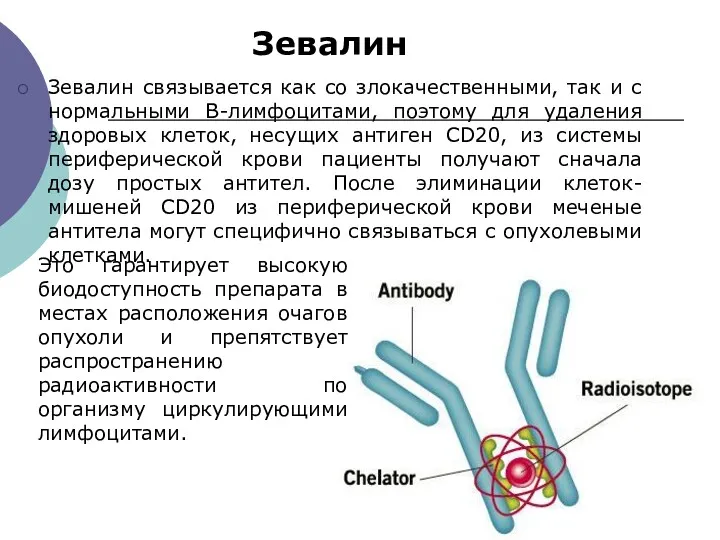
- 37. Зевалин Зевалин связывается как со злокачественными, так и с нормальными В-лимфоцитами, поэтому для удаления здоровых клеток,
- 38. 90% эффективной энергии иттрия-90 — в том виде, в котором он используется в препарате Зевалин —
- 39. Тозитумомаб (Бексар) — мышиные МАТ к антигену CD20, к которым прикреплен радиоактивный изотоп йода-131. Препарат получил
- 40. Блінатумомаб – синтетичне моноклональне АТ, одна частина якого зв’язується з CD19 (антигеном на поверхні пухлинних В-лімфоцитів),
- 41. Пухлиноінфільтруючі лімфоцити Лімфоцити хворого культивують in vitro в присутності його атипових клітин та ІЛ-2 (фактор росту).
- 42. Імуностимулюючі фактори БЦЖ (Bacillus Calmette-Guérin) (бацила Кальметта-Герена) – ослаблена жива коров’яча туберкульозна бацила. П/ш вводять при
- 44. Скачать презентацию

































 Болезнь Лайма
Болезнь Лайма Бронхиальная астма у детей
Бронхиальная астма у детей Атеросклероз
Атеросклероз Тип герпесвируса человека
Тип герпесвируса человека Нарушение функций половых желез
Нарушение функций половых желез Нарушения периферического кровообращения
Нарушения периферического кровообращения Surgical operation and post-operation period
Surgical operation and post-operation period Халықтың радиациялық қауіпсіздігін қамтамасыз ету мен қоршаған ортаны радиациядан қорғау бойынша ҚР негізгі заңды актілері
Халықтың радиациялық қауіпсіздігін қамтамасыз ету мен қоршаған ортаны радиациядан қорғау бойынша ҚР негізгі заңды актілері Снотворные средства
Снотворные средства Созылмалы лимфолейкоз
Созылмалы лимфолейкоз Препараты карбапенемы и монобактамы. Спектр действия
Препараты карбапенемы и монобактамы. Спектр действия Грыжи передней брюшной стенки
Грыжи передней брюшной стенки Босанғаннан кейінгі ерте кезеңдегі қан кетудің себептері: травма,тромбин
Босанғаннан кейінгі ерте кезеңдегі қан кетудің себептері: травма,тромбин Урогенитальный хламидиоз
Урогенитальный хламидиоз Кишечные инфекции
Кишечные инфекции Сатып алу логистикасын ұйымдастыруға арналған шығындарды анықтаудың типологиясы
Сатып алу логистикасын ұйымдастыруға арналған шығындарды анықтаудың типологиясы Жақ кисталары. Фолликулярлы және радикулярлы кисталар
Жақ кисталары. Фолликулярлы және радикулярлы кисталар Rickettsial infection
Rickettsial infection Наиболее распространенные варианты остеохондропатий
Наиболее распространенные варианты остеохондропатий Телемедицина. Лекционное занятие
Телемедицина. Лекционное занятие Механізм дії променевої енергії на організм
Механізм дії променевої енергії на організм Навигационная хирургия в дентальной имплантологии. Имплантация в стоматологии
Навигационная хирургия в дентальной имплантологии. Имплантация в стоматологии Бағаналы жасушалардың моральды-этиқалық мәселелері
Бағаналы жасушалардың моральды-этиқалық мәселелері Подъем сегмента ST – всегда ли инфаркт. Электрокардиография
Подъем сегмента ST – всегда ли инфаркт. Электрокардиография Планирование выполнения операции Лабиринт IIIВ
Планирование выполнения операции Лабиринт IIIВ Актуальные проблемы желчнокаменной болезни
Актуальные проблемы желчнокаменной болезни Эвтаназия
Эвтаназия Профилактика сердечно-сосудистых заболеваний
Профилактика сердечно-сосудистых заболеваний