Содержание
- 2. Слайд 2 Миорелаксанты – необходимая составляющая общей анестезии Обеспечивают хирургический доступ к органам без препятствий в
- 3. Слайд 3 Миорелаксанты угнетают нервно-мышечную передачу1 МР препятствуют связыванию ацетилхолина с его рецепторами, что приводит к
- 4. Слайд 4 Мониторинг нервно-мышечной передачи путем стимуляции периферического нерва1 Мониторинг нервно-мышечной передачи необходим для точной дозировки
- 5. Слайд 5 Миорелаксанты и ответ на TOF стимуляцию1 МР = миорелаксанты. 1. Hunter JM. N Eng
- 6. Слайд 6 Устранение нервно-мышечного блока Предпочтительно быстрое, полное и надежное восстановление нейромышечной проводимости1 Спонтанное восстановление после
- 7. Слайд 7 Идеальный МР для хирургических вмешательств Недеполяризующий механизм действия Быстрое начало действия Короткая продолжительность действия
- 8. Слайд 8 Существующие МР1 МР = миорелаксанты. 1. Morgan GE Jr et al. Clinical Anesthesiology. 4th
- 9. Слайд 9 Сукцинилхолин считался миорелаксантом выбора1 Деполяризующий механизм действия Быстрое начало действия Короткая продолжительность действия Спонтанное
- 10. Слайд 10 Сукцинилхолин вызывает множество побочных эффектов1 Побочные эффекты сукцинилхолина иногда могут приводить к тяжелым осложнениям,
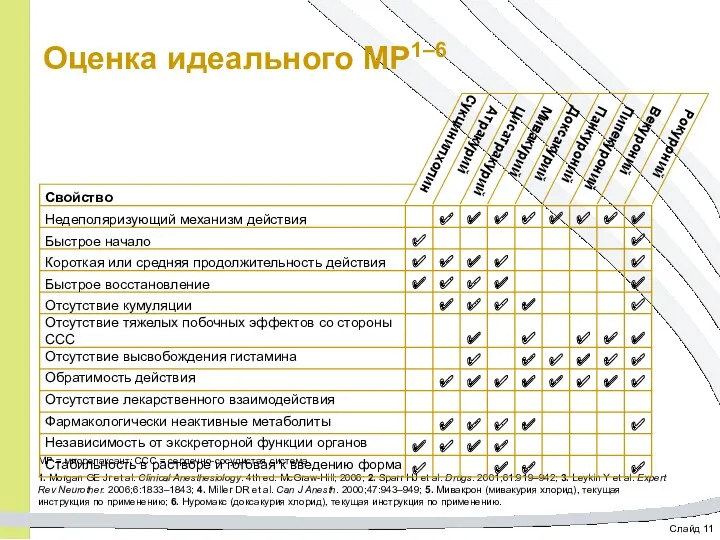
- 11. Слайд 11 Оценка идеального МР1–6 МР = миорелаксант; ССС = сердечно-сосудистая система. 1. Morgan GE Jr
- 12. Слайд 12 Рокуроний1 Рокуроний представляет собой недеполяризующий миорелаксант, который связывается с н-холинорецепторами концевой пластинки мембраны мышечных
- 13. Слайд 13 Рокуроний приближается по свойствам к идеальному МР Недеполяризующий механизм действия1 Быстрое начало действия2 Средняя
- 14. Слайд 1 Нервно-мышечный блок Модуль 2: Начало действия миорелаксантов
- 15. Слайд 2 Свойства идеального МР1 Недеполяризующий механизм действия Быстрое начало действия МР = миорелаксант. 1. Booij
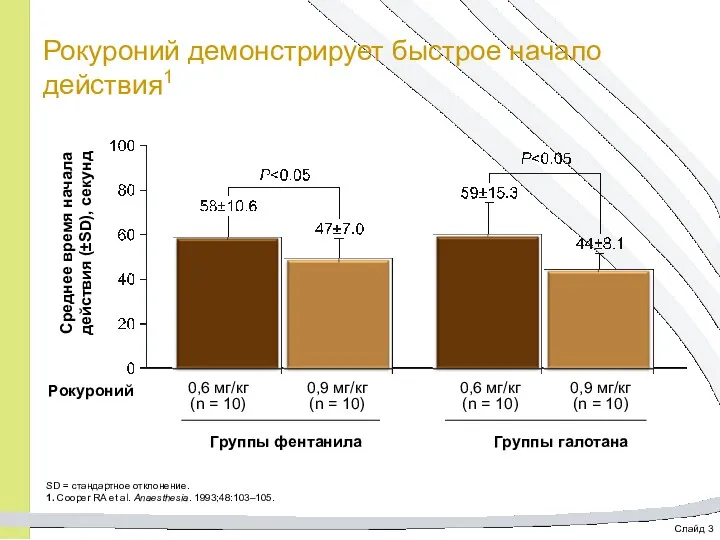
- 16. Слайд 3 Рокуроний демонстрирует быстрое начало действия1 Среднее время начала действия (±SD), секунд Рокуроний Группы фентанила
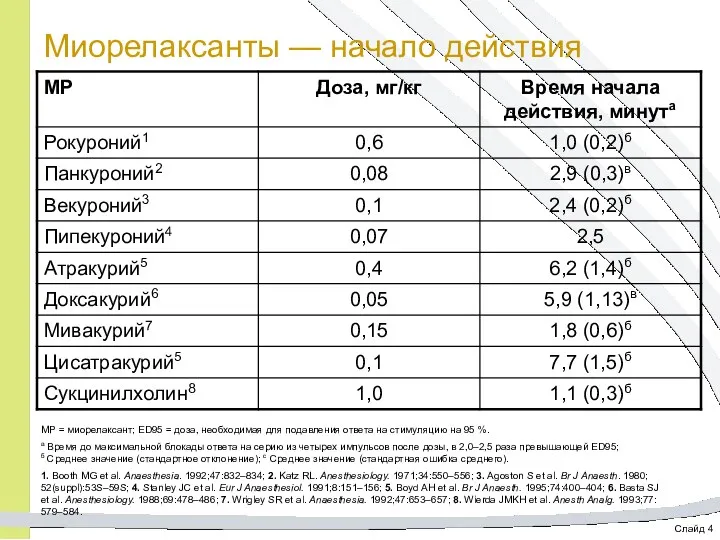
- 17. Слайд 4 Миорелаксанты — начало действия МР = миорелаксант; ED95 = доза, необходимая для подавления ответа
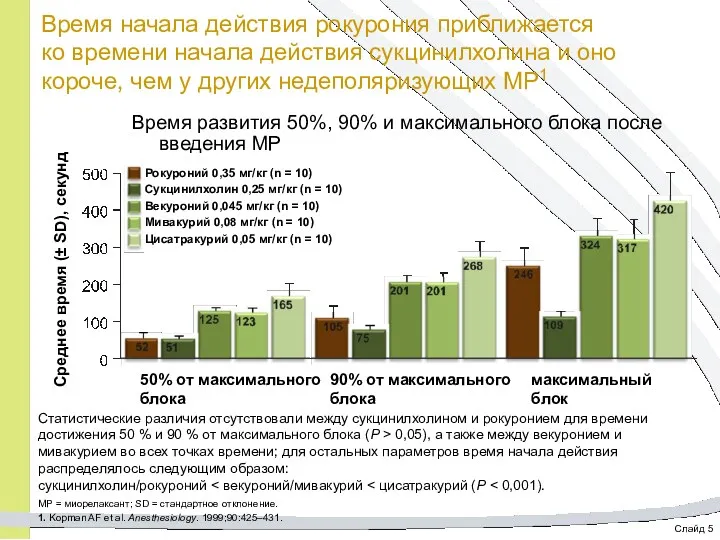
- 18. Слайд 5 Время начала действия рокурония приближается ко времени начала действия сукцинилхолина и оно короче, чем
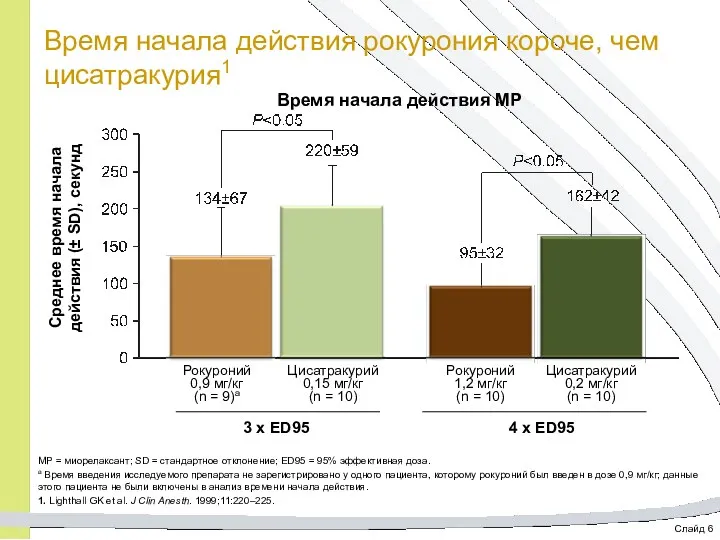
- 19. Слайд 6 Время начала действия рокурония короче, чем цисатракурия1 МР = миорелаксант; SD = стандартное отклонение;
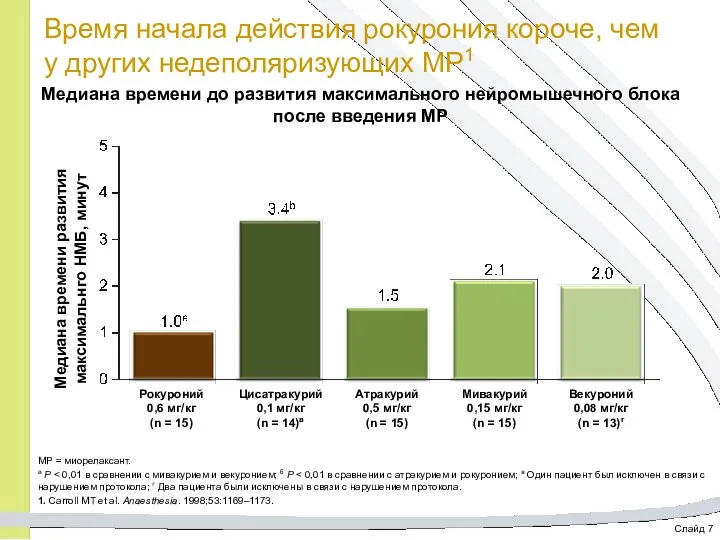
- 20. Слайд 7 Время начала действия рокурония короче, чем у других недеполяризующих МР1 Медиана времени до развития
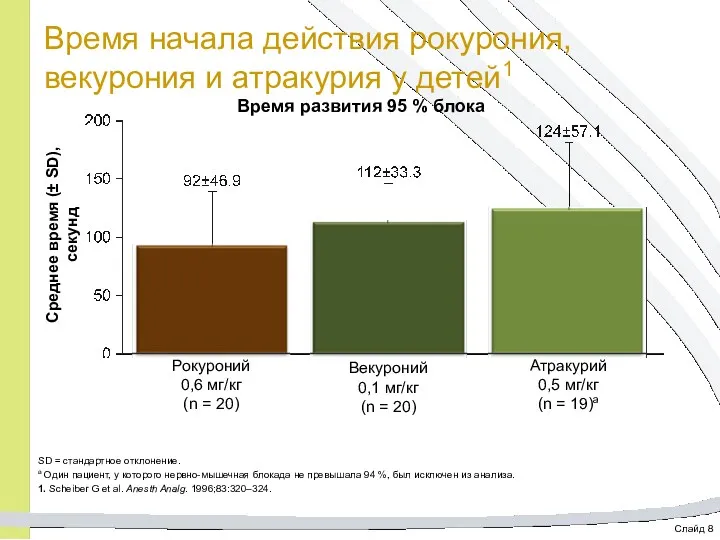
- 21. Слайд 8 Время начала действия рокурония, векурония и атракурия у детей1 Время развития 95 % блока
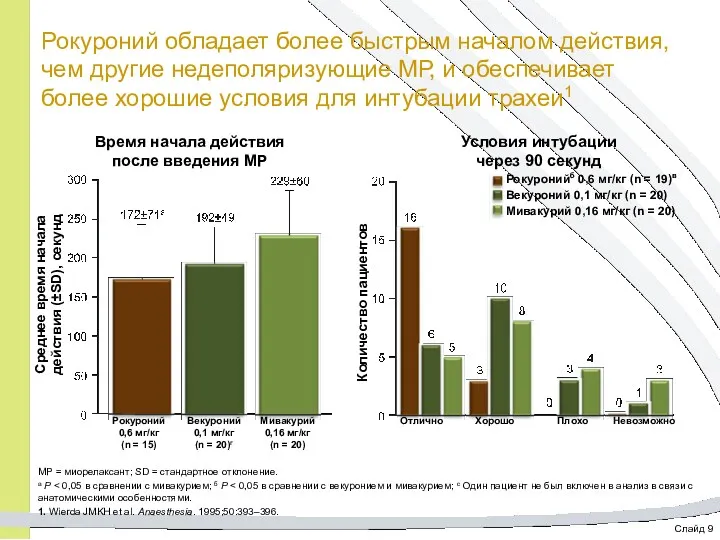
- 22. Слайд 9 Рокуроний обладает более быстрым началом действия, чем другие недеполяризующие МР, и обеспечивает более хорошие
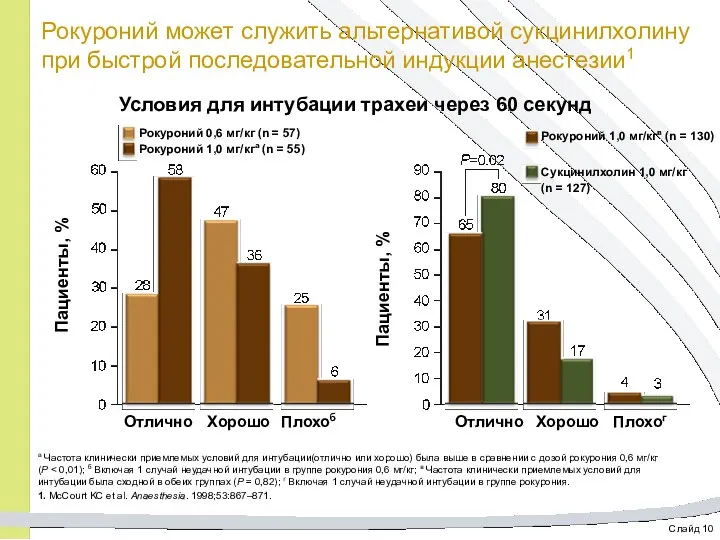
- 23. Слайд 10 Рокуроний может служить альтернативой сукцинилхолину при быстрой последовательной индукции анестезии1 Условия для интубации трахеи
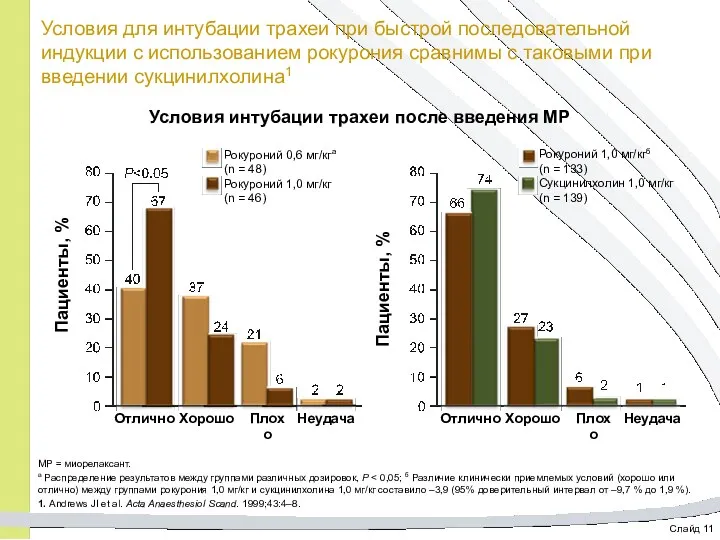
- 24. Слайд 11 Условия для интубации трахеи при быстрой последовательной индукции с использованием рокурония сравнимы с таковыми
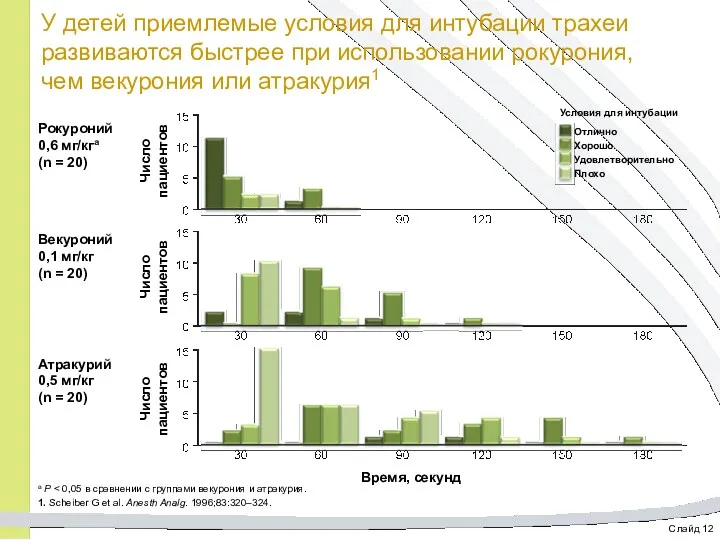
- 25. Слайд 12 У детей приемлемые условия для интубации трахеи развиваются быстрее при использовании рокурония, чем векурония
- 26. Слайд 1 Нервно-мышечный блок Модуль 3: клиническая продолжительность действия и управляемость
- 27. Слайд 2 Свойства идеального МР1 Недеполяризующий механизм действия Быстрое начало действия Короткая и управляемая клиническая продолжительность
- 28. Слайд 3 Продолжительность действия МР: основные определения Клиническая продолжительность действия: время от введения МР до восстановления
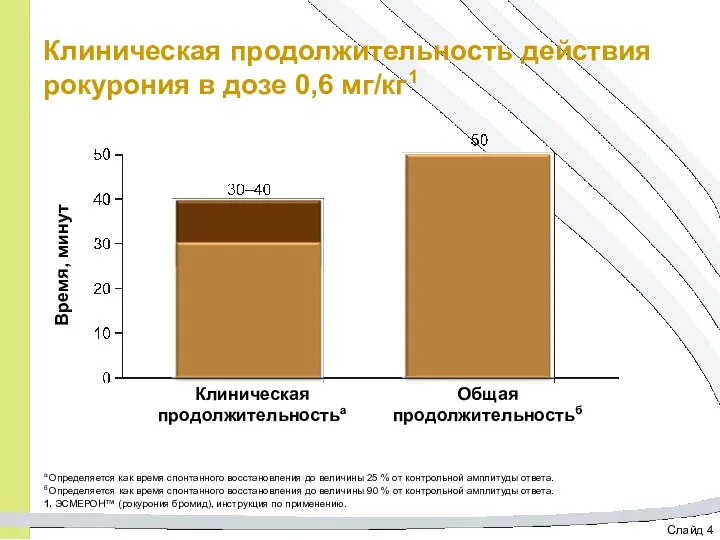
- 29. Слайд 4 Клиническая продолжительность действия рокурония в дозе 0,6 мг/кг1 а Определяется как время спонтанного восстановления
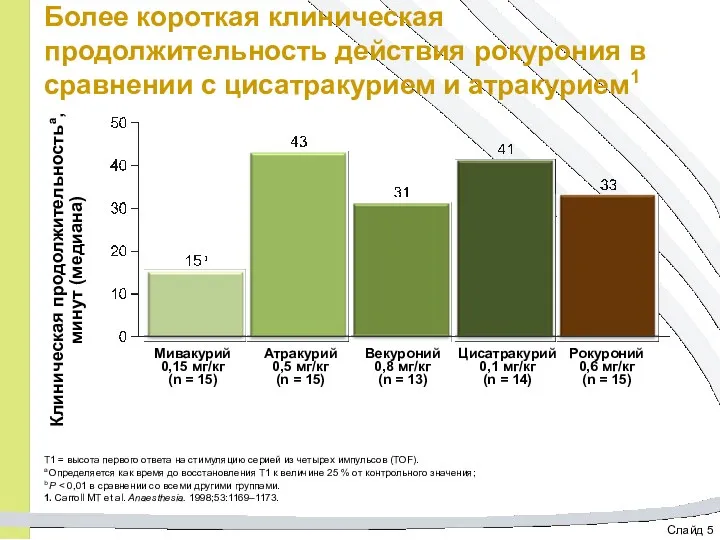
- 30. Слайд 5 Более короткая клиническая продолжительность действия рокурония в сравнении с цисатракурием и атракурием1 T1 =
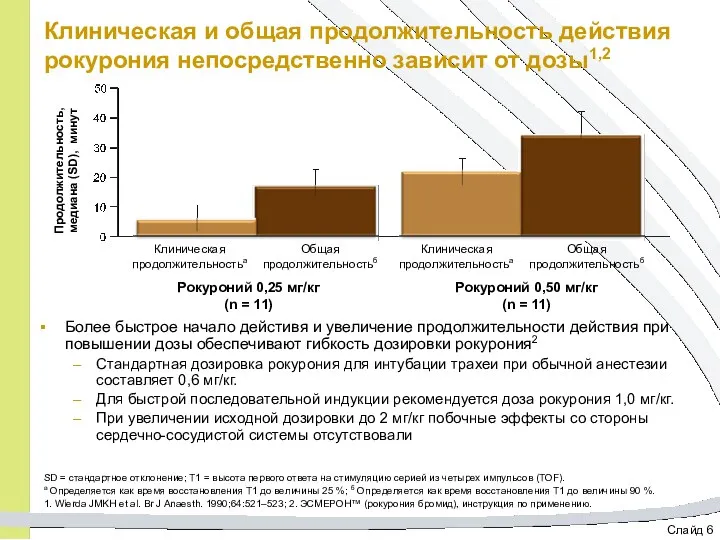
- 31. Слайд 6 Клиническая и общая продолжительность действия рокурония непосредственно зависит от дозы1,2 Более быстрое начало дейстивя
- 32. Слайд 7 Влияние возраста, пола, функции почек и печени на продолжительность действия рокурония Продолжительность действия рокурония
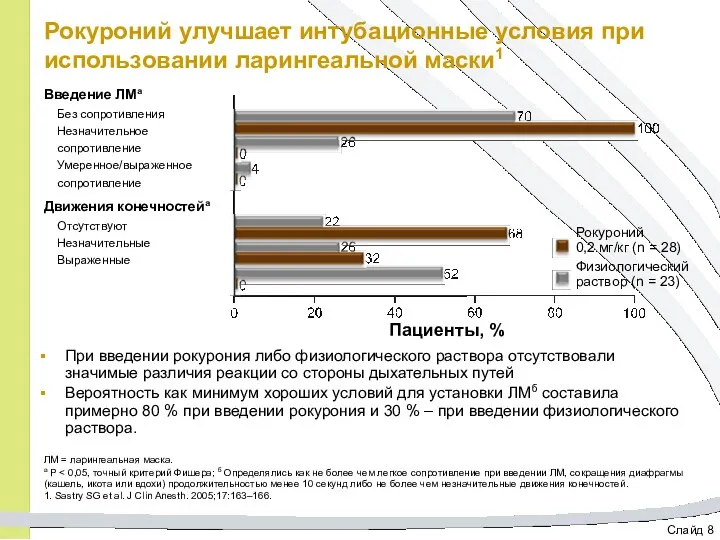
- 33. Слайд 8 Рокуроний улучшает интубационные условия при использовании ларингеальной маски1 При введении рокурония либо физиологического раствора
- 34. Слайд 9 Свойства идеального МР1 Недеполяризующий механизм действия Быстрое начало действия Короткая и управляемая клиническая продолжительность
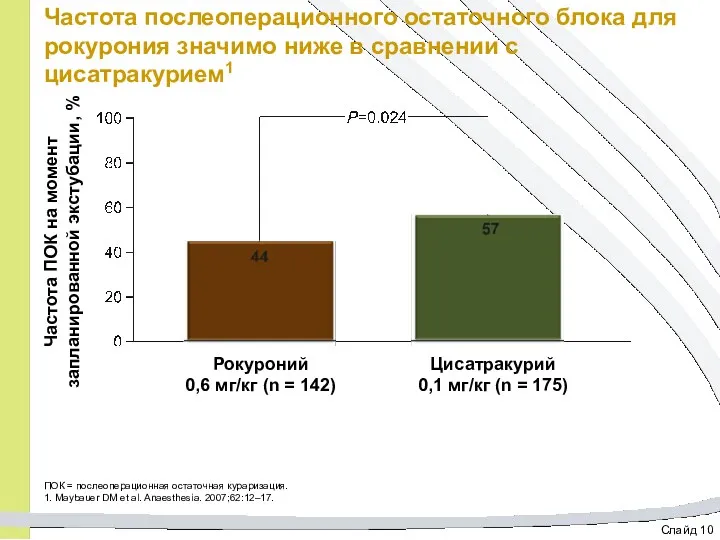
- 35. Слайд 10 Частота послеоперационного остаточного блока для рокурония значимо ниже в сравнении с цисатракурием1 ПОК =
- 36. Слайд 11 Восстановление из глубокого НМБ, вызванного рокуронием, происходит значительно быстрее при использовании сугаммадекса в сравнении
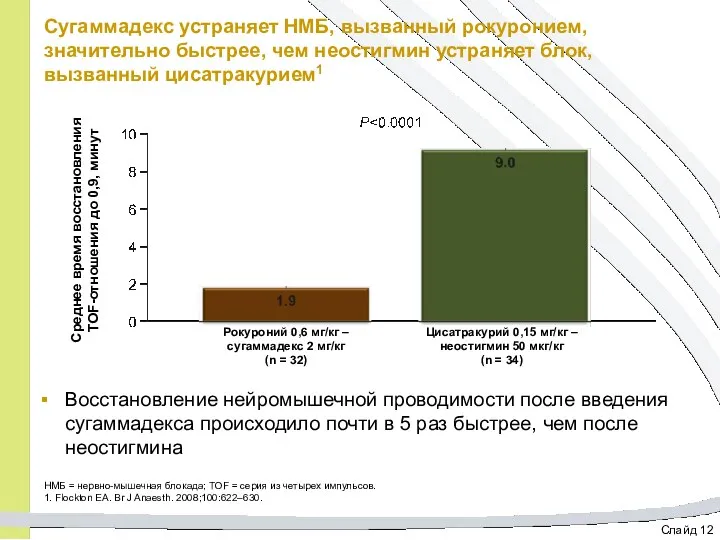
- 37. Слайд 12 Сугаммадекс устраняет НМБ, вызванный рокуронием, значительно быстрее, чем неостигмин устраняет блок, вызванный цисатракурием1 Восстановление
- 38. Слайд 1 Нервно-мышечный блок Модуль 4: Гемодинамическая стабильность
- 39. Слайд 2 Свойства идеального МР1 Недеполяризующий механизм действия Быстрое начало действия Короткая и управляемая клиническая продолжительность
- 40. Слайд 3 Сердечно-сосудистые эффекты миорелаксантов1,2 Блокада мускариновых рецепторов (м-холинорецепторов) Ганглиоблокирующее действие Усиление высвобождения норадреналина Блокада обратного
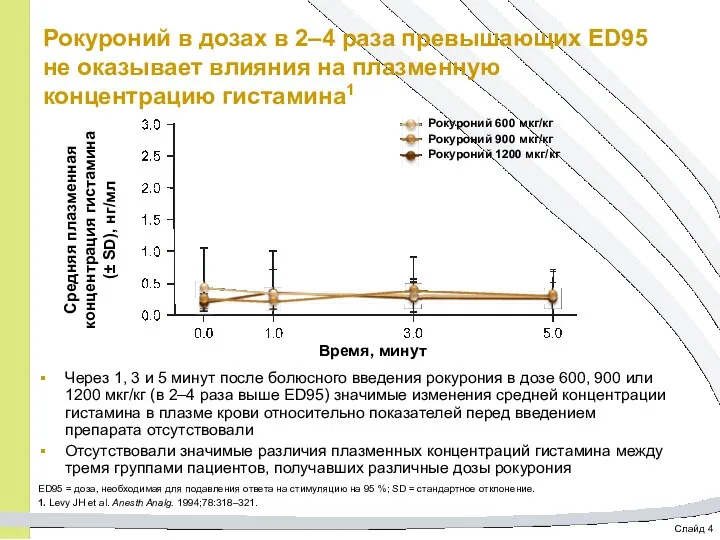
- 41. Слайд 4 Рокуроний в дозах в 2–4 раза превышающих ED95 не оказывает влияния на плазменную концентрацию
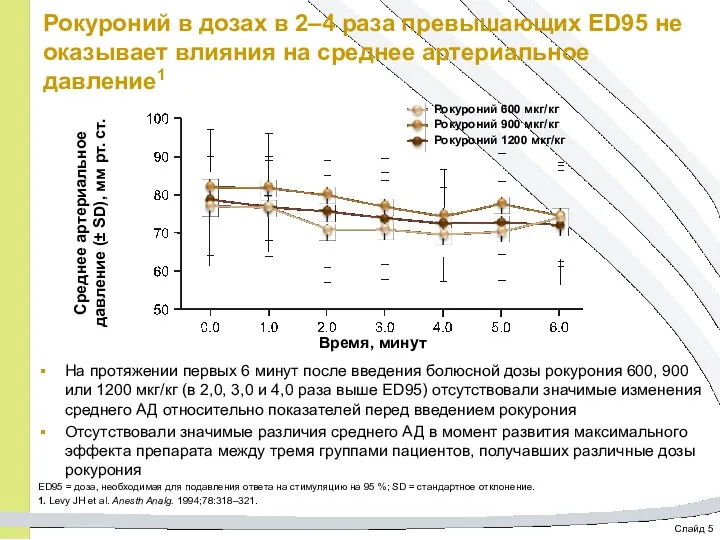
- 42. Слайд 5 Рокуроний в дозах в 2–4 раза превышающих ED95 не оказывает влияния на среднее артериальное
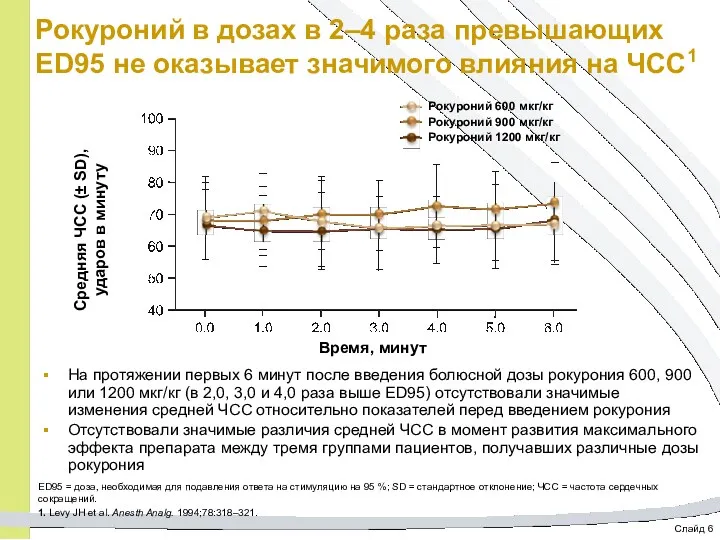
- 43. Слайд 6 Рокуроний в дозах в 2–4 раза превышающих ED95 не оказывает значимого влияния на ЧСС1
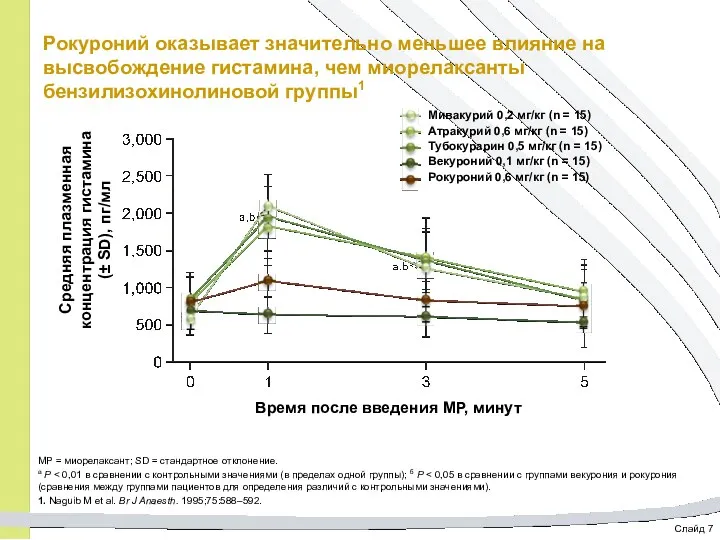
- 44. Слайд 7 Рокуроний оказывает значительно меньшее влияние на высвобождение гистамина, чем миорелаксанты бензилизохинолиновой группы1 МР =
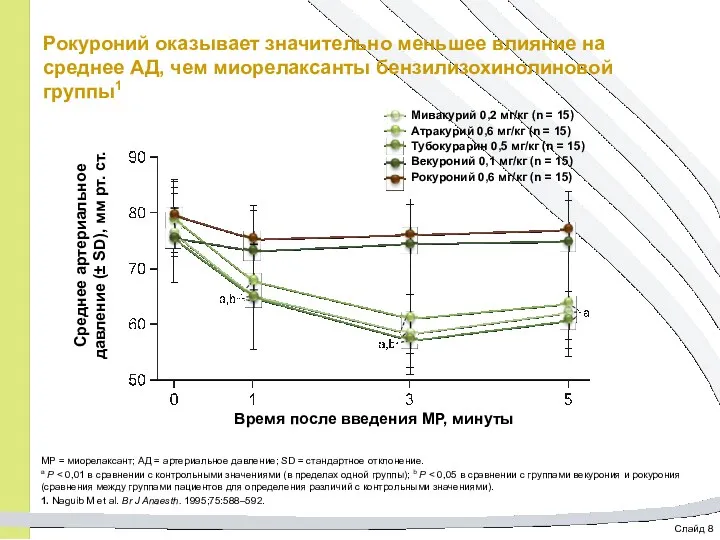
- 45. Слайд 8 Рокуроний оказывает значительно меньшее влияние на среднее АД, чем миорелаксанты бензилизохинолиновой группы1 МР =
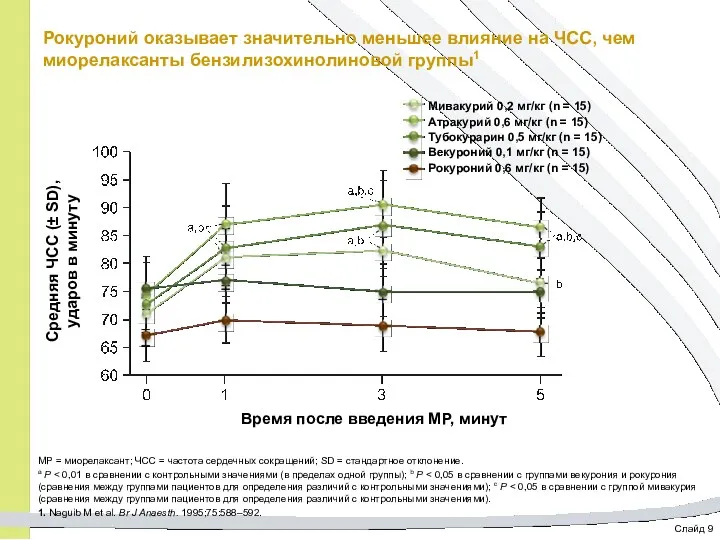
- 46. Слайд 9 Рокуроний оказывает значительно меньшее влияние на ЧСС, чем миорелаксанты бензилизохинолиновой группы1 МР = миорелаксант;
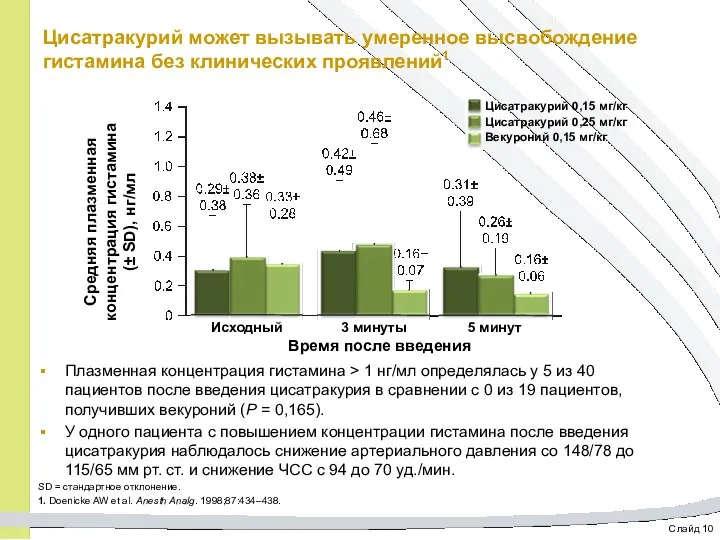
- 47. Слайд 10 Цисатракурий может вызывать умеренное высвобождение гистамина без клинических проявлений1 Плазменная концентрация гистамина > 1
- 48. Слайд 11 Заключение: гемодинамическая стабильность при использовании рокурония В исследованиях на пациентах, получавших рокуроний, было продемонстрировано:
- 49. Слайд 1 Нервно-мышечный блок Модуль 5: метаболизм миорелаксантов
- 50. Слайд 2 Свойства идеального МР1 Недеполяризующий механизм действия Быстрое начало действия Короткая и управляемая клиническая продолжительность
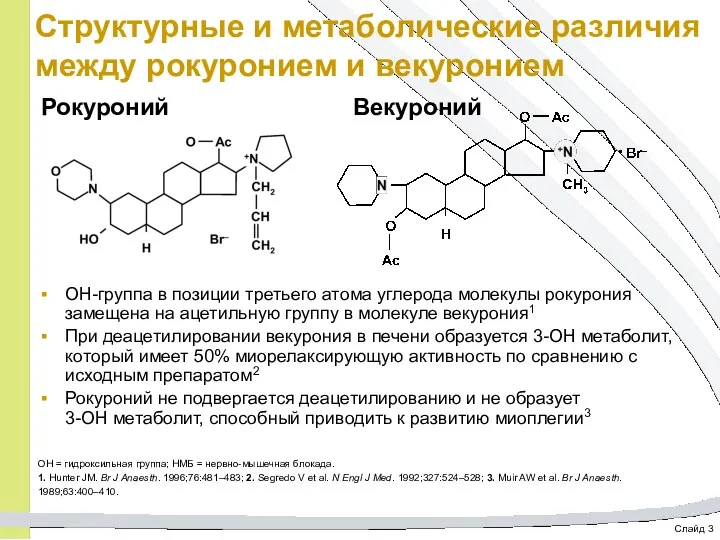
- 51. Слайд 3 Структурные и метаболические различия между рокуронием и векуронием OH-группа в позиции третьего атома углерода
- 52. Слайд 4 Метаболический профиль рокурония1 Выводится с мочой и желчью В течение 12–24 ч с мочой
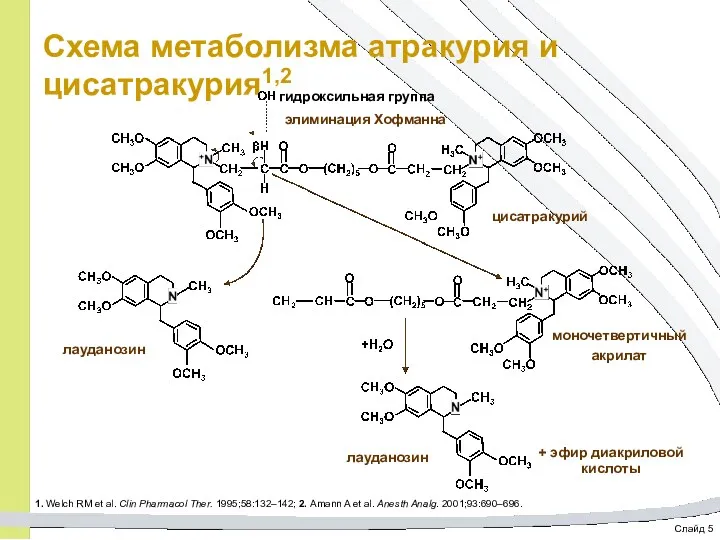
- 53. Слайд 5 Схема метаболизма атракурия и цисатракурия1,2 1. Welch RM et al. Clin Pharmacol Ther. 1995;58:132–142;
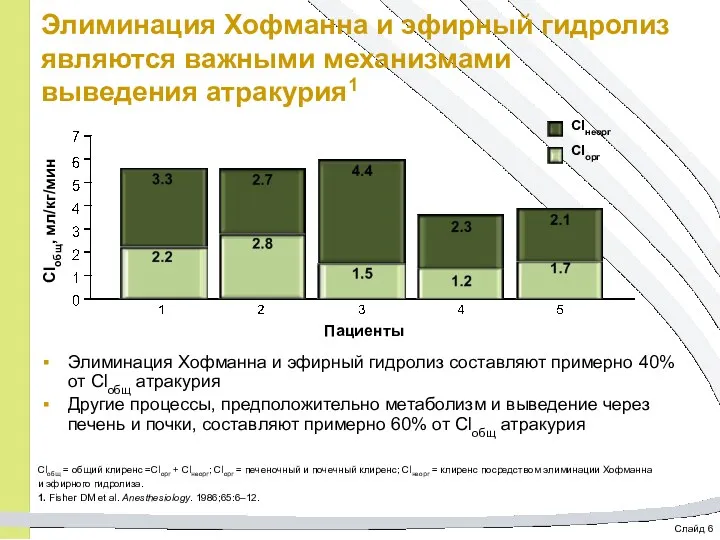
- 54. Слайд 6 Элиминация Хофманна и эфирный гидролиз являются важными механизмами выведения атракурия1 Элиминация Хофманна и эфирный
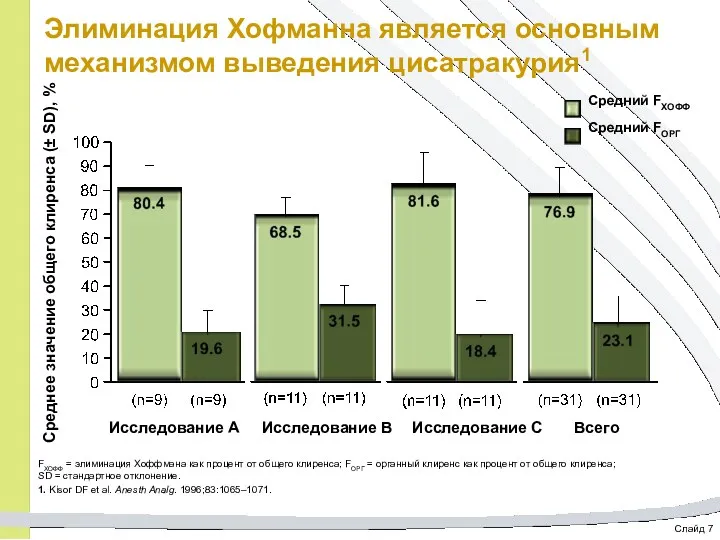
- 55. Слайд 7 Элиминация Хофманна является основным механизмом выведения цисатракурия1 FХОФФ = элиминация Хоффмана как процент от
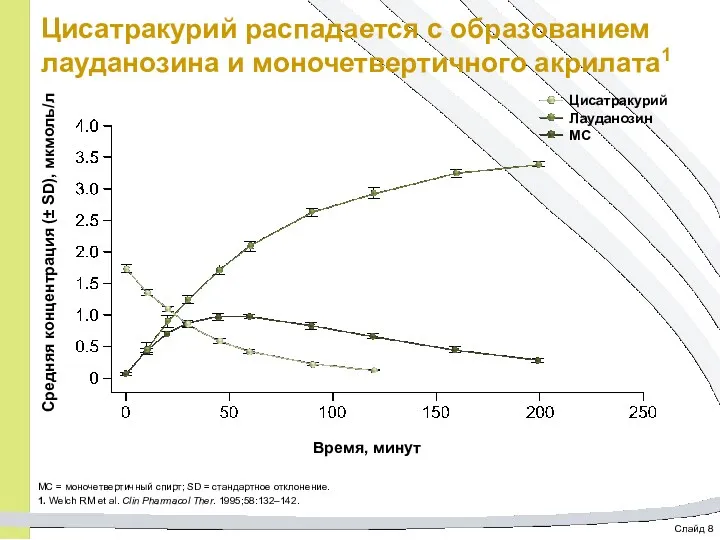
- 56. Слайд 8 Цисатракурий распадается с образованием лауданозина и моночетвертичного акрилата1 МС = моночетвертичный спирт; SD =
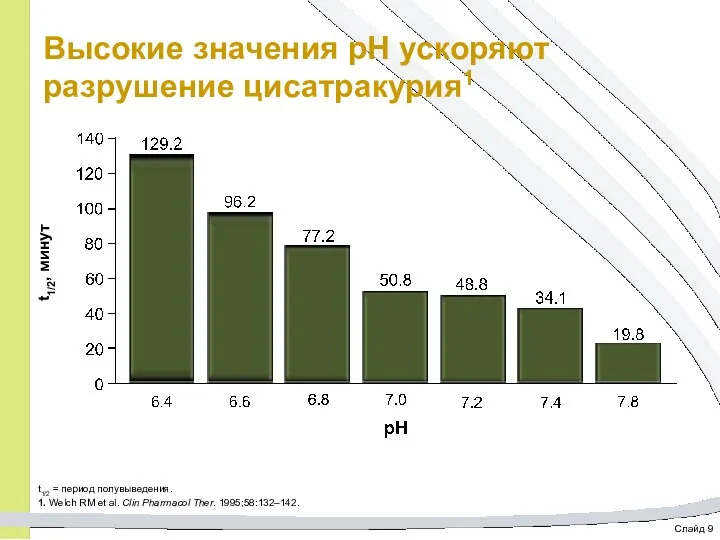
- 57. Слайд 9 Высокие значения pH ускоряют разрушение цисатракурия1 t1/2 = период полувыведения. 1. Welch RM et
- 58. Слайд 10 Преимущества и недостатки элиминации Хофманна Видимые преимущества Не зависящее от функций органов выведение миорелаксанта
- 59. Слайд 11 Рокуроний при почечной недостаточности и циррозе печени Почечная недостаточность и нарушение функции печени приводит
- 60. Слайд 1 Нервно-мышечный блок Модуль 6: преимущества интубации с применением миорелаксантов
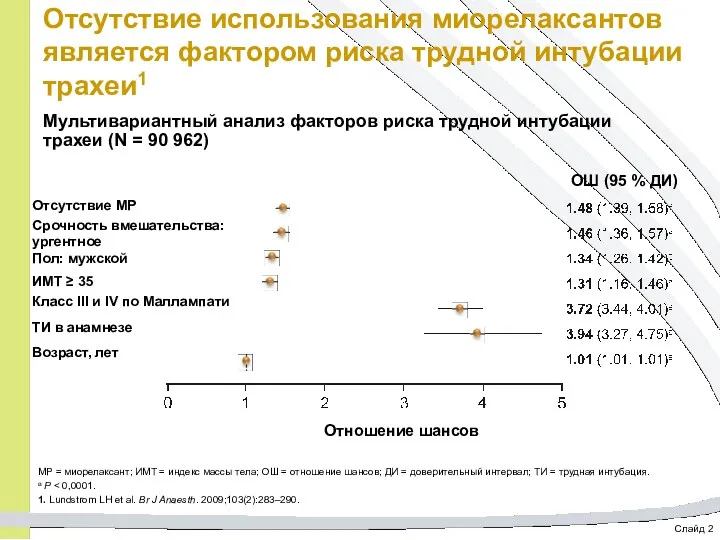
- 61. Слайд 2 Отсутствие использования миорелаксантов является фактором риска трудной интубации трахеи1 Мультивариантный анализ факторов риска трудной
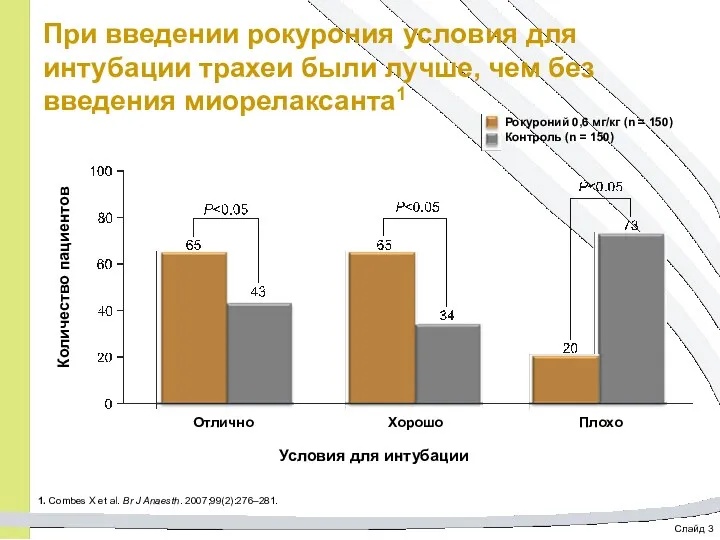
- 62. Слайд 3 При введении рокурония условия для интубации трахеи были лучше, чем без введения миорелаксанта1 1.
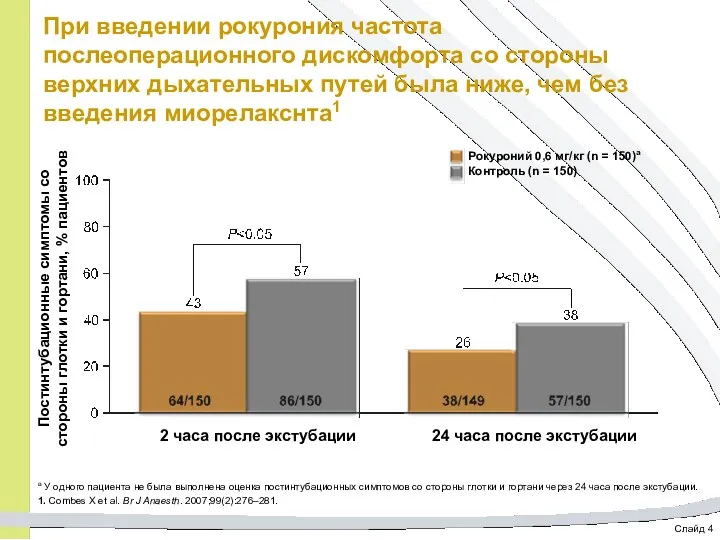
- 63. Слайд 4 При введении рокурония частота послеоперационного дискомфорта со стороны верхних дыхательных путей была ниже, чем
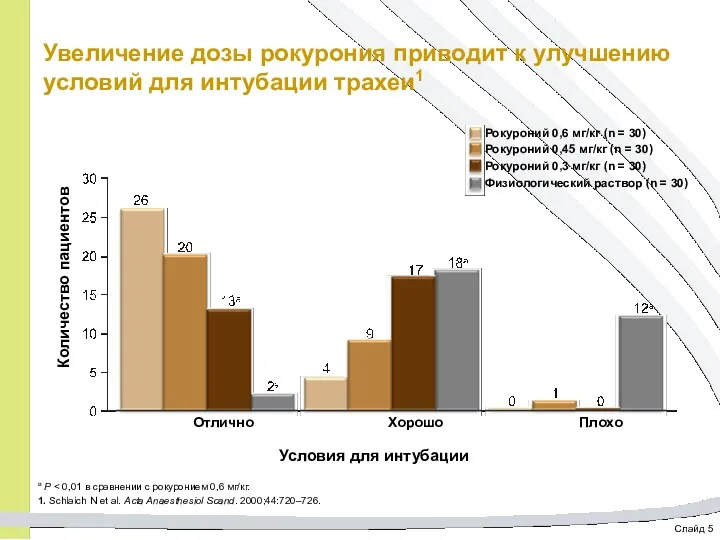
- 64. Слайд 5 Увеличение дозы рокурония приводит к улучшению условий для интубации трахеи1 Рокуроний 0,6 мг/кг (n
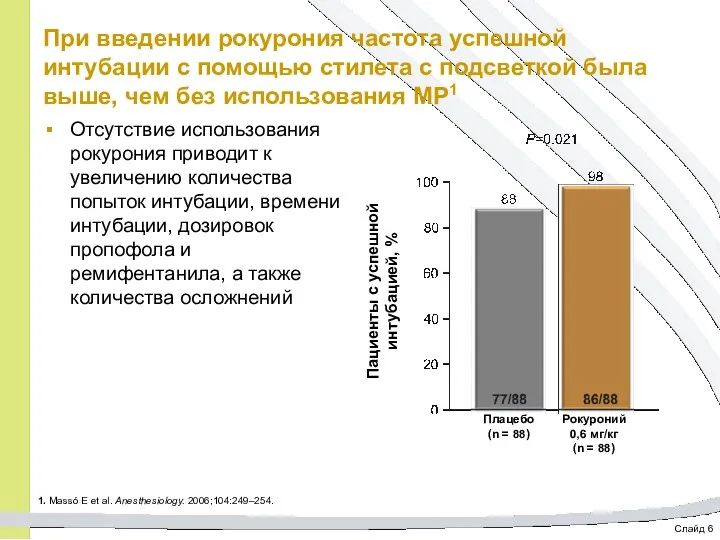
- 65. Слайд 6 При введении рокурония частота успешной интубации с помощью стилета с подсветкой была выше, чем
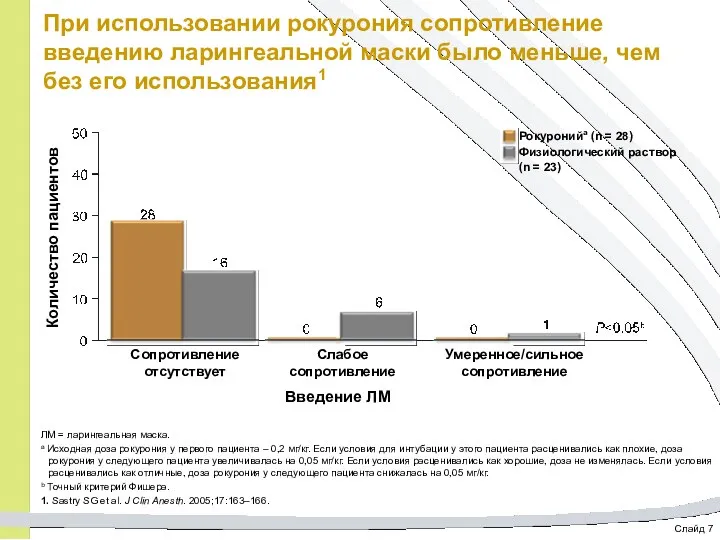
- 66. Слайд 7 При использовании рокурония сопротивление введению ларингеальной маски было меньше, чем без его использования1 Рокуронийа
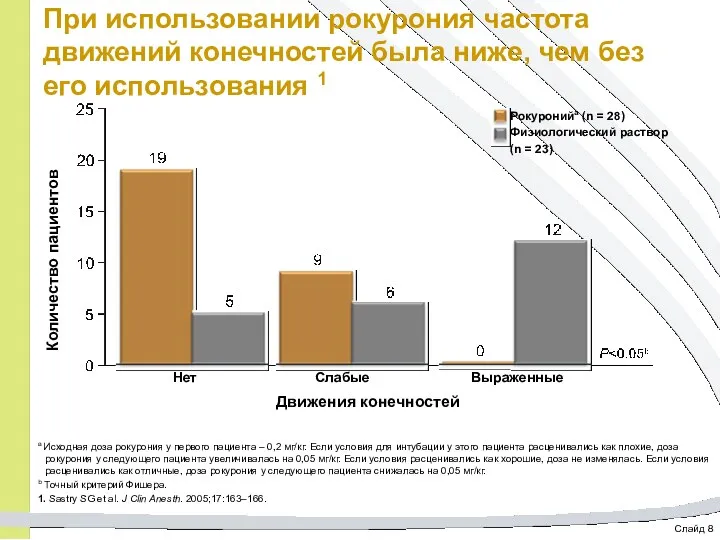
- 67. Слайд 8 При использовании рокурония частота движений конечностей была ниже, чем без его использования 1 a
- 68. Side Нервно-мышечный блок Модуль 7: обзор миорелаксантов
- 69. Side Классы миорелаксантов Деполяризующие МР1 Аналогично ацетилхолину связываются с α субъединицей постсинаптических никотиновых рецепторов Единственным доступным
- 70. Side Сукцинилхолин Выпущен в 1952 году1 Является единственным доступным в настоящее время деполяризующим МР2 Преимущества: быстрое
- 71. Side Недеполяризующие МР: бензилизохинолины Четвертичные соединения аммония имеющие не менее одного положительно заряженного атома азота, позволяющего
- 72. Side Атракурий Бензилизохинолиновый МР средней продолжительности действия, впервые вышедший в 1982 году1,2 Преимущества Огран-независимая элиминация Хофманна
- 73. Side Цисатракурий Бензилизохинолиновый МР со средней скоростью наступления эффекта и средней продолжительностью действия, впервые выпущенный в
- 74. Side Мивакурий Бензилизохинолиновый МР, впервые вышедший для клинического использования в 1990х годах1,2 Первый недеполяризующий МР короткого
- 75. Side Недеполяризующие МР: аминостероиды Четвертичные соединения аммония, имеющие не менее одного положительно заряженного атома азота для
- 76. Side Панкуроний Аминостероидный МР, впервые выпущенный в 1967 году1,2 Преимущества Слабый индуктор высвобождения гистамина1,2 Недостатки1,2 Медленное
- 77. Side Векуроний Аминостероидный МР средней продолжительности действия, впервые выпущенный в начале 1980-х годов1,2 Преимущества Длительность клинического
- 78. Side Пипекуроний Аминостероидный МР длительного действия, впервые вышедший в начале 1990-х годов1 Преимущества Подходит для продолжительных
- 79. Side Рокуроний - идеальный миорелаксант Аминостероидный миорелаксант с быстрым наступлением эффекта и средней продолжительностью действия, впервые
- 80. Side Преимущества и недостатки различных миорелаксантов МР = миорелаксант; Сук = сукцинилхолин; Атр= атракурий; Цис =
- 81. Краткая информация о препарате ЭСМЕРОН® Терапевтический класс Эсмерон® (рокурония бромид) - быстродействующий, недеполяризующий миорелаксант средней продолжительности
- 82. Способ применения и дозы Эсмерон® вводится внутривенно как в виде болюсной инъекции, так и в виде
- 83. Поддерживающая доза Рекомендуемая поддерживающая доза составляет 0,15 мг/кг рокурония бромида; в случае длительного ингаляционного наркоза ее
- 84. Применение препарата в педиатрической практике . Для детей с 1 месяца рекомендуемая доза для интубации при
- 85. Применение у пациентов пожилого возраста, у пациентов с нарушением функции печени и/или заболеванием желчевыводящих путей и/или
- 86. Интенсивная терапия Интубация трахеи Дозы аналогичны таковым при хирургических вмешательствах. Поддерживающая доза Рекомендуется начинать с дозы
- 87. Некоторая информация о безопасности препарата ЭСМЕРОН™ Противопоказания - Повышенная чувствительность к рокуронию или к бромид-иону или
- 88. Как и при применении других миорелаксантов, были отмечены случаи развития остаточного блока и после использования препарата
- 89. После длительного введения миорелаксантов пациентам, находящимся в отделении интенсивной терапии, может отмечаться развитие пролонгированного нервно-мышечного блока
- 90. Состояния, которые могут усиливать эффект ЭСМЕРОНа: гипокалиемия (например, после продолжительной рвоты, диареи или терапии диуретиками), гипермагниемия,
- 91. Кормление грудью. В настоящее время остается неизвестным, выводится ли препарат Эсмерон® у человека с грудным молоком.
- 92. Снижение эффекта: Предшествующее длительное введение фенитоина или карбамазепина; Ингибиторы протеаз (габексат, улинастатин); Изменение эффекта: Введение других
- 93. Очень редко, но все-таки сообщается о возникновении тяжёлых анафилактических реакций в результате применения миорелаксантов, включая Эсмерон®.
- 94. Другие В случае передозировки и пролонгирования нервно-мышечного блока, пациентам следует продолжать проведение искусственной вентиляции легких и
- 96. Скачать презентацию
























































 МРТ в гинекологии
МРТ в гинекологии Общие анестетики
Общие анестетики Нейропсихология. Клиническая нейропсихология
Нейропсихология. Клиническая нейропсихология Ожоги. Виды ожогов
Ожоги. Виды ожогов Носовые кровотечения
Носовые кровотечения Медицина эпохи античности
Медицина эпохи античности Абдоминальный синдром при язвенной болезни желудка и двенадцатиперстной кишки и ее осложнениях
Абдоминальный синдром при язвенной болезни желудка и двенадцатиперстной кишки и ее осложнениях Диагностика и лечение рака молочной железы во время беременности
Диагностика и лечение рака молочной железы во время беременности Искусственное кровообращение
Искусственное кровообращение СП при энтеритах
СП при энтеритах Гигиена труда медицинских работников
Гигиена труда медицинских работников Вимоги та методи контролю якості плазми людини для фракціонування відповідно до ДФУ та PhE
Вимоги та методи контролю якості плазми людини для фракціонування відповідно до ДФУ та PhE Мамандыққа кіріспе. Стоматологиялық ауруларды алдын алу. Стоматологиялық ауруларының эпидемиологиясы
Мамандыққа кіріспе. Стоматологиялық ауруларды алдын алу. Стоматологиялық ауруларының эпидемиологиясы Поздний гестоз
Поздний гестоз Жүректің ишемиялық ауруы
Жүректің ишемиялық ауруы Микобактерии. Возбудители туберкулеза
Микобактерии. Возбудители туберкулеза Современные методы изготовления виниров
Современные методы изготовления виниров Бас сақинасы (мигрень)
Бас сақинасы (мигрень) Болезнь Альцгеймера
Болезнь Альцгеймера Хирургия вентральных грыж
Хирургия вентральных грыж Эпидемический процесс
Эпидемический процесс Травматические повреждения
Травматические повреждения Peptic Ulcer Disease Complications
Peptic Ulcer Disease Complications Қазақстан халқының әл-ауқатын арттыру – мемлекеттік саясаттың басты мақсаты
Қазақстан халқының әл-ауқатын арттыру – мемлекеттік саясаттың басты мақсаты Введение в общую и частную хирургию. Травматизм животных
Введение в общую и частную хирургию. Травматизм животных Строение паренхиматозных органов
Строение паренхиматозных органов Амбулаторно-поликлинический этап реабилитационного процесса больных
Амбулаторно-поликлинический этап реабилитационного процесса больных Инфекции, передающиеся половым путем
Инфекции, передающиеся половым путем