Содержание
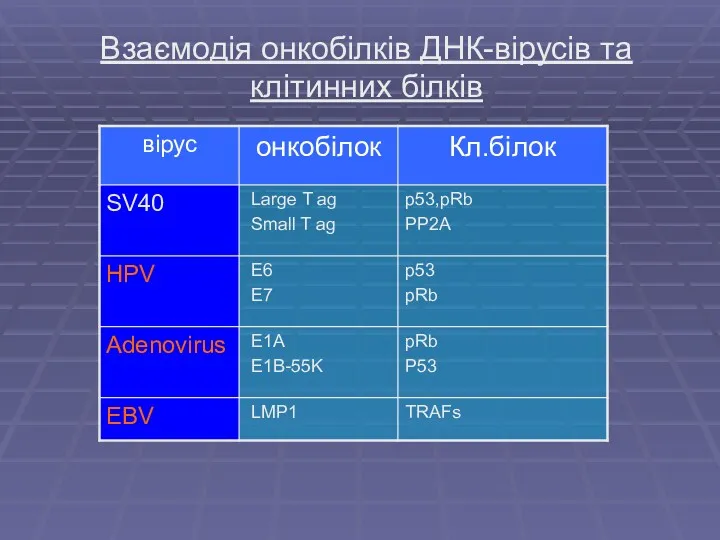
- 2. Взаємодія онкобілків ДНК-вірусів та клітинних білків
- 3. гени-супресори наслідки при порушенні гені гени функція спадкові спорадичні DCC (18q) взаємодія невідомі рак прямой з
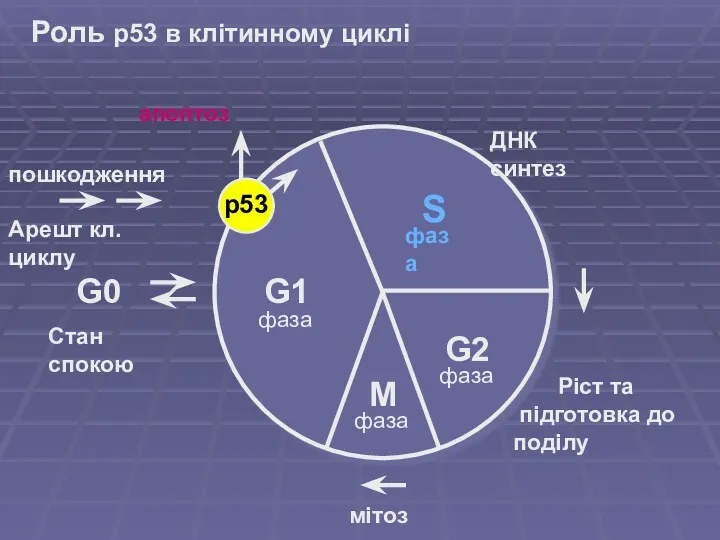
- 4. Роль p53 в клітинному циклі G1 S G2 M G0 ДНК синтез Ріст та підготовка до
- 5. p53 “охоронець геному” в зародкових клітинах мутації р53 призводять до синдрому Li-Fraumeni p53 мутації часто утворюються
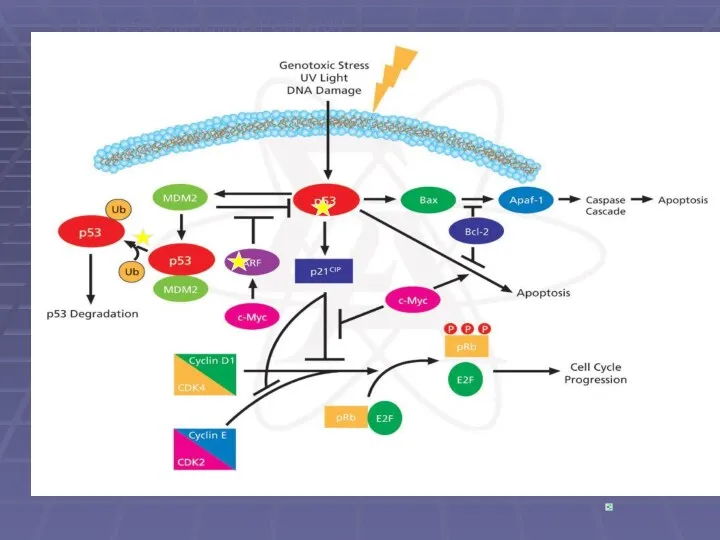
- 6. The p53 Signaling Pathway SIGMA-ALDRICH
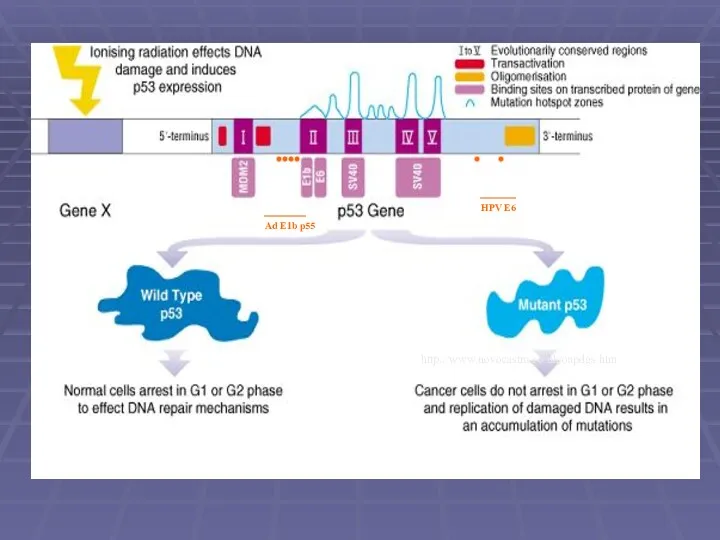
- 7. Functional Domains of p53 MDM2 EMBO J (99)18:1661 http://www.novocastra.co.uk/oapdgs.htm HPV E6 Ad E1b p55
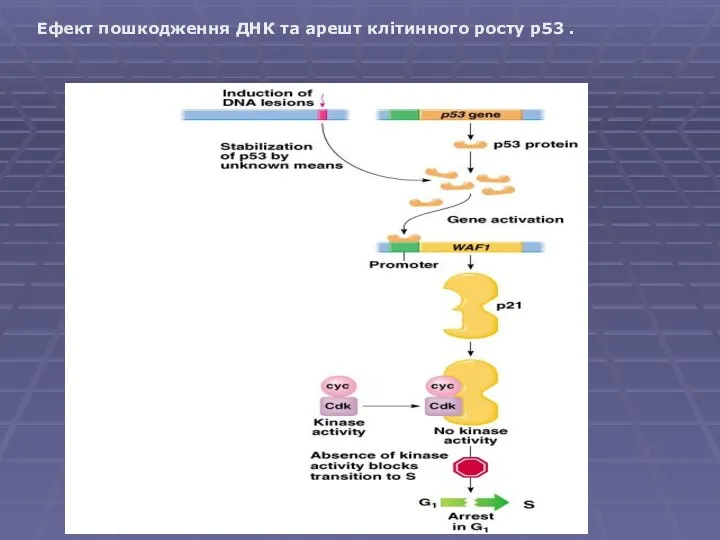
- 8. Ефект пошкодження ДНК та арешт клітинного росту p53 .
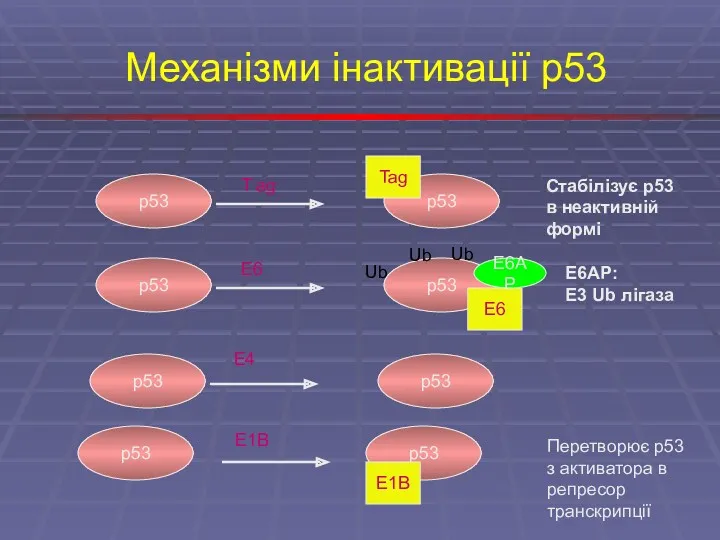
- 9. Механізми інактивації p53 p53 T ag p53 Tag Стабілізує p53 в неактивній формі p53 E6 p53
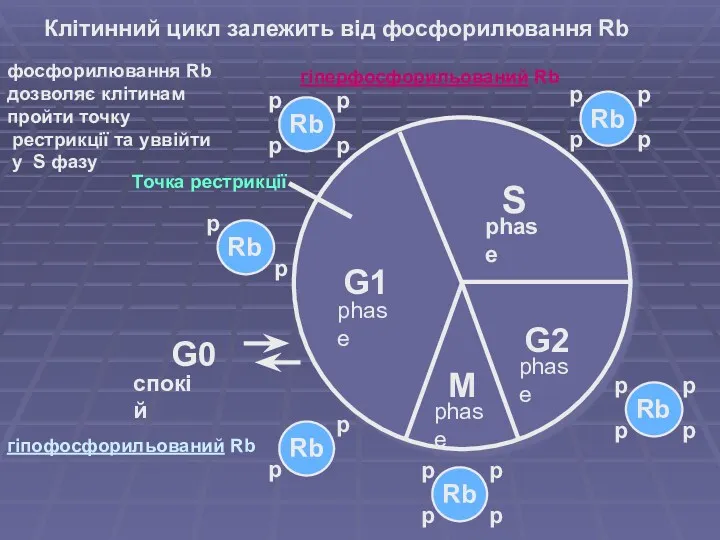
- 10. Клітинний цикл залежить від фосфорилювання Rb G1 S G2 M G0 спокій phase phase phase phase
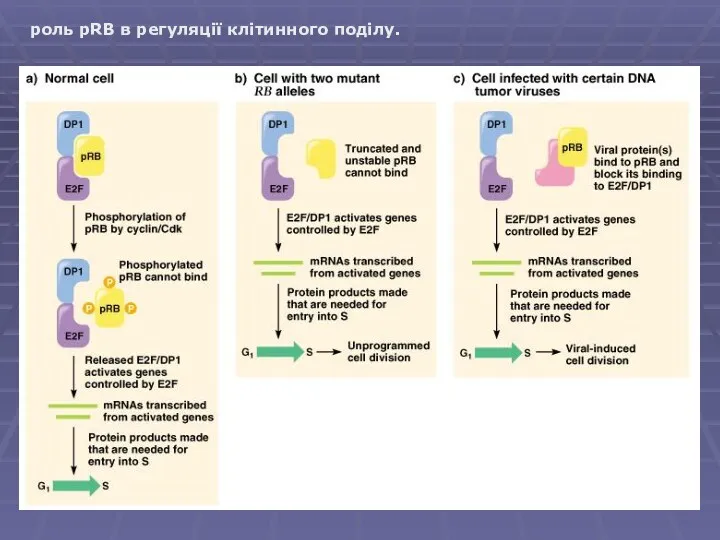
- 11. роль pRB в регуляції клітинного поділу.
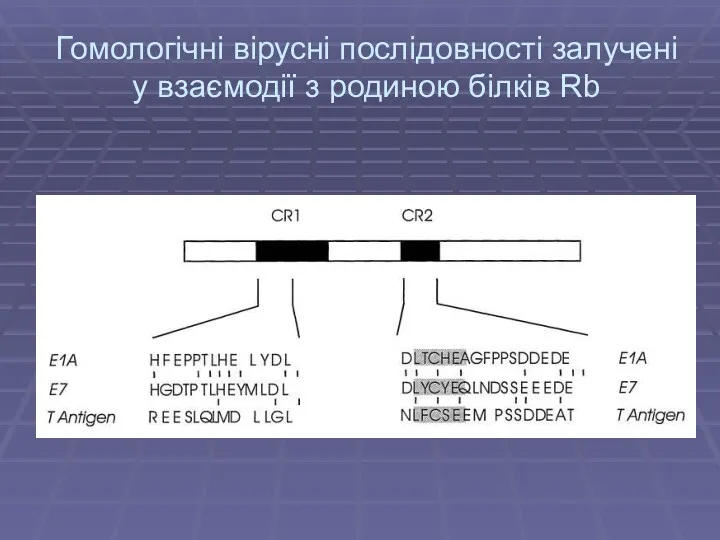
- 12. Гомологічні вірусні послідовності залучені у взаємодії з родиною білків Rb
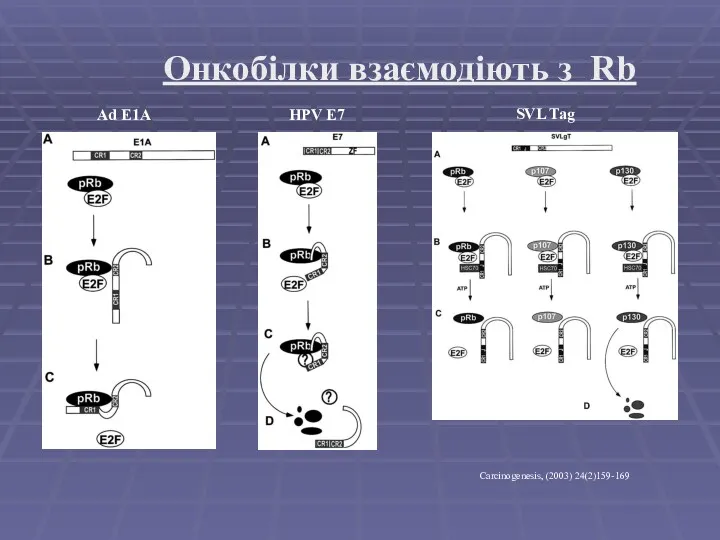
- 13. Онкобілки взаємодіють з Rb Ad E1A HPV E7 SVL Tag Carcinogenesis, (2003) 24(2)159-169
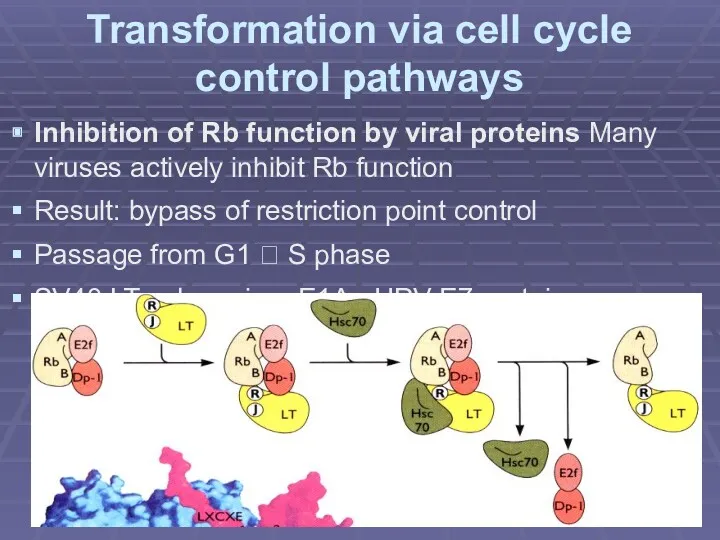
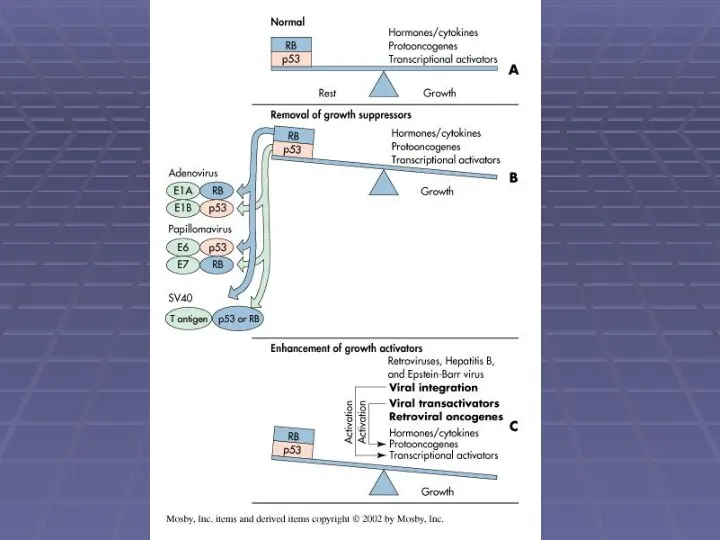
- 14. Transformation via cell cycle control pathways Inhibition of Rb function by viral proteins Many viruses actively
- 15. Апоптоз - (гр."falling"), притаманний багатоклітинному організму процес, за допомогою якого специфічні клітини знищують та очищають організм
- 16. Біологічна суть апоптозу підтримка тканинного гомеостазу шляхом знищення надлишкових\ функціонально аномальних клітин, а його інгібування –
- 18. Процес апоптозу умовно розділяють на: сигнальну фазу, під час якої клітина отримує сигнал, що ініціює апоптоз;
- 19. Шляхи апоптозу: ефектори та модулятори Існує два основних шляху апоптозу в клітинах ссавців “Зовнішній” через «домен
- 21. Рецептори клітинної загибелі Fas-peцептор (Fas-R), TNF-R1, TNF-R2, "рецептор смерті-3" (DR-3 та 4 ) Найкраще вивчені Fas-R
- 22. Шляхи апоптозу: ефектори та модулятори Експресію Fas-R на мембрані клітин індукують прозапальні цитокіни ІЛ-1, -2, -6,
- 23. Розвиток апоптозу може бути заблоковано активацією ряду факторів I-FLICE (ендогенна домінантно-негативна форма каспази 8), bcl-2 та
- 24. Апоптоз, індукованний через TNF-α + TNF-R1, подібний Fas-R - Fas-L, та потребує олігомерізації рецептору та здійснюється
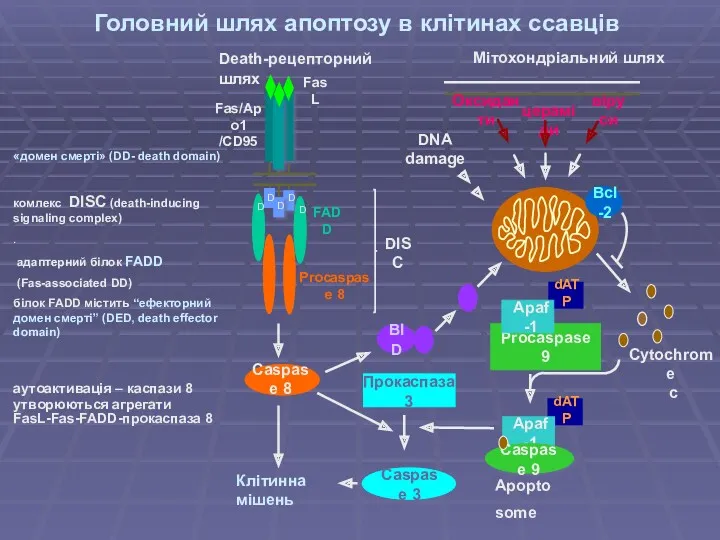
- 25. Головний шлях апоптозу в клітинах ссавців «домен смерті» (DD- death domain) комлекс DISC (death-inducing signaling complex)
- 26. Bcl-2 прото-онкоген вперше був описаний при B-клітинній лімфомі Bcl 2 родина білків (17 представників) – модулятори
- 27. Регуляторна дія білків цієї родини здійснюється різними механізмами - утворення гомо- та гетеро-димерів за допомогою наявності
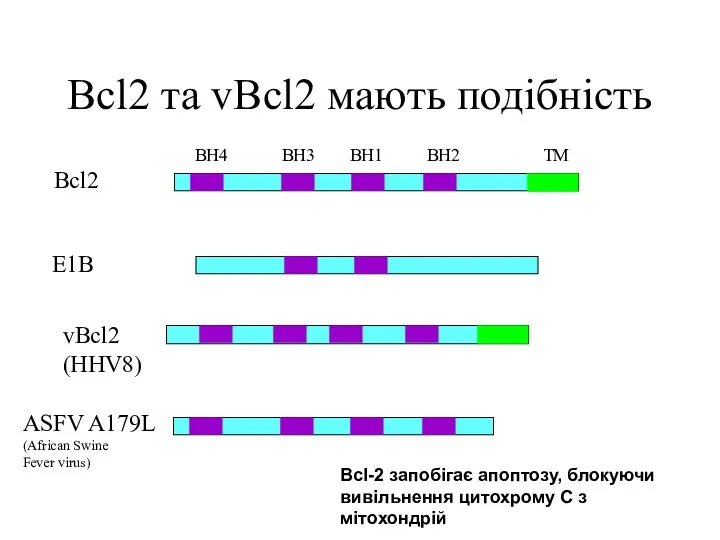
- 28. Bcl2 та vBcl2 мають подібність Bcl2 E1B vBcl2 (HHV8) ASFV A179L (African Swine Fever virus) BH4
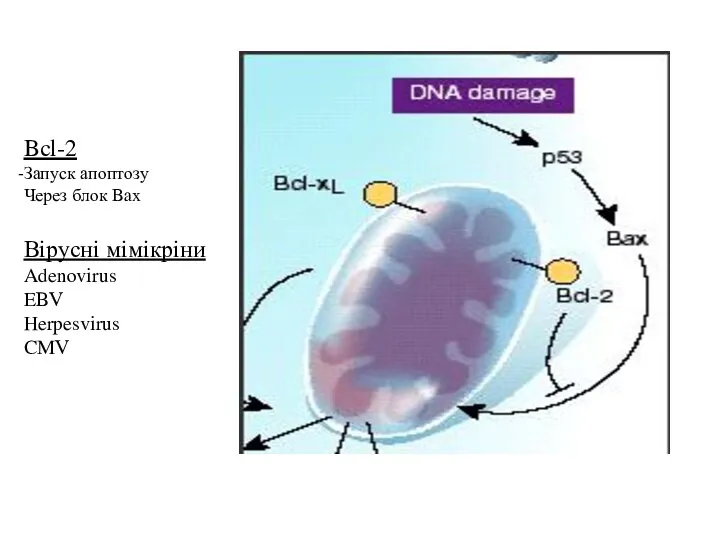
- 29. Bcl-2 Запуск апоптозу Через блок Bax Вірусні мімікріни Adenovirus EBV Herpesvirus CMV
- 30. Copyright ©2002 by the National Academy of Sciences Huang, Qiulong et al. (2002) Proc. Natl. Acad.
- 31. В результаті активації апоптичного сигналу, проапоптичні білки сприяють відкриттю мітохондріальних каналів і виходу цитохрому С (вихід
- 32. Р53 та апоптоз При значних пошкодженнях ДНК активується експресія про - апоптичних генів Вах, Fas, DR5
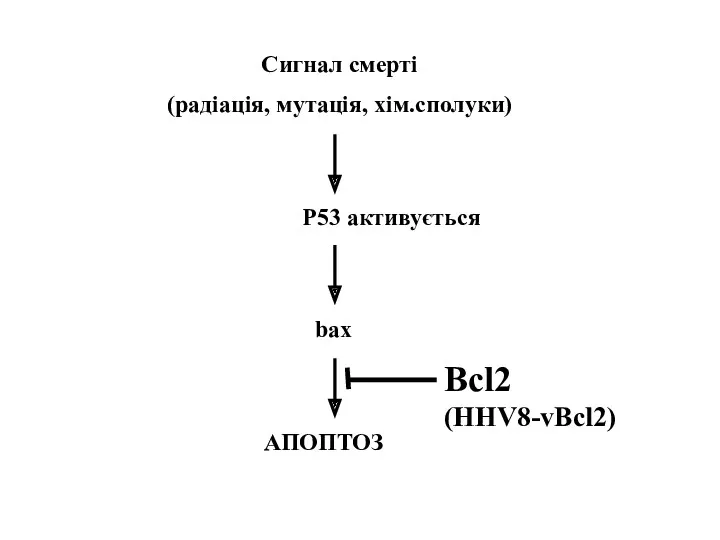
- 33. Сигнал смерті (радіація, мутація, хім.сполуки) P53 активується bax АПОПТОЗ Bcl2 (HHV8-vBcl2)
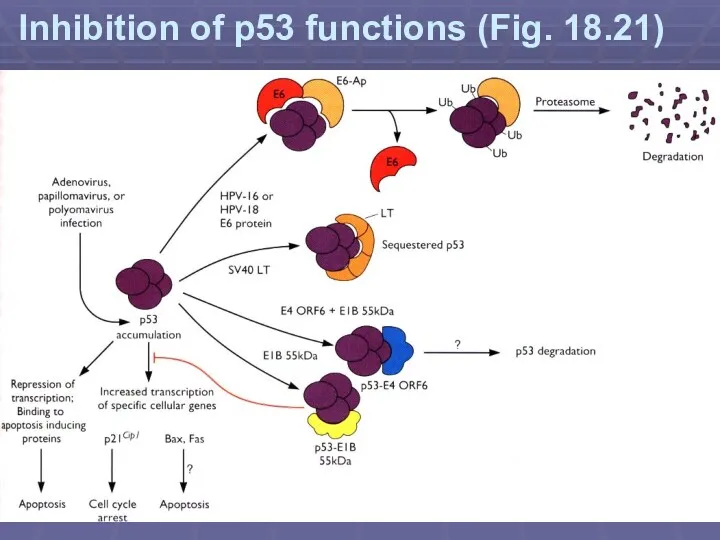
- 34. Inhibition of p53 functions (Fig. 18.21)
- 35. Hanahan та Weinberg запропонували, що нормальна клітина повинна отримати 6 фенотипових ознак для становлення злоякісності. Одна
- 37. Віруси та апоптоз Блокування вірусними білками апоптичного сигналу і передачу його всередину клітини ( аденовірусні E1B
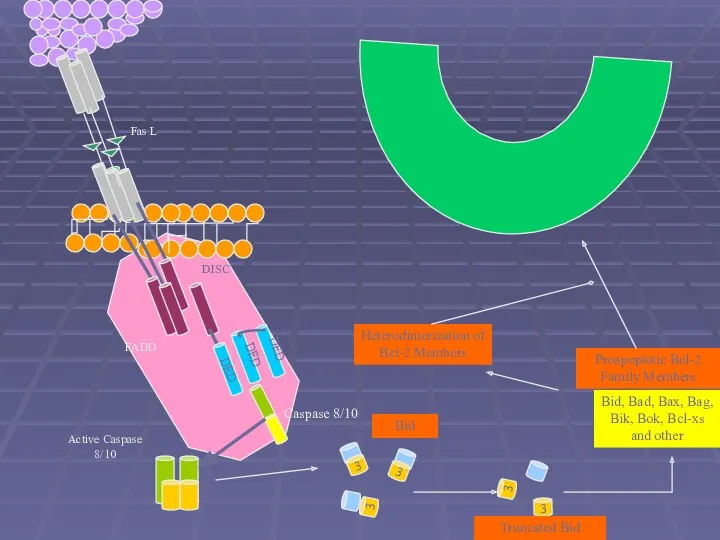
- 39. Fas L DISC FADD DED DED DED Caspase 8/10 3 3 3 Bid 3 3 Truncated
- 41. Скачать презентацию



















 Вибрационная болезнь
Вибрационная болезнь Диагностика бронхиальной астмы
Диагностика бронхиальной астмы Маскүнемдік, уытқорлық, шылым шегудің патофизиологиялық негіздері
Маскүнемдік, уытқорлық, шылым шегудің патофизиологиялық негіздері Доброкачественные и злокачественные опухоли почек
Доброкачественные и злокачественные опухоли почек Репродуктивное здоровье населения России
Репродуктивное здоровье населения России Гипертоническая болезнь сердца
Гипертоническая болезнь сердца Шизофрения, шизотипическое и бредовые расстройства
Шизофрения, шизотипическое и бредовые расстройства 10 фактов о физической активности. Физическая активность и настроение. Выбор видов физических нагрузок в пожилом возрасте
10 фактов о физической активности. Физическая активность и настроение. Выбор видов физических нагрузок в пожилом возрасте Equipment and instruments of dental clinic
Equipment and instruments of dental clinic Әскери медицина туралы түсінік. Медицина қызметін ұйымдастыру және тактикасы, ғылыми тұрғыда және пән ретінде оқып үйрену
Әскери медицина туралы түсінік. Медицина қызметін ұйымдастыру және тактикасы, ғылыми тұрғыда және пән ретінде оқып үйрену Здоровье населения, факторы, влияющие на здоровье населения. Формула здоровья
Здоровье населения, факторы, влияющие на здоровье населения. Формула здоровья Алгоритм ранней диагностики злокачественных новообразований на уровне ПМСП
Алгоритм ранней диагностики злокачественных новообразований на уровне ПМСП Противотуберкулезные средства
Противотуберкулезные средства Функциональная морфология пищеварительной и дыхательной систем человека. (Лекция 2)
Функциональная морфология пищеварительной и дыхательной систем человека. (Лекция 2) Чувствительность и её нарушения
Чувствительность и её нарушения Произвольные движения и действия (праксис). Нарушения и исследование праксиса
Произвольные движения и действия (праксис). Нарушения и исследование праксиса Первая помощь при кровотечениях
Первая помощь при кровотечениях Функциональная морфология сердца. (Лекция 5)
Функциональная морфология сердца. (Лекция 5) Нейропсихология. Мозговая организация речи. (Лекция 9)
Нейропсихология. Мозговая организация речи. (Лекция 9) Клещевой энцефалит в Республике Башкортостан (11 класс)
Клещевой энцефалит в Республике Башкортостан (11 класс)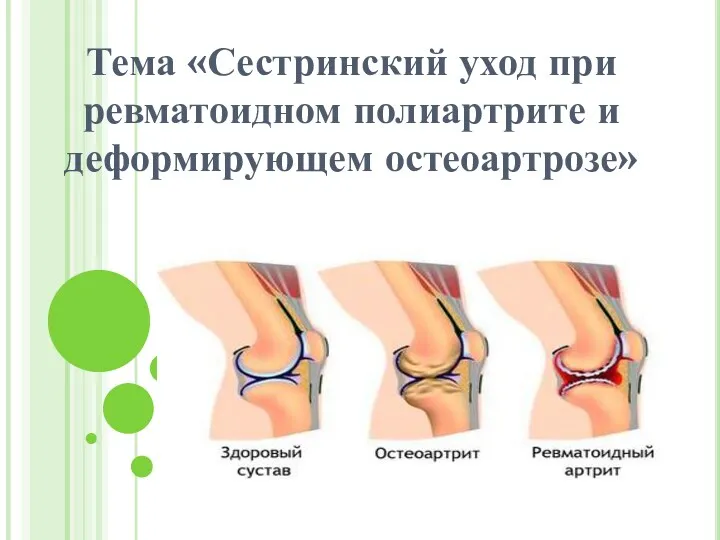 Сестринский уход при ревматоидном полиартрите и деформирующем остеоартрозе
Сестринский уход при ревматоидном полиартрите и деформирующем остеоартрозе Первая медицинская помощь при термической травме
Первая медицинская помощь при термической травме Менингококковая инфекция
Менингококковая инфекция Захворювання серцево-судинної системи та їх профілактика
Захворювання серцево-судинної системи та їх профілактика Медицинские отходы
Медицинские отходы Лейкозы, лейкоцитозы, лейкопении
Лейкозы, лейкоцитозы, лейкопении Оценка сердечного ритма у больных с хроническим гастритом
Оценка сердечного ритма у больных с хроническим гастритом Медико-социальная концепция Продление рода. Клиника мужского здоровья
Медико-социальная концепция Продление рода. Клиника мужского здоровья