Организация лабораторной службы в системе здравоохранения. Клиническая лабораторная диагностика презентация
Содержание
- 2. СПЕЦИАЛЬНОСТЬ «КЛИНИЧЕСКАЯ ЛАБОРАТОРНАЯ ДИАГНОСТИКА»
- 3. Возникновение специальности Приказом Минздравмедпрома РФ от 16 февраля 1995 года N 33 «Об утверждении положения об
- 4. Получение специальности «Клиническая лабораторная диагностика» Специальность «Клиническая лабораторная диагностика» является основной специальностью, которую могут получить лица
- 5. Кадровая основа Клинической лабораторной диагностики Положение о порядке допуска к осуществлению профессиональной медицинской и фармацевтической деятельности
- 6. Сертификат Сертификат специалиста по специальности «Клиническая лабораторная диагностика» и др. при устройстве на работу Биологу /врачу-лаборанту
- 7. Профессиональная переподготовка биологов Проведение профессиональной переподготовки для биологов противоречит пункту 8 приказа № 66н «Об утверждении
- 8. Квалификационные характеристики должностей в области лабораторной медицины Заведующий лабораторией 5 лет стажа, сертификат, 1 раз в
- 9. Непрерывное медицинское образование
- 10. Профессиональный стандарт Профессиональный стандарт - характеристика квалификации, необходимой работнику для осуществления определенного вида профессиональной деятельности (ФЗ-236,
- 11. Профессиональный стандарт Профессиональный стандарт врача-биохимика – утвержден в 2017 году Профессиональный стандарт специалиста в области КЛД
- 12. Непрерывное медицинское образование
- 13. Непрерывное медицинское образование
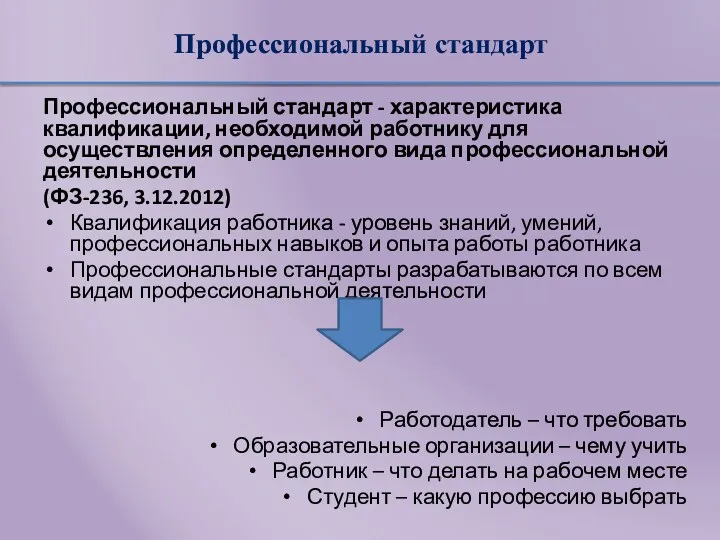
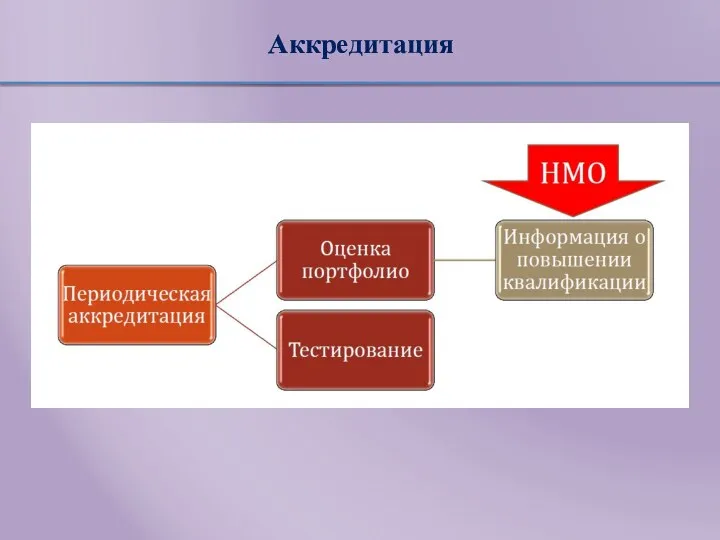
- 14. Аккредитация Приказ МЗ РФ№334н от 2 июня 2016 «Об утверждении положения об аккредитации специалистов» Аккредитация специалиста
- 15. Сроки и этапы аккредитации Приказ МЗ РФ № 1043н от 22 декабря 2017 «Об утверждении сроков
- 16. Аккредитация
- 17. Должностные обязанности врача КЛД Согласно приказа МЗСР РФ от 23.07.2010 г. № 541н… проводит лабораторные исследования
- 18. Врач КЛД должен знать Согласно приказа МЗСР РФ от 23.07.2010 г. № 541н… законы РФ в
- 19. Положение о враче КЛД Согласно приказа МЗ РФ от 25.12.1997 г. № 380… На должность врача
- 20. Должностные обязанности медицинского технолога Согласно приказа от 23.07.2010 № 541н… Проводит самостоятельно сложные исследования с использованием
- 21. Медицинский технолог должен знать Согласно приказа МЗСР РФ от 23.07.2010 г. № 541н… Основы лабораторной диагностики
- 22. Должностные обязанности лаборанта Согласно приказа от 23.07.2010 № 541н… Должностные обязанности: Проводит лабораторные исследования под руководством
- 23. Общее усовершенствование 1 раз в 5 лет или чаще на усмотрение руководителя Обучение ЗА СЧЁТ СРЕДСТВ
- 24. Квалификационные категории Приказ МЗ РФ от 23.04.2013г. № 240н «О порядке и сроках прохождения медицинскими работниками
- 25. Квалификационные категории По представлению администрации учреждения здравоохранения, контролирующих органов здравоохранения, аттестационная комиссия имеет право в установленном
- 26. Квалификационные категории Матерям, находящимся в отпуске по уходу за ребенком, сохраняется стаж работы по специальности. Сохраняется
- 27. Квалификационные категории Квалификация специалиста определяется по трем квалификационным категориям: Вторая квалификационная категория - стаж работы по
- 28. Требования к отчету специалиста Приказ МЗ РФ от 23.04.2013г. № 240н «О порядке и сроках прохождения
- 29. Требования к отчету специалиста 2.2 Практические навыки и умения. Обязательно отразить: соответствие объема теоретических знаний, фактически
- 30. Требования к отчету специалиста 2.6.1. Личное участие в проведении внутрилабораторного контроля качества, указать конкретно какие контрольные
- 31. Требования к отчету специалиста Документы, составляющие квалификационную документацию, должны быть аккуратно оформлены и сброшюрованы. Порядок расположения
- 32. Этапы оценки квалификации специалиста Отчет и его рецензирование (согласованный с руководителем и заверенный печатью организации) Обязательный
- 33. Медицинский стаж Постановление Правительства РФ от 29 октября 2002 г. N 781 «Список должностей и учреждений,
- 34. Штатное расписание Приказ Минздрава СССР от 26.09.1978 № 900 «О штатных нормативах медицинского, фармацевтического персонала и
- 35. Штатное расписание Приказ Минздрава СССР от 26.09.1978 № 900 «О штатных нормативах медицинского, фармацевтического персонала и
- 36. Штатное расписание Приказ Минздрава СССР от 26.09.1978 № 900 «О штатных нормативах медицинского, фармацевтического персонала и
- 37. Штатное расписание ПРЕДЛАГАЕТСЯ в соответствии с Приказом Министерства здравоохранения от 25.12.1997 N 380 «О состоянии и
- 38. Оплата труда Постановление Правительства РФ от 05.08.2008 N 583 (ред. от 17.12.2010) "О введении новых систем
- 39. Стимулирующие выплаты Приказ Министерства здравоохранения и социального развития Российской Федерации от 29 декабря 2007 г. N
- 40. Компенсационные выплаты Приказ Министерства здравоохранения и социального развития Российской Федерации от 29 декабря 2007 г. N
- 41. Дифференциация оплаты труда Федеральный закон Российской Федерации от 21 ноября 2011 г. N 323-ФЗ «Об основах
- 42. Аттестация рабочих мест Постановление правительства РФ от 20.11.2008 № 870 «Об установлении продолжительности рабочего времени, ежегодного
- 43. Продолжительность рабочего времени Трудовой кодекс РФ, ст. 350 для всех категорий медицинских работников устанавливает сокращенную продолжительность
- 44. Продолжительность рабочего времени В постановлении представлен перечень должностей и (или) специальностей медицинских работников, а также отделений…,
- 45. Продолжительность рабочего времени Перечень должностей и (или) специальностей медицинских работников, а также отделений…, дающих право на
- 46. Охрана труда в лаборатории Приказ МЗ РФ № 126 от 29.04.97 «Об организации работы по охране
- 47. Охрана труда в лаборатории В инструкции по охране труда отражаются: Общие требования безопасности Требования безопасности до
- 48. Охрана труда в лаборатории Постановление правительства РФ от 03.04.06 № 191 «Об утверждении перечня должностей подлежащих
- 49. НАЦИОНАЛЬНЫЕ СТАНДАРТЫ РФ в КДЛ
- 50. Национальные стандарты Федеральный закон № 184-ФЗ от 27.12.2002 «О техническом регулировании» Определил подход к вопросам установления
- 51. ГОСТ Р ИСО 15189 - 2009 «Лаборатории медицинские. Частные требования к качеству и компетентности» Принят в
- 52. ГОСТ Р ИСО 15189 - 2009 «Лаборатории медицинские. Частные требования к качеству и компетентности» Отражает подход
- 53. ГОСТ Р 53079 - 2008 «Технологии лабораторные медицинские. Обеспечение качества клинических лабораторных исследований» Часть 1. Описание
- 54. ГОСТ Р 53022 - 2008 «Технологии лабораторные медицинские. Требования к качеству клинических лабораторных исследований» Часть 1.
- 55. ГОСТ Р 53133 - 2008 «Технологии лабораторные медицинские. Контроль качества клинических лабораторных исследований» Часть 1. Пределы
- 56. Стандарты по месту лечения ГОСТ Р ИСО 15197-2009 Системы диагностические in vitro. Требования к системам мониторного
- 57. Стандарты, определяющие требования к референтной системе ГОСТ Р ИСО 17511-2006 Изделия медицинские для диагностики in vitro.
- 58. РУКОВОДСТВО ПО КАЧЕСТВУ
- 59. Нормативные документы Приказ МЗ РФ № 45 от 07.02.2000 г. «О системе мер по повышению качества
- 60. Нормативные документы ГОСТ Р ИСО 15189-2007 «Лаборатории медицинские. Частные требования к качеству и компетентности» 4.2.3 Политика,
- 61. Типовая модель «Руководства по качеству» 2.1 Общая часть Документы, входящие в общую часть "Руководства по качеству",
- 62. Типовая модель «Руководства по качеству» 2.2. Система обеспечения качества деятельности КДЛ Система обеспечения качества КДЛ строится
- 63. Типовая модель «Руководства по качеству» 2.3 Учетно - отчетная документация. Унифицированные формы учетно - отчетной документации
- 64. Типовая модель «Руководства по качеству» 2.4 Перечень основных ведомственных нормативных документов, используемых при разработке "Руководства по
- 65. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) Руководство по качеству направлено на успешную реализацию политики
- 66. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) Введение 1.1. Общие положения (общая информация об организации,
- 67. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) Введение 1.3 Действующая политика в области качества (Основной
- 68. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) 1. Введение 2. Нормативные ссылки 3. Термины, определения
- 69. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) 4. Требования к управлению 4.1.5 Конфиденциальная информация Вся
- 70. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) 4.2. Система менеджмента качества 4.2.2 Система менеджмента качества
- 71. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) 4.2. Система менеджмента качества 4.2.3. Политика и цели
- 72. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) 4.3. Управление документацией для методических нужд описания СМК
- 73. СМК «Руководство по качеству» (ГОСТ Р ИСО 15189-2007) 4.3. Управление документацией Основным видом документов СМК лабораторного
- 74. Проблемы разработки и внедрения СМК медицинских лабораторий на базе ГОСТ Р ИСО 15189-2009 Недостаточность опыта в
- 75. Проблемы лабораторной медицины в РФ Низкая квалификация клиницистов в сфере лабораторной медицины Низкая квалификация среднего медперсонала
- 76. СТАНДАРТНЫЕ ОПЕРАЦИОННЫЕ ПРОЦЕДУРЫ
- 77. Нормативные документы ГОСТ Р 53079.2 - 2008 «Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть
- 78. Нормативные документы ГОСТ Р 53079.2 - 2008 «Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть
- 79. Нормативные документы ГОСТ Р 53079.2 - 2008 «Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть
- 80. Нормативные документы ГОСТ 33044 - 2014 «Межгосударственный стандарт. Принципы надлежащей лабораторной практики» (дата введения 01.08.2015 г)
- 81. Стандартная операционная процедура (СОП) ИСО 9000:2005 «Система управления качеством. Основные положения и словарь». Процедура – это
- 82. Стандартная операционная процедура (СОП) Должна быть ясной и отражать детали Должна быть составлена наиболее квалифицированными сотрудниками
- 83. Рекомендуемый перечень СОП-ов 1. Для преаналитического этапа (за пределами лаборатории) 1.1 Заполнение бланка-запроса на исследование. 1.2
- 84. Рекомендуемый перечень СОП-ов 2. Для преаналитического этапа (внутри лаборатории) 2.1 Прием, регистрация и контроль качества биоматериала
- 85. Рекомендуемый перечень СОП-ов 3. Для аналитического этапа 3.1 СОПы по всем «ручным методам» и методам, где
- 86. Рекомендуемый перечень СОП-ов 3. Для аналитического этапа 3.8 Правила работы с информационными системами лаборатории 3.9 Организация
- 87. Рекомендуемый перечень СОП-ов 4. Для постаналитического этапа 4.1 Правила оформления, верификации и утверждения данных протокола исследований
- 88. Рекомендуемый перечень СОП-ов 5. Дополнительные СОПы: 5.1 Правила хранения реагентов 5.2 Правила хранения биоматериала 5.3 Техническое
- 89. Общая схема создания СОП-ов 2.1. Приказ о создании СОПа в устном или письменном виде отдает исполнителю
- 90. Титульная страница СОП 1. Название СОПа 2. Идентификатор (код) СОПа 3. ФИО и должность разработчика СОПа
- 91. Разделы СОП 1. Назначение и область применения В данном разделе необходимо указать в общем виде цель
- 92. Разделы СОП 5. Применяемое оборудования/инструменты Указать, какое оборудование/инструменты необходимо для выполнения СОПа. Помимо простого перечисления рекомендуется
- 93. Разделы СОП 9. Квалификация исполнителей Указать требования к квалификации персонала, допущенного к работе с СОПом 10.
- 94. Ведение реестра внутренних документов Необходимо вести реестр СОПов. В идеале, в лаборатории должна быть установлена система
- 95. Актуализация СОП Проводится не реже, чем один раз в год Проводится разработчиком СОП или ответственным сотрудником
- 96. Стандартизация в РФ Цели и принципы стандартизации в РФ установлены Федеральным законом от 27.12.2002 г №
- 97. МЕДИЦИНСКАЯ ДОКУМЕНТАЦИЯ В КЛИНИКО-ДИАГНОСТИЧЕСКОЙ ЛАБОРАТОРИИ
- 98. Медицинская документация в КДЛ Приказ МЗ СССР № 1030 от 04.10.80 «Об утверждении форм первичной медицинской
- 99. Медицинская документация в КДЛ РЕГИСТРАЦИОННЫЕ ЖУРНАЛЫ Журнал регистрации анализов и их результатов – 3 года Журнал
- 100. Медицинская документация в КДЛ Дополнительная документация (в соответствии с приказом МЗ РФ № 45 от 07.02.00,
- 102. Скачать презентацию

































































































 Профилактика поведенческих факторов риска у детей и подростков (табакокурение)
Профилактика поведенческих факторов риска у детей и подростков (табакокурение) Классификация оперативного доступа к органам брюшной полости
Классификация оперативного доступа к органам брюшной полости Диспансеризация и диспансерное наблюдение
Диспансеризация и диспансерное наблюдение Ранний послеоперационный период
Ранний послеоперационный период Оценка состояния плода во время беременности и родов. Оценка маленького для гестационного возраста плода (МГВП)
Оценка состояния плода во время беременности и родов. Оценка маленького для гестационного возраста плода (МГВП) Лечение при полном отсутствии коронки зуба штифтовыми конструкциями
Лечение при полном отсутствии коронки зуба штифтовыми конструкциями Лейкози (гемобластози)
Лейкози (гемобластози) Функциональные пробы сердечнососудистой системы у инвалидов с поражением опорнодвигательной системы. (Лекция 2а)
Функциональные пробы сердечнососудистой системы у инвалидов с поражением опорнодвигательной системы. (Лекция 2а) Судебно-медицинская токсикология. Повреждения от действия отравляющих веществ
Судебно-медицинская токсикология. Повреждения от действия отравляющих веществ Эндомиялық зоб
Эндомиялық зоб Предупредительные меры повторных кризов у больных с АГ путем постоянного приема ингибиторов АПФ
Предупредительные меры повторных кризов у больных с АГ путем постоянного приема ингибиторов АПФ Аппаратная конвективная вентиляция легких
Аппаратная конвективная вентиляция легких Ерте кезеңдегі ұлы дәрігерлер
Ерте кезеңдегі ұлы дәрігерлер Воспаление. Местные признаки воспаления
Воспаление. Местные признаки воспаления Әлеуметтік жұмыстың теоретикалық концепциялары мен модельдері
Әлеуметтік жұмыстың теоретикалық концепциялары мен модельдері Острые кишечные инфекции у детей
Острые кишечные инфекции у детей Сердечно-легочная реанимация
Сердечно-легочная реанимация Мочевыделительная система
Мочевыделительная система Омыртқа жотасының иіліс сатыларының анықтығына сәйкес дене түрлерин анықтау
Омыртқа жотасының иіліс сатыларының анықтығына сәйкес дене түрлерин анықтау Современные технологии снижения материнской смертности при кровотечении
Современные технологии снижения материнской смертности при кровотечении Зло которое всегда рядом
Зло которое всегда рядом Терминология и инструментарий доказательной медицины. Типы исследований
Терминология и инструментарий доказательной медицины. Типы исследований Сепсис (общая гнойная инфекция. Генерализованная гнойная инфекция)
Сепсис (общая гнойная инфекция. Генерализованная гнойная инфекция) Внезапная смерть. Лекция 8-1
Внезапная смерть. Лекция 8-1 Постхолецистэктомический синдром
Постхолецистэктомический синдром Здоровый человек (женщина)
Здоровый человек (женщина) Био кремний
Био кремний Электрофизиологические основы ЭКГ. Лекция 17
Электрофизиологические основы ЭКГ. Лекция 17