Содержание
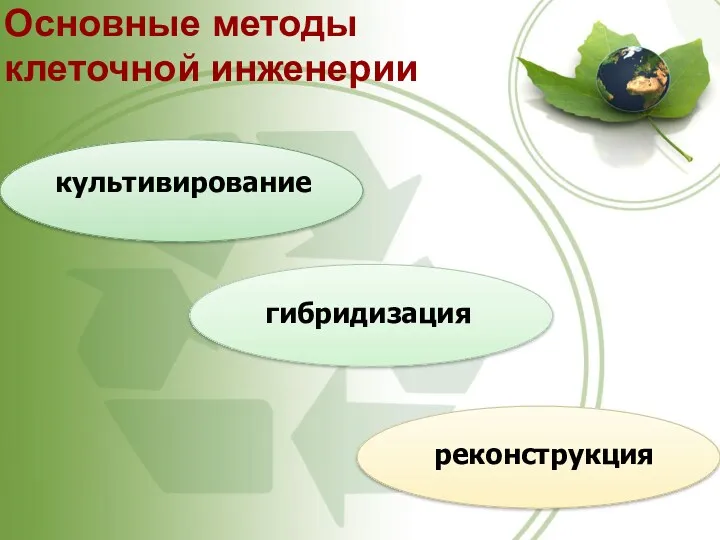
- 2. Основные методы клеточной инженерии культивирование гибридизация реконструкция
- 3. ОБЩИЕ СВЕДЕНИЯ КЛЕТОЧНАЯ ИНЖЕРЕНИЯ. ЖИВОТНЫЕ. Лекция 9
- 4. Культуры животных. Среды для культивирования
- 5. Культуры животных. Методы культивирования
- 6. Культуры животных. Классификация по адаптации к жизни in vitro.
- 7. ОБЛАСТИ ПРИМЕНЕНИЯ КЛЕТОЧНАЯ ИНЖЕРЕНИЯ. ЖИВОТНЫЕ. Лекция 9
- 8. Фундаментальные аспекты
- 9. Прикладные аспекты
- 10. ТЕСТ-СИСТЕМЫ КЛЕТОЧНАЯ ИНЖЕРЕНИЯ. ЖИВОТНЫЕ. Лекция 9
- 11. ПРЕИМУЩЕСТВА по сравнению с тест-системами in vivo: простота культивирования возможности контроля и большая воспроизводимость сокращение временных
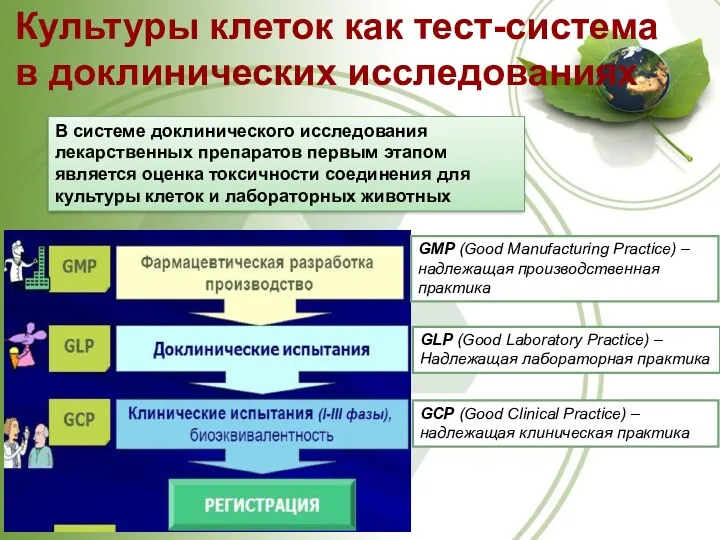
- 12. Культуры клеток как тест-система в доклинических исследованиях В системе доклинического исследования лекарственных препаратов первым этапом является
- 13. СОМАТИЧЕСКИЕ ГИБРИДЫ КЛЕТОЧНАЯ ИНЖЕРЕНИЯ. ЖИВОТНЫЕ. Лекция 9
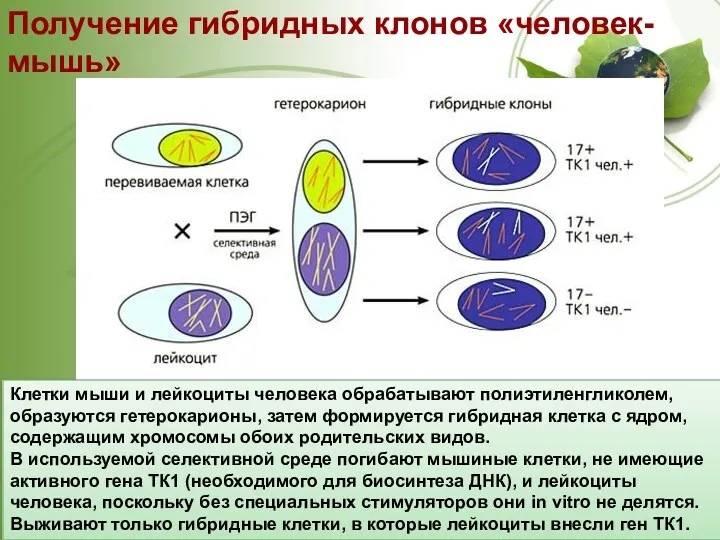
- 14. Получение гибридных клонов «человек-мышь» http://vivovoco.astronet.ru/VV/JOURNAL/NATURE/06_07/INST-3.HTM Клетки мыши и лейкоциты человека обрабатывают полиэтиленгликолем, образуются гетерокарионы, затем формируется
- 15. НА ГЕТЕРОКАРИОНАХ И СОМАТИЧЕСКИХ ГИБРИДАХ ИЗУЧАЮТ: реактивацию геномов активацию и подавление экспрессии генов, роль в этих
- 16. РЕКОНСТРУКЦИЯ. СТВОЛОВЫЕ КЛЕТКИ КЛЕТОЧНАЯ ИНЖЕРЕНИЯ. ЖИВОТНЫЕ. Лекция 9
- 17. История открытия. Появление термина. 1908 г. – появление термина «стволовые клетки» гистолог А.А. Максимов исследуя развитие
- 18. История открытия. Исследования. 1960-х гг. канадские ученые Эрнест Мак-Кулох и Джеймс Тилл нашли кроветворные (гемопоэтические) стволовые
- 19. История открытия. Исследования. 1970-е гг. А.Я. Фриденштейн и И.Л. Чертков заложили основы науки о стволовых клетках
- 20. История открытия. Исследования. 1998 г. публикация статей о выделении эмбриональных стволовых клеток из бластоцисты человека Джеймс
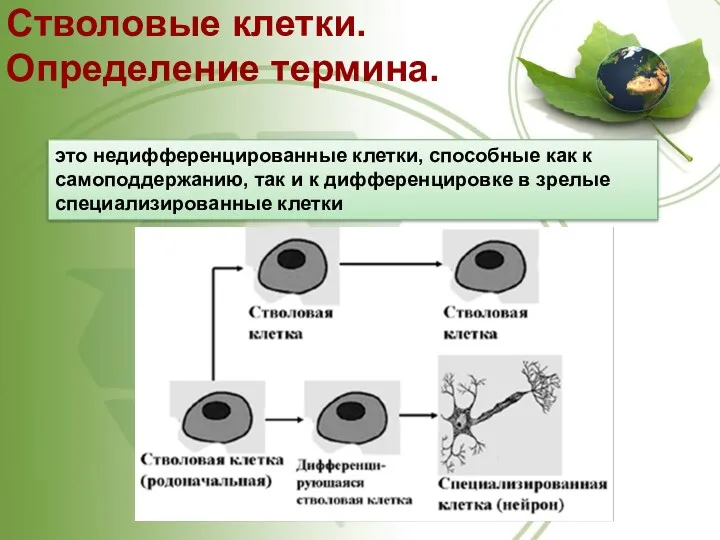
- 21. Стволовые клетки. Определение термина. это недифференцированные клетки, способные как к самоподдержанию, так и к дифференцировке в
- 22. Стволовые клетки. Свойства.
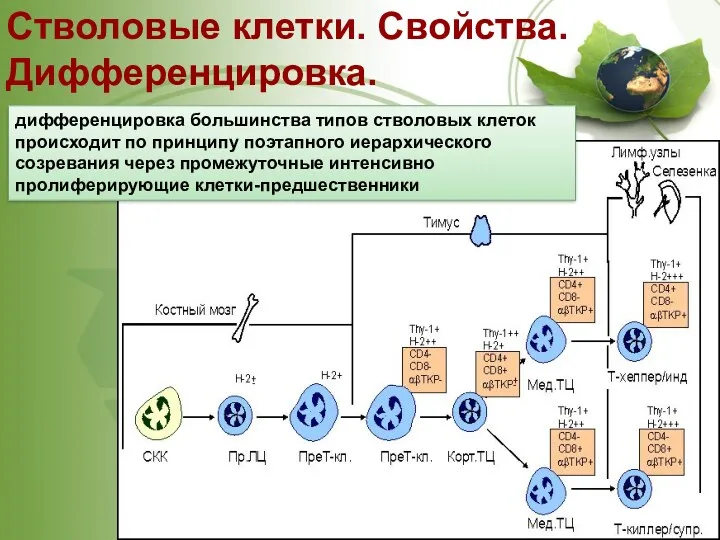
- 23. Стволовые клетки. Свойства. Дифференцировка. дифференцировка большинства типов стволовых клеток происходит по принципу поэтапного иерархического созревания через
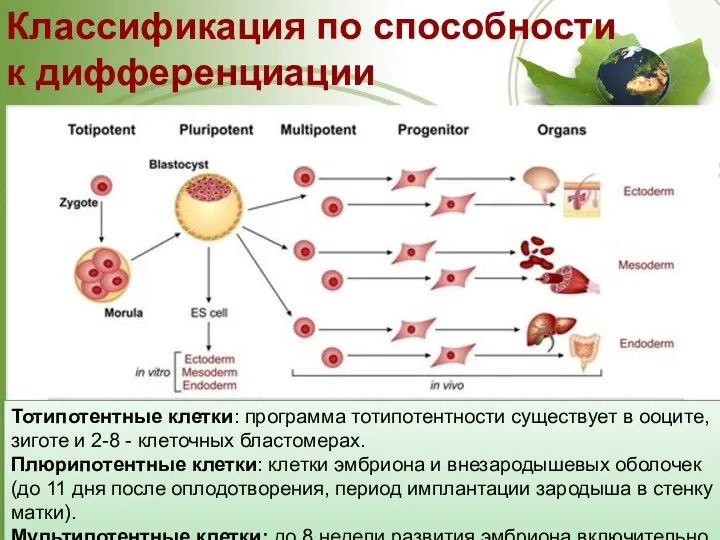
- 24. Стволовые клетки. Классификация по способности к дифференциации. Потентность – это способность стволовых клеток давать начало зрелым
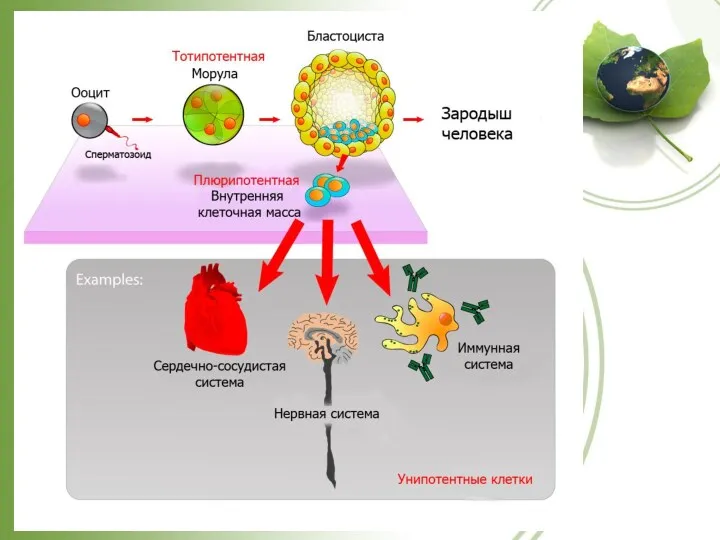
- 25. http://www.tankonyvtar.hu Классификация по способности к дифференциации Тотипотентные клетки: программа тотипотентности существует в ооците, зиготе и 2-8
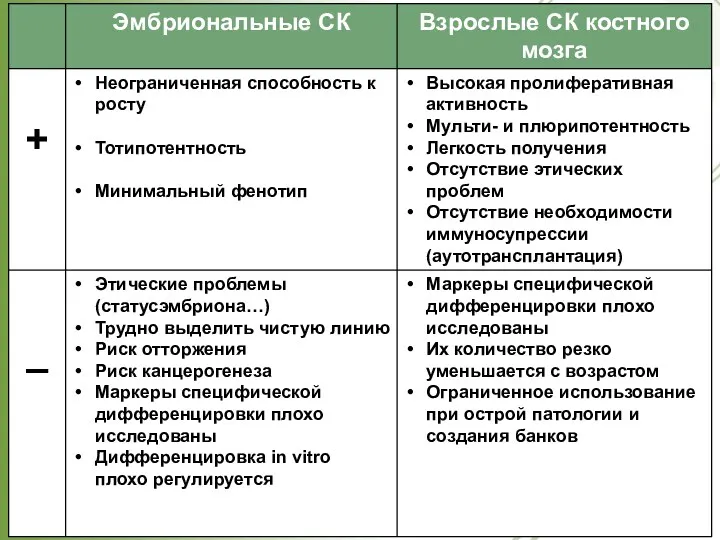
- 26. Стволовые клетки. Классификация по источнику для получения. Эмбриональные стволовые клетки (ЭСК) Фетальные стволовые клетки Стволовые клетки
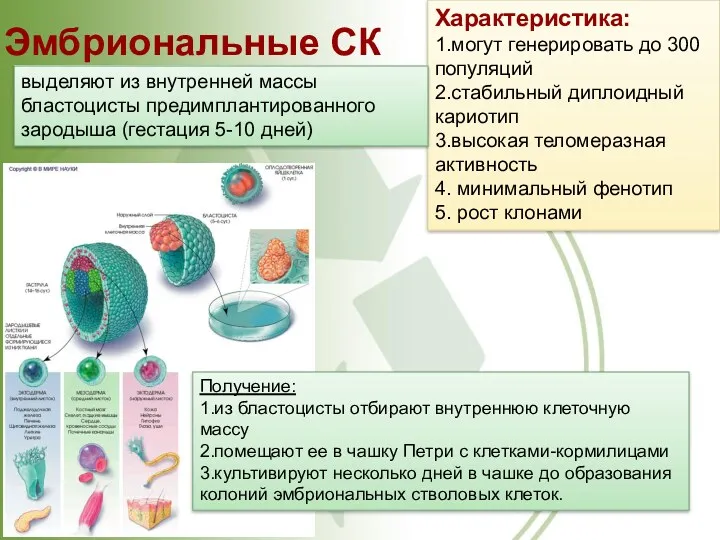
- 27. Классификация по источнику выделения. Эмбриональные. образуют внутреннюю клеточную массу, или эмбриобласт, на ранней стадии развития эмбриона,
- 28. Характеристика: 1.могут генерировать до 300 популяций 2.стабильный диплоидный кариотип 3.высокая теломеразная активность 4. минимальный фенотип 5.
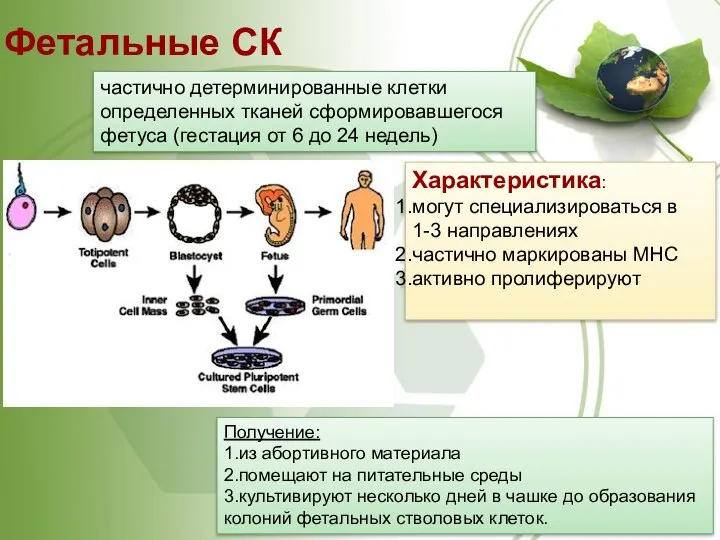
- 30. Фетальные СК частично детерминированные клетки определенных тканей сформировавшегося фетуса (гестация от 6 до 24 недель) Характеристика:
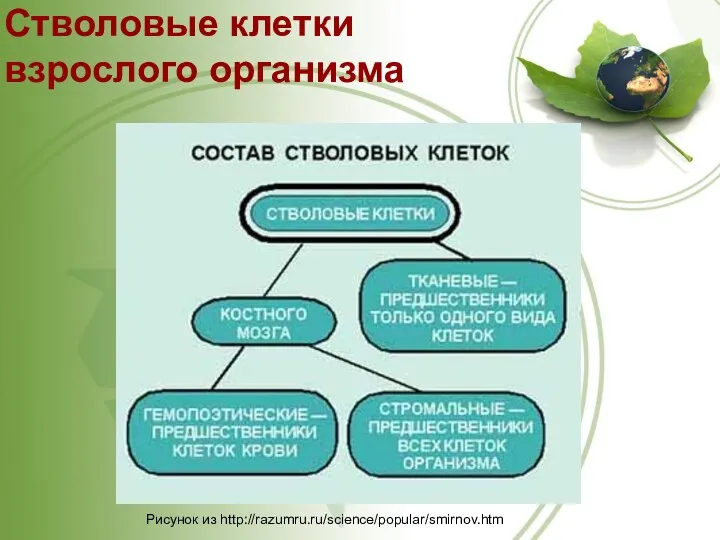
- 31. Рисунок из http://razumru.ru/science/popular/smirnov.htm Стволовые клетки взрослого организма
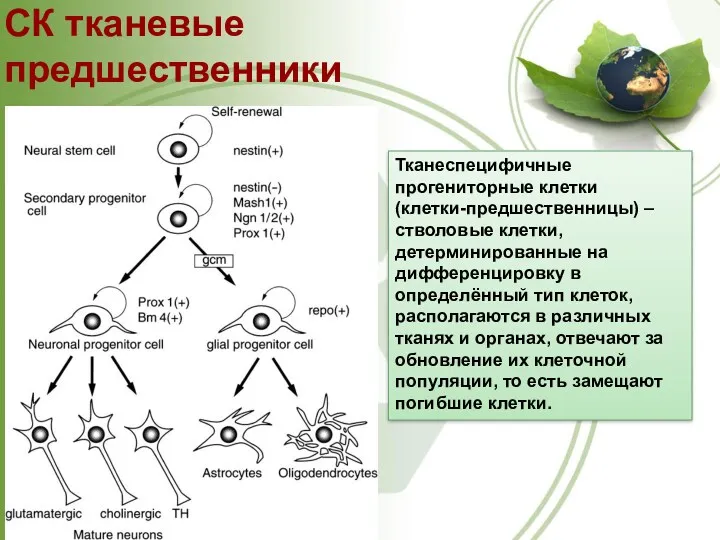
- 33. СК тканевые предшественники Тканеспецифичные прогениторные клетки (клетки-предшественницы) – стволовые клетки, детерминированные на дифференцировку в определённый тип
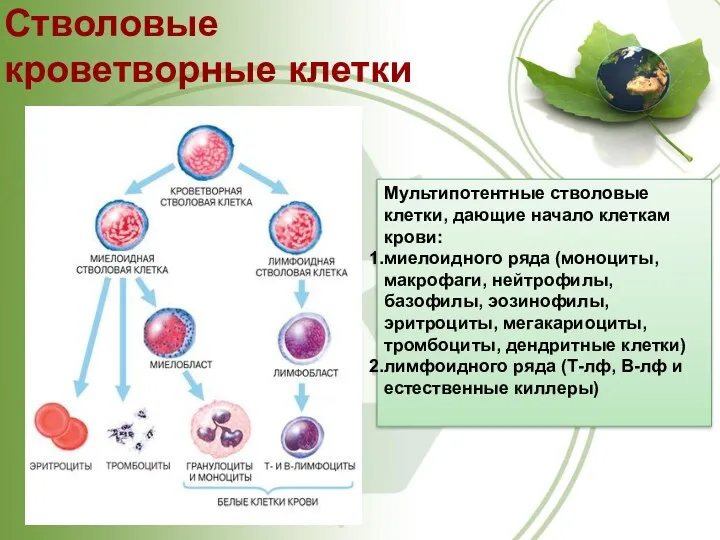
- 34. Стволовые кроветворные клетки Мультипотентные стволовые клетки, дающие начало клеткам крови: миелоидного ряда (моноциты, макрофаги, нейтрофилы, базофилы,
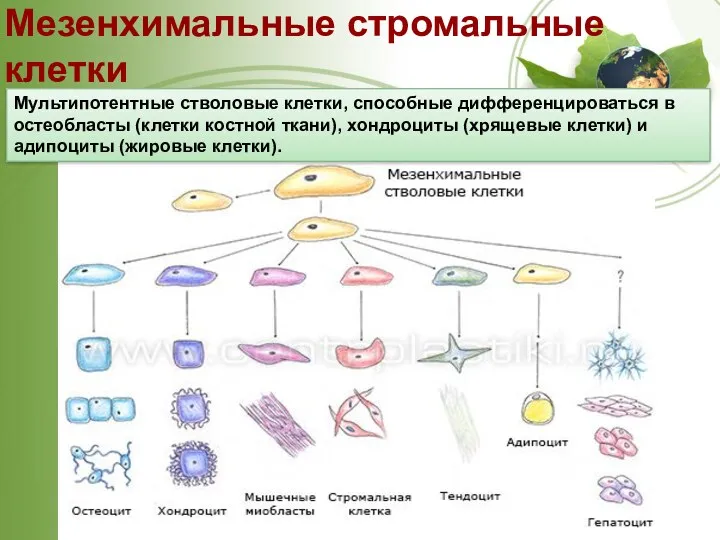
- 35. Мезенхимальные стромальные клетки Мультипотентные стволовые клетки, способные дифференцироваться в остеобласты (клетки костной ткани), хондроциты (хрящевые клетки)
- 37. Лимит Хейфлика в клетках существует механизм их старения (теломеры), который лимитирует количество клеточных делений (не более
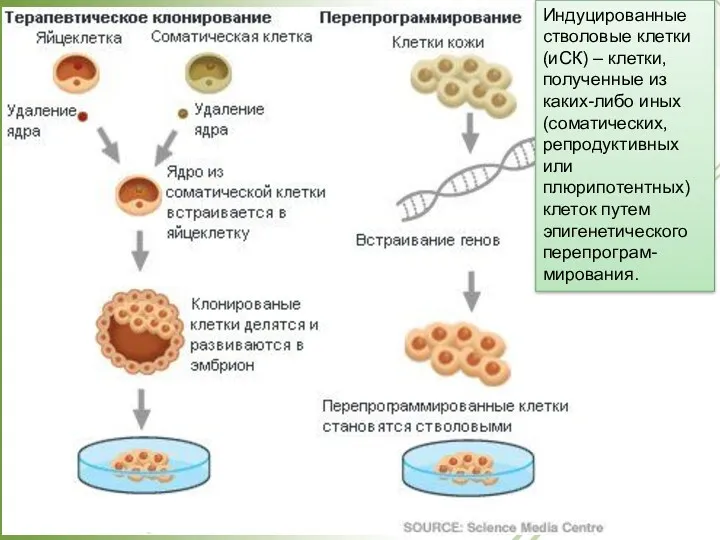
- 38. Индуцированные стволовые клетки (иСК) – клетки, полученные из каких-либо иных (соматических, репродуктивных или плюрипотентных) клеток путем
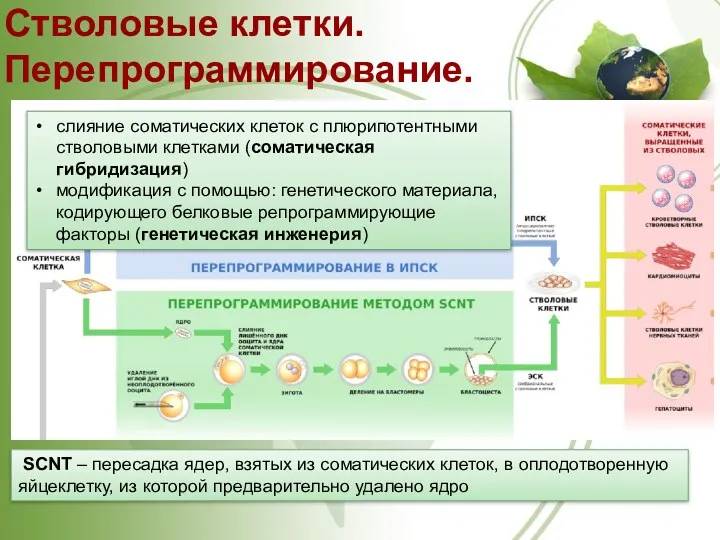
- 39. Стволовые клетки. Перепрограммирование. SCNT – пересадка ядер, взятых из соматических клеток, в оплодотворенную яйцеклетку, из которой
- 40. Стволовые клетки. Перспективы. Клеточная трансплантология Клеточная терапия метод позволяет преодолеть: дефицит донорских органов высокую стоимость трансплантации
- 41. КЛОНИРОВАНИЕ ЖИВОТНЫХ КЛЕТОЧНАЯ ИНЖЕРЕНИЯ. ЖИВОТНЫЕ. Лекция 9
- 42. Формы клонирования
- 43. Предыстория метода 1938 г. – Х. Шпеман предложил эксперимент по переносу ядра
- 44. ЭКСПЕРИМЕНТ Г.В. ЛОПАШЕВА Георгий Викторович Лопашов (1912-2010) 1948 г. разработал метод трансплантации ядер в яйцеклетку лягушки
- 45. ЭКСПЕРИМЕНТ Р. БРИГГСА и Т. КИНГА Роберт Бриггс и Томас Кинг (1911-1983) (1921-2000) 1952 г. повторили
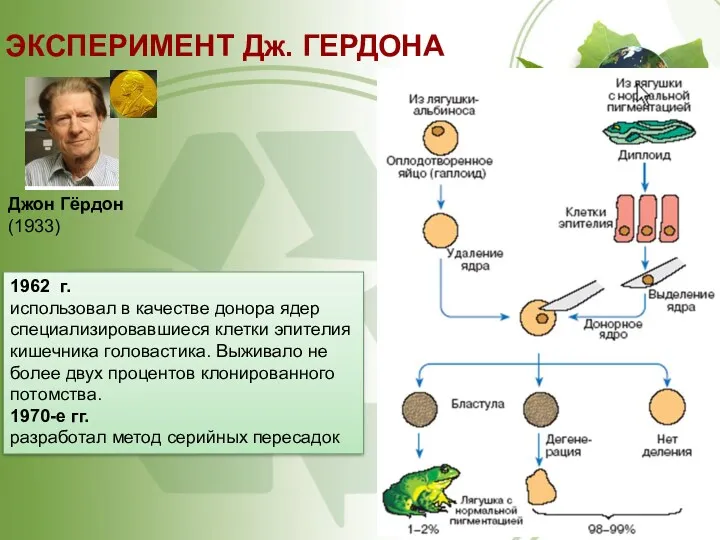
- 46. ЭКСПЕРИМЕНТ Дж. ГЕРДОНА Джон Гёрдон (1933) 1962 г. использовал в качестве донора ядер специализировавшиеся клетки эпителия
- 47. ЭКСПЕРИМЕНТ Л.М. ЧАЙЛАХЯНА и сотр. 1987 г. первое клонирование млекопитающих (лабораторная линия мышей-альбиносов CBWA ) Мышку
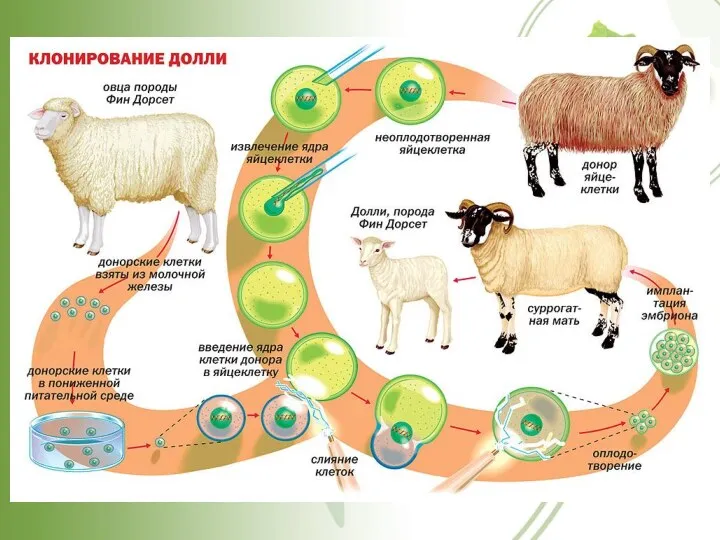
- 48. ЭКСПЕРИМЕНТ Я. УИЛМУТА Ян Уилмут Долли (1944) (1996-2003) Билл Ритчи Карен Майкок Кейт Кэмпбэлл (1954-2012) Долли
- 50. перенос ядра из дифференцированной клетки в неоплодотворённую яйцеклетку в энуклеированную яйцеклетку с последующей пересадкой реконструированной зиготы
- 51. I этап Получение ядра для трансплантации II этап Получение энуклеированной клетки-реципиента III этап Получение реконструированной зиготы
- 53. 1 Этап. Получение ядра для трансплантации Донорская клетка отбирается у клонируемого животного и из нее при
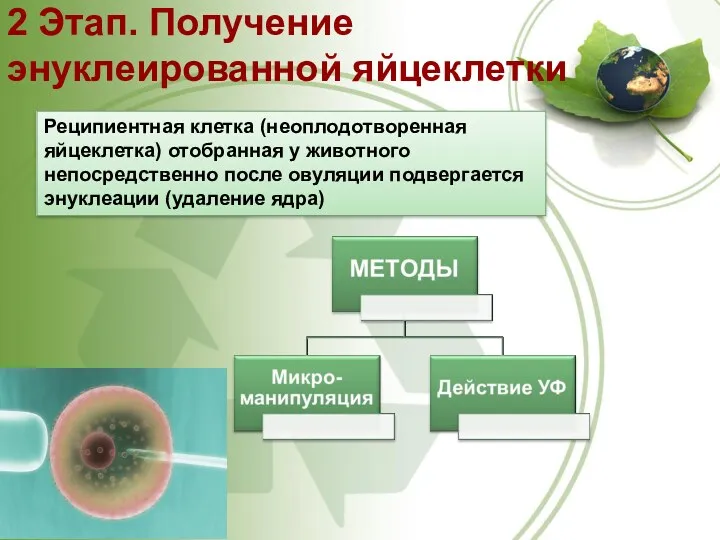
- 54. 2 Этап. Получение энуклеированной яйцеклетки Реципиентная клетка (неоплодотворенная яйцеклетка) отобранная у животного непосредственно после овуляции подвергается
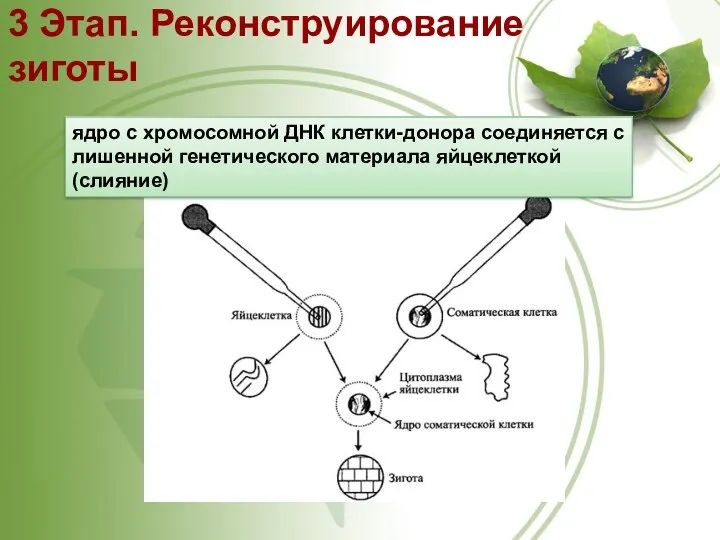
- 55. 3 Этап. Реконструирование зиготы ядро с хромосомной ДНК клетки-донора соединяется с лишенной генетического материала яйцеклеткой (слияние)
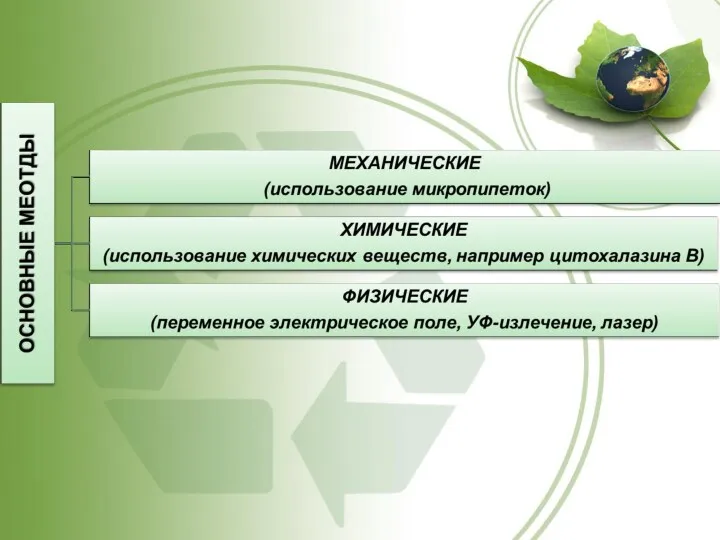
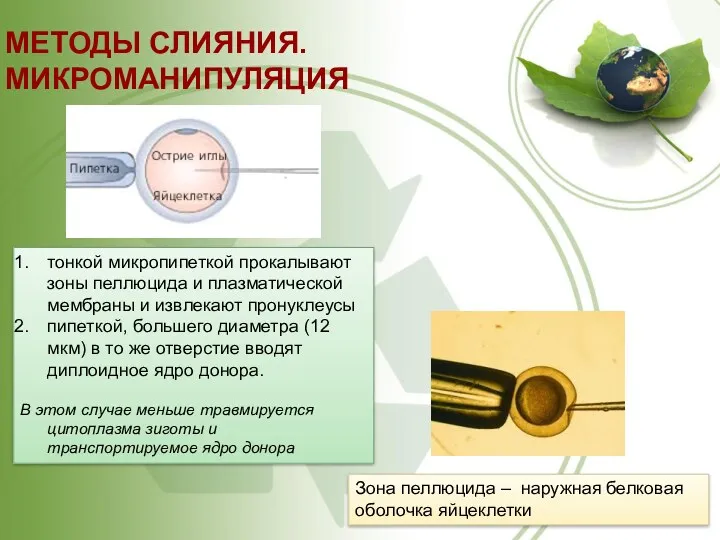
- 56. МЕТОДЫ СЛИЯНИЯ. МИКРОМАНИПУЛЯЦИЯ тонкой микропипеткой прокалывают зоны пеллюцида и плазматической мембраны и извлекают пронуклеусы пипеткой, большего
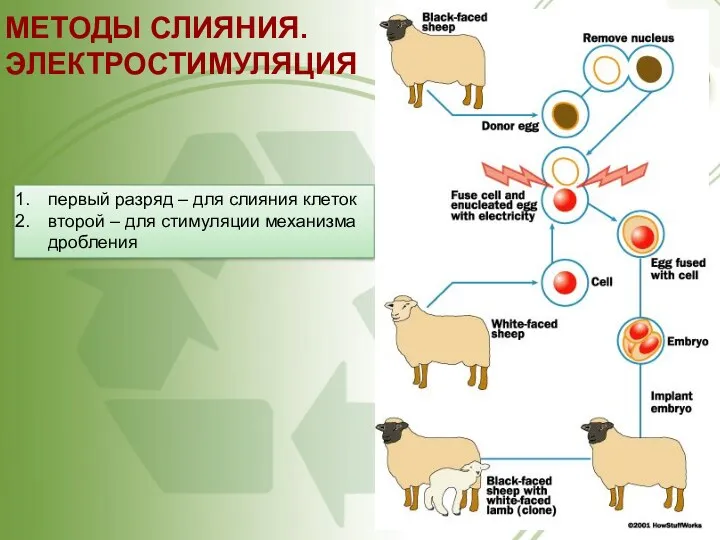
- 57. МЕТОДЫ СЛИЯНИЯ. ЭЛЕКТРОСТИМУЛЯЦИЯ первый разряд – для слияния клеток второй – для стимуляции механизма дробления
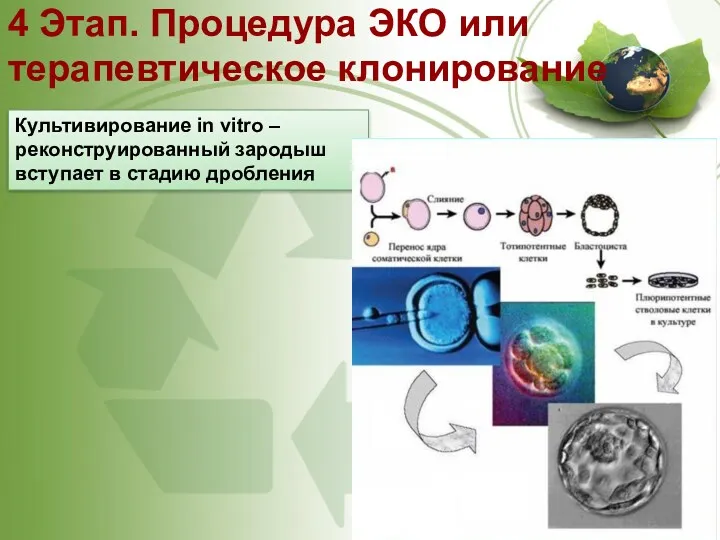
- 58. 4 Этап. Процедура ЭКО или терапевтическое клонирование Культивирование in vitro – реконструированный зародыш вступает в стадию
- 59. Бластоциста приближается к стенке матки Бластоциста начинает внедряться (имплантироваться) под слизистую оболочку Имплантация практически закончена Предимплантационный
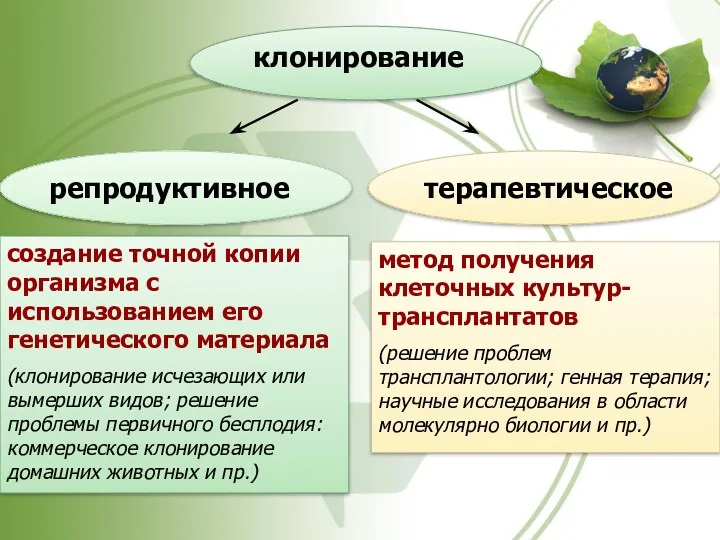
- 61. клонирование репродуктивное терапевтическое создание точной копии организма с использованием его генетического материала (клонирование исчезающих или вымерших
- 62. Основные современные подходы при клонировании животных Фрагментирование предимплантационного эмбриона со стимуляцией последующего развития (таким путем были
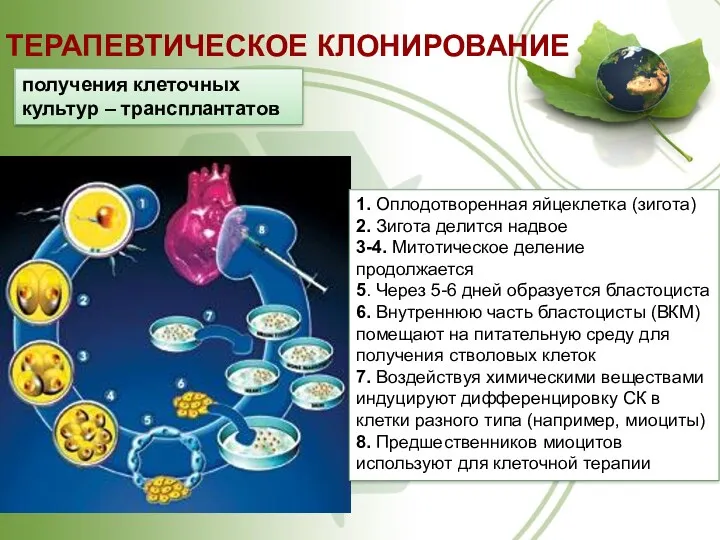
- 63. ТЕРАПЕВТИЧЕСКОЕ КЛОНИРОВАНИЕ получения клеточных культур – трансплантатов 1. Оплодотворенная яйцеклетка (зигота) 2. Зигота делится надвое 3-4.
- 65. Скачать презентацию




































 Вирусты. Гепатит В. Эпидемиологиясы
Вирусты. Гепатит В. Эпидемиологиясы Реабилитация при Инфаркте Миокарда
Реабилитация при Инфаркте Миокарда Отбеливание зубов
Отбеливание зубов Базовая модель медико-социальной работы
Базовая модель медико-социальной работы Дизайны клинических исследований
Дизайны клинических исследований Составление схемы диспансерного наблюдений курируемых хронических больных
Составление схемы диспансерного наблюдений курируемых хронических больных Общая анестезия. . Виды общей анестезии. Клиническая фармакология средств применяемых в анестезиологическом пособии
Общая анестезия. . Виды общей анестезии. Клиническая фармакология средств применяемых в анестезиологическом пособии Нарушения речи при детских неврозах. Мутизм, сурдомутизм, заикание
Нарушения речи при детских неврозах. Мутизм, сурдомутизм, заикание Профессиональные нейротоксикозы
Профессиональные нейротоксикозы Жұқпалы үрдіс патофизиологиясы. Сепсис және сепсистік сілейменің патогенезі
Жұқпалы үрдіс патофизиологиясы. Сепсис және сепсистік сілейменің патогенезі Лечебное питание при различных нарушениях обмена веществ
Лечебное питание при различных нарушениях обмена веществ Электрическая ось сердца и электрическая позиция сердца
Электрическая ось сердца и электрическая позиция сердца Biological Therapy in Psychiatry
Biological Therapy in Psychiatry Облитерирующий атеросклероз брюшной аорты и артерий нижних конечностей
Облитерирующий атеросклероз брюшной аорты и артерий нижних конечностей Жүрек гликозидтері
Жүрек гликозидтері Визуальная диагностика при гипоталамо-гипофизарном ожирении
Визуальная диагностика при гипоталамо-гипофизарном ожирении Топографическая анатомия нижней конечности. Области мышечной и сосудистой лакуны, бедра, подколенная ямка, ягодичная область
Топографическая анатомия нижней конечности. Области мышечной и сосудистой лакуны, бедра, подколенная ямка, ягодичная область Внелегочной туберкулез
Внелегочной туберкулез Ұрықтың туа пайда болған орталық жүйке жүйесінің ақаулары
Ұрықтың туа пайда болған орталық жүйке жүйесінің ақаулары Ультразвуковая терапия
Ультразвуковая терапия Морфология и цикл развития дизентерийной амебы
Морфология и цикл развития дизентерийной амебы Дифференциальный диагноз анемий
Дифференциальный диагноз анемий Тәуліктік PH-метрия
Тәуліктік PH-метрия Заболевания простаты
Заболевания простаты Абдоминальный массаж
Абдоминальный массаж Электронное здравоохранение. Медицинские информационные системы
Электронное здравоохранение. Медицинские информационные системы Организация работы с непригодными для медицинского использования лекарственными средствами
Организация работы с непригодными для медицинского использования лекарственными средствами Алгоритм диагностики заболеваний органов дыхания
Алгоритм диагностики заболеваний органов дыхания