Порядок включения лекарств в клинические протоколы. Внедрение клинических протоколов в клиническую практику презентация
Содержание
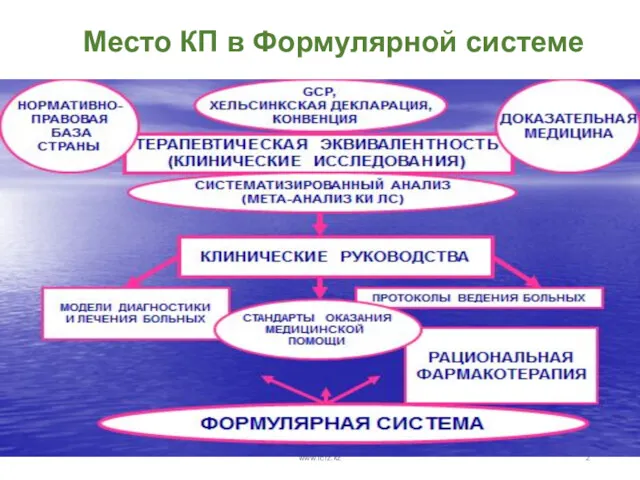
- 2. Место КП в Формулярной системе www.rcrz.kz www.rcrz.kz
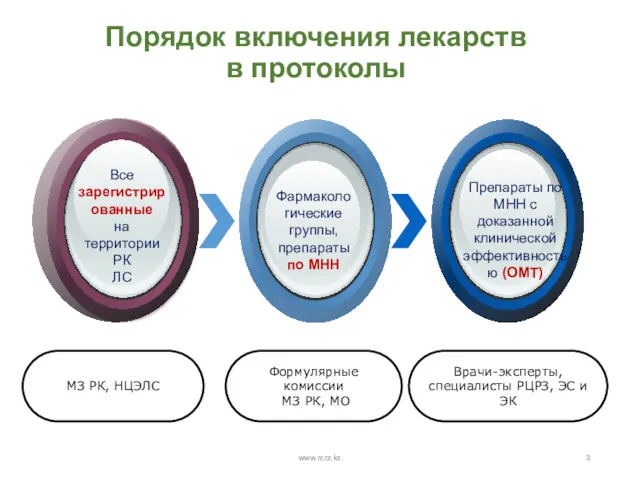
- 3. Порядок включения лекарств в протоколы www.rcrz.kz
- 4. Оценка лекарственных препаратов: специальные вопросы Режимы дозирования: рассмотреть дозу и продолжительность утвержденного лекарственного препарата в сравнении
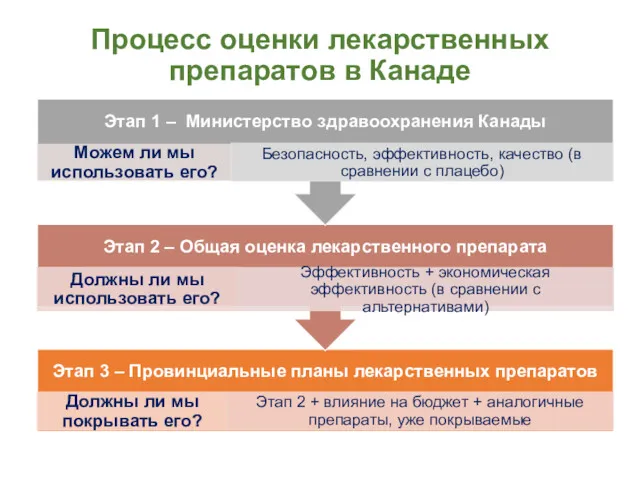
- 5. Процесс оценки лекарственных препаратов в Канаде
- 6. Оценка безопасности фармакотерапии 1. По типу: - побочные реакции - любые непреднамеренные и вредные для организма
- 7. 2. По частоте побочные реакции подразделяются на: - очень частые – более 1/10 (более 10%); -
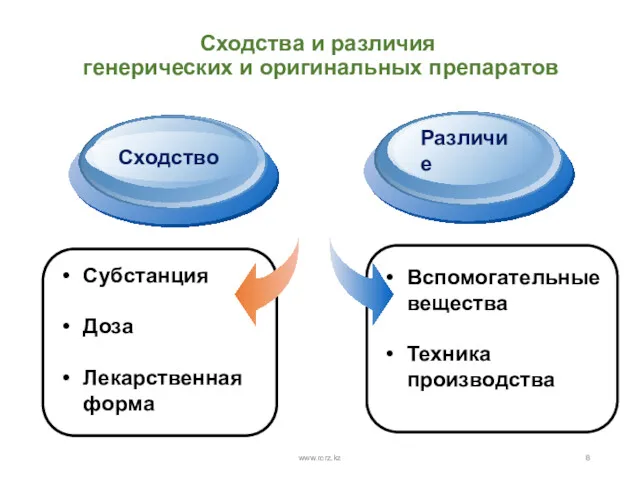
- 8. Сходства и различия генерических и оригинальных препаратов www.rcrz.kz Субстанция Доза Лекарственная форма Title Add your text
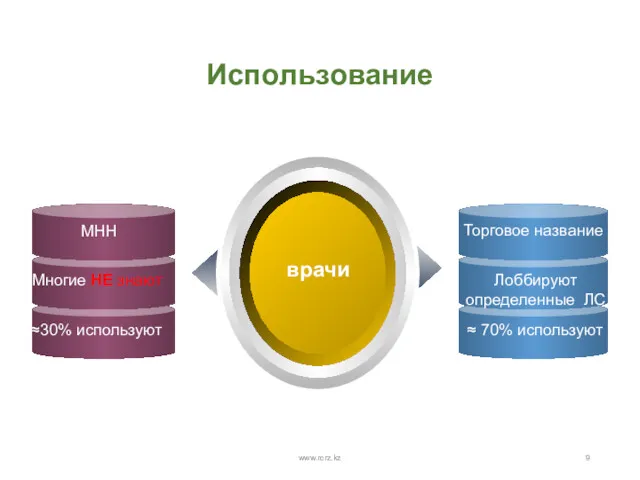
- 9. Использование www.rcrz.kz
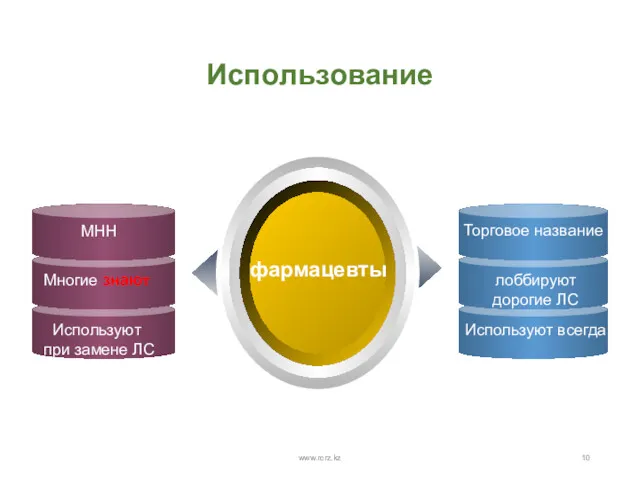
- 10. www.rcrz.kz Использование
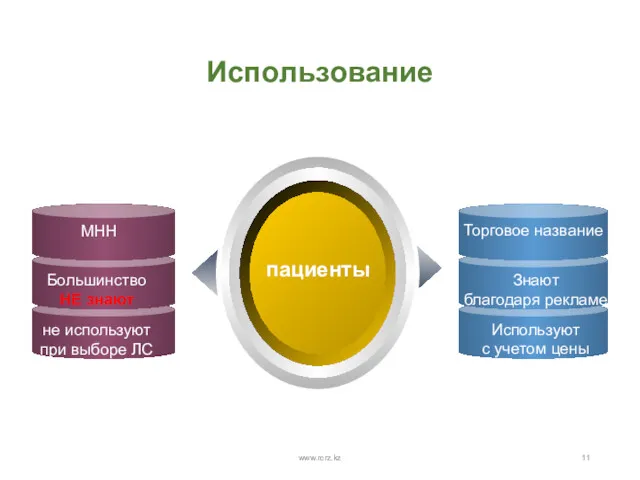
- 11. www.rcrz.kz Использование
- 12. Преимущества использования генерических названий в КП Стандартизация Унифицированность Возможность определения групповой принадлежности Отсутствие лоббирования фармкомпаний Удобство
- 13. Недостатки использования генерических препаратов Данные об эффективности и безопасности оригинальных препаратов часто экстраполируется на генерические препараты
- 14. Сравнение терапевтической эффективности липримара и его дженериков Эффективная дозировка – от 20 мг/сут Скорость наступления клинических
- 15. Проблемы использования генерических препаратов При некоторых нозологиях замена оригинального препарата на генерик приводит к осложнениям и
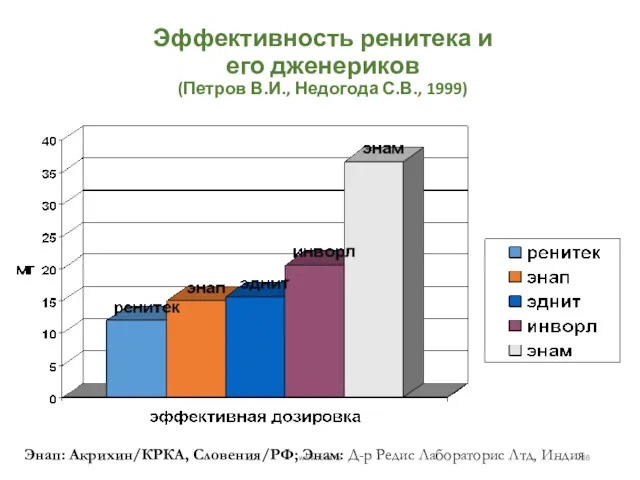
- 16. Эффективность ренитека и его дженериков (Петров В.И., Недогода С.В., 1999) www.rcrz.kz Энап: Акрихин/КРКА, Словения/РФ; Энам: Д-р
- 17. Взаимозаменяемость Терапевтическая эквивалентность – основное требование взаимозаменяемости Фармацевтическая эквивалентность не гарантирует эквивалентности фармакокинетической www.rcrz.kz www.rcrz.kz
- 18. Биоэквивалентность «Два лекарственных препарата считают биоэквивалентными, если они фармацевтически эквивалентны, имеют одинаковую биодоступность и при назначении
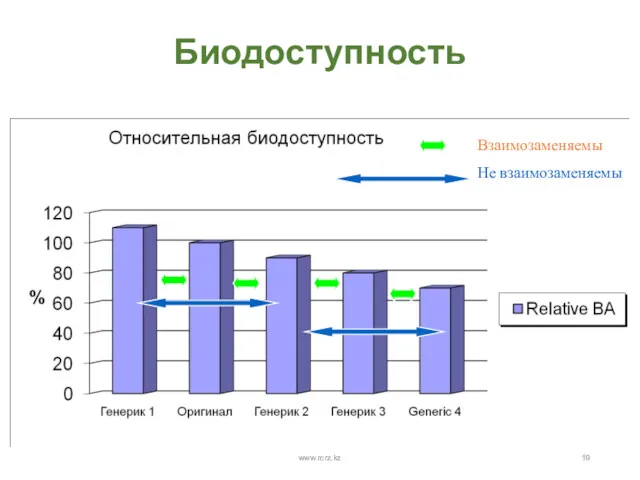
- 19. Биодоступность www.rcrz.kz Взаимозаменяемы Не взаимозаменяемы www.rcrz.kz
- 20. В 1984 году Управление по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) впервые опубликовало
- 21. Терапевтическая эквивалентность В опубликованном в 1998 году FDA проекте правил оценки терапевтической эквивалентности дженериков предлагается указывать
- 22. Кодировка ЛС (FDA) Код «А- препарат с подтвержденной терапевтической эквивалентностью (сведения о проблемах биоэквивалентности препарата отсутствуют)
- 23. Мнение экспертов В руководстве ВОЗ по регистрационным требованиям, предъявляемым для определения взаимозаменяемости генерических лекарственных препаратов, также
- 24. Выводы Включение в клинические протоколы ЛС по МНН является обоснованным и целесообразным с точки зрения организатора
- 25. Рекомендации Включать в клинические протоколы ЛС только по МНН Указывать в клинических протоколах отдельных нозологий о
- 26. Внедрение КП в клиническую практику
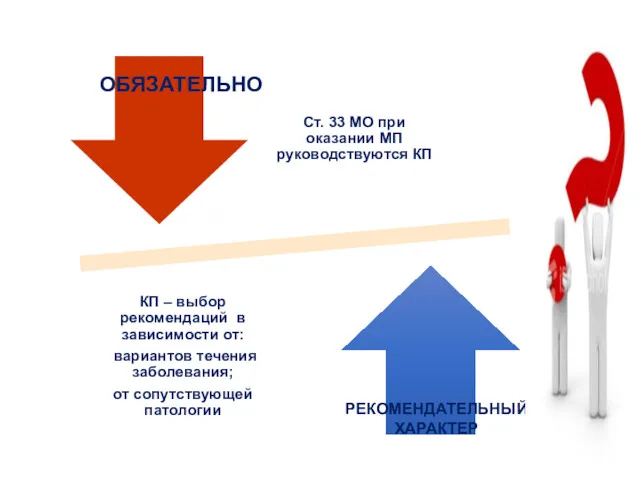
- 27. Обязательно Рекомендуемо Применение КП …..
- 28. ОБЯЗАТЕЛЬНО РЕКОМЕНДАТЕЛЬНЫЙ ХАРАКТЕР
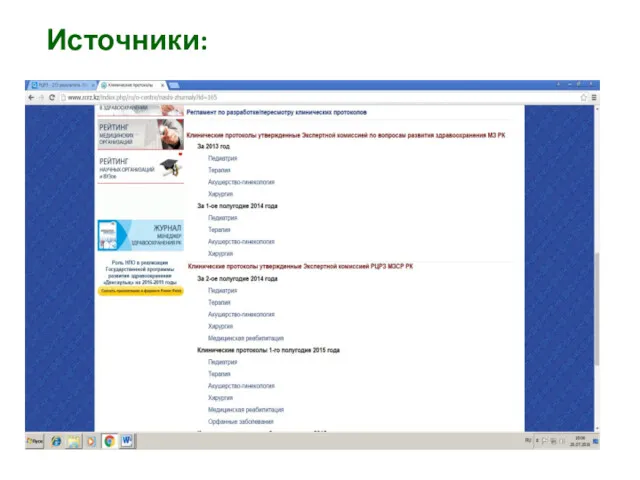
- 29. Источники:
- 30. Источники:
- 31. Источники:
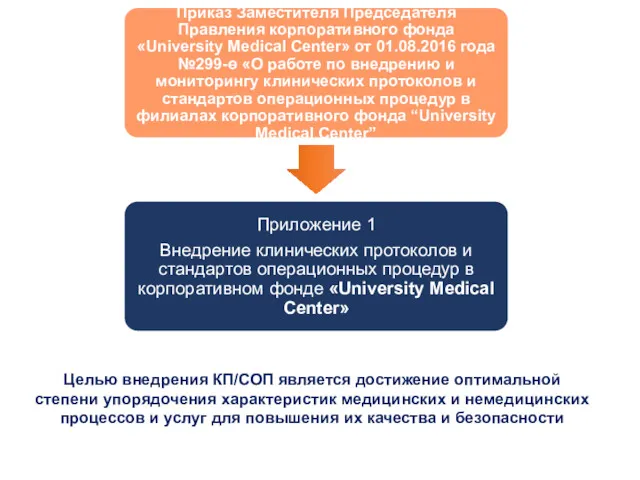
- 32. Целью внедрения КП/СОП является достижение оптимальной степени упорядочения характеристик медицинских и немедицинских процессов и услуг для
- 33. Определение КП – это документ, устанавливающий общие требования к оказанию медицинской помощи пациенту при определенном заболевании
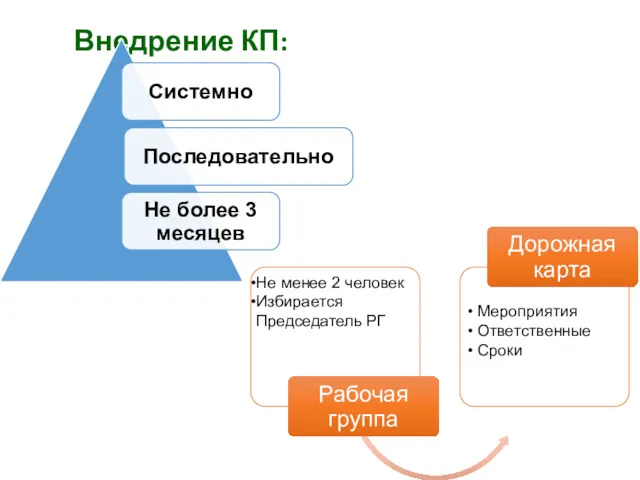
- 34. Внедрение КП:
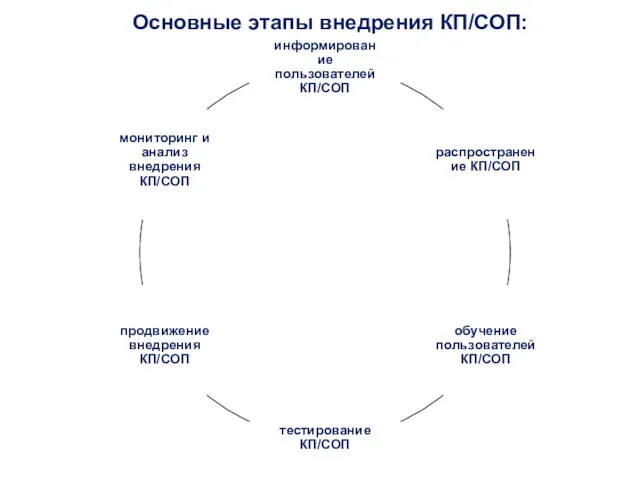
- 35. Основные этапы внедрения КП/СОП:
- 36. Информирование пользователей доведение информации до пользователей КП/СОП через непосредственных руководителей структурных подразделений; информирование сотрудников на производственных
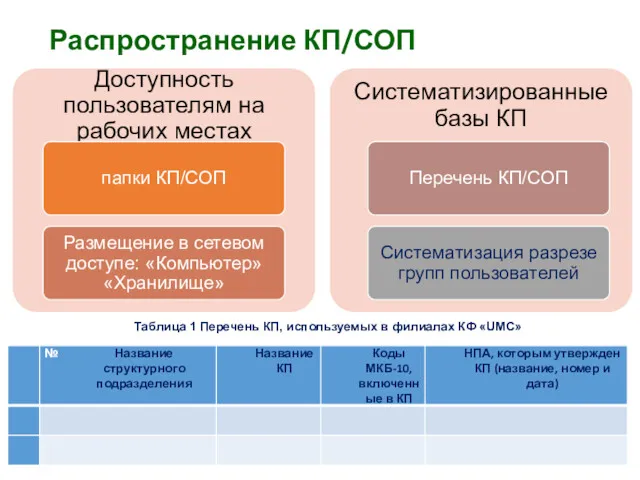
- 37. Распространение КП/СОП Таблица 1 Перечень КП, используемых в филиалах КФ «UMC»
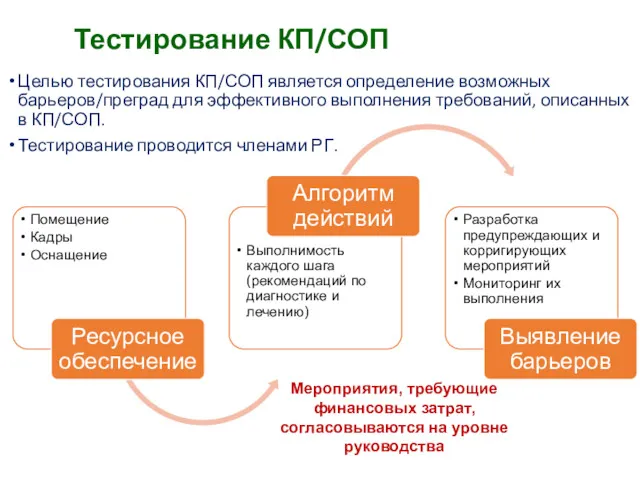
- 38. Тестирование КП/СОП Целью тестирования КП/СОП является определение возможных барьеров/преград для эффективного выполнения требований, описанных в КП/СОП.
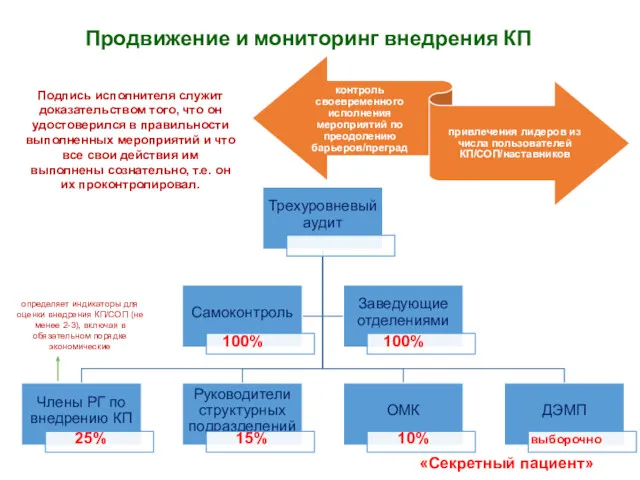
- 39. Продвижение и мониторинг внедрения КП Подпись исполнителя служит доказательством того, что он удостоверился в правильности выполненных
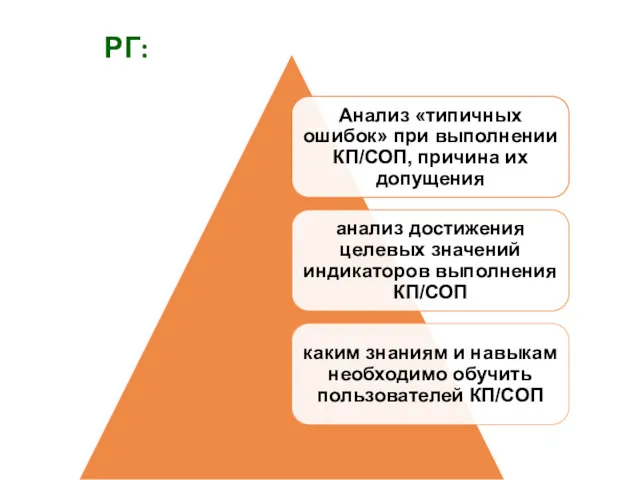
- 40. РГ:
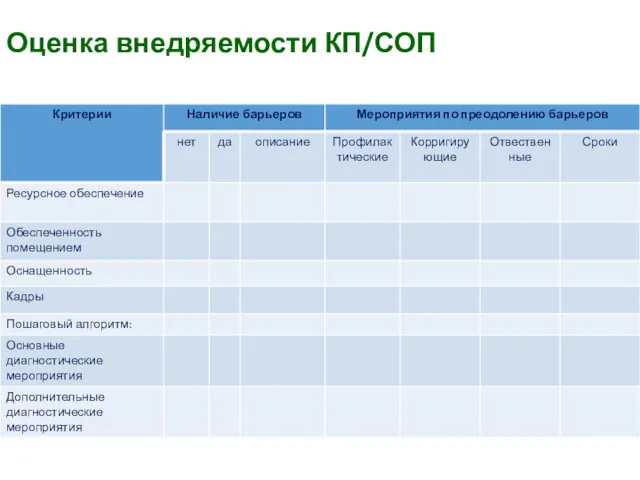
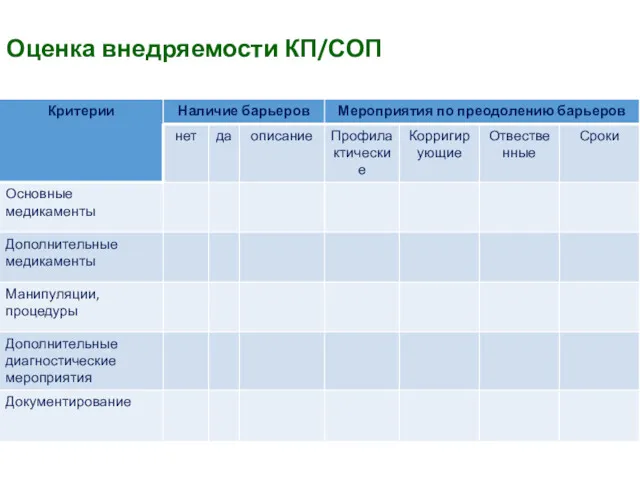
- 41. Оценка внедряемости КП/СОП
- 42. Оценка внедряемости КП/СОП
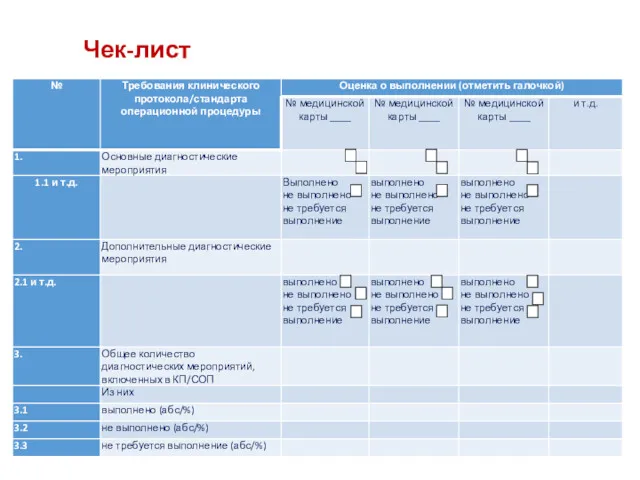
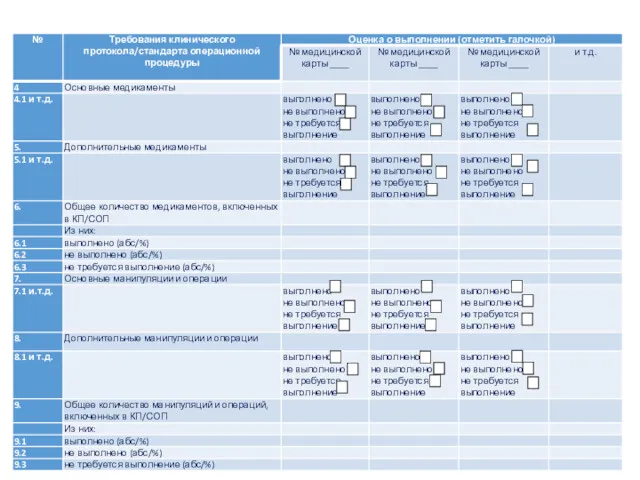
- 43. Чек-лист
- 44. Чек-лист
- 46. Скачать презентацию



















 Механизмы развития дыхательной недостаточности
Механизмы развития дыхательной недостаточности Қазақстандағы бүгінгі фармация
Қазақстандағы бүгінгі фармация Современный взгляд на кесарево сечение
Современный взгляд на кесарево сечение Ретинобластома. Определение понятия
Ретинобластома. Определение понятия Туберкулезный менингит
Туберкулезный менингит Українська медична термінологія
Українська медична термінологія Өкпенің ошақты туберкулезі
Өкпенің ошақты туберкулезі Физиология гемостаза
Физиология гемостаза Острый респираторный дистресс-синдром
Острый респираторный дистресс-синдром Производные фторхинолонов (ломефлоксацин, офлоксацин) и хиназолина (празозин). Требования к качеству, методы анализа
Производные фторхинолонов (ломефлоксацин, офлоксацин) и хиназолина (празозин). Требования к качеству, методы анализа Методы и режимы препарирования. Алгоритм выбора. Актуальные проблемы обезболивания а ортопедической стоматологии
Методы и режимы препарирования. Алгоритм выбора. Актуальные проблемы обезболивания а ортопедической стоматологии Красная волчанка
Красная волчанка Синдром желтухи у новорожденных и детей первого года жизни
Синдром желтухи у новорожденных и детей первого года жизни Наркология
Наркология Вирусные гепатиты на современном этапе
Вирусные гепатиты на современном этапе Сенильді психоздың дамуына әкелетін факторлар. Кәрі жастағы психикалық бұзылыстары бар науқастардың реабилитациясы
Сенильді психоздың дамуына әкелетін факторлар. Кәрі жастағы психикалық бұзылыстары бар науқастардың реабилитациясы Адам денесіндегі ұлпалар
Адам денесіндегі ұлпалар Астматикалық статус
Астматикалық статус Патогенна дія хімічних та біологічних факторів на організм. Роль спадковості в патології. (Лекція 4)
Патогенна дія хімічних та біологічних факторів на організм. Роль спадковості в патології. (Лекція 4) Болезнь Лайма
Болезнь Лайма Сахарный диабет, как социально-значимое заболевание
Сахарный диабет, как социально-значимое заболевание Risk for a health and ecological risk
Risk for a health and ecological risk Заготовка ЛРС. Общие правила сбора ЛРС
Заготовка ЛРС. Общие правила сбора ЛРС Великоустюгская центральная районная больница
Великоустюгская центральная районная больница Дәрігердің кәсіптік деформациясы
Дәрігердің кәсіптік деформациясы Роль медицинской сестры в подготовке пациента к плановой операции
Роль медицинской сестры в подготовке пациента к плановой операции Клиническая фармакология гипотензивных средств
Клиническая фармакология гипотензивных средств Геморрагиялық диатездер
Геморрагиялық диатездер