Содержание
- 2. В настоящее время в большинстве стран рак пищевода составляет около 2% – 3% от всех случаев
- 4. Уровень заболеваемости РП в европейских странах в среднем составляет 3,6 на 100 000 населения, исключая Великобританию(12,0)
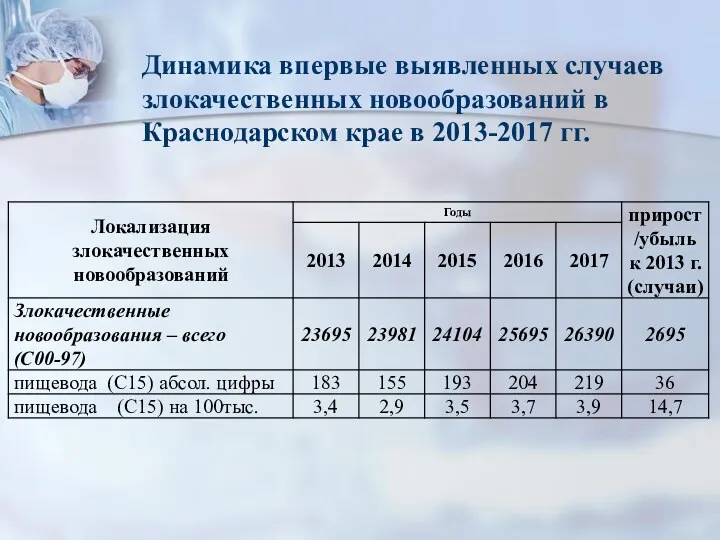
- 5. Динамика впервые выявленных случаев злокачественных новообразований в Краснодарском крае в 2013-2017 гг.
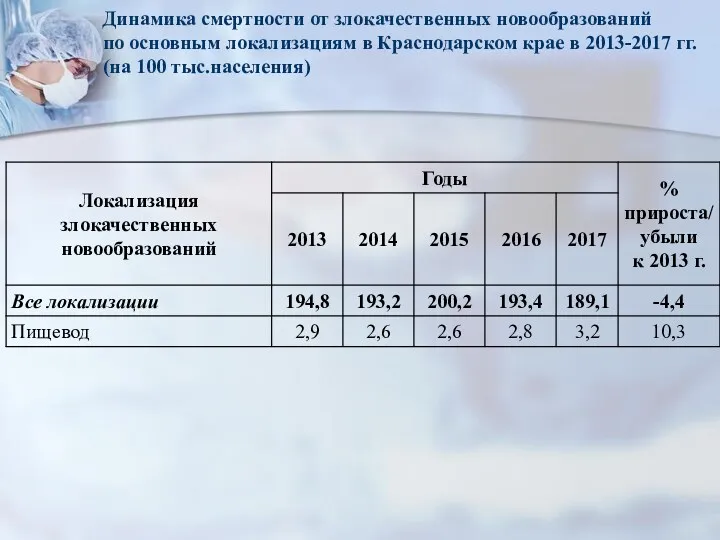
- 6. Динамика смертности от злокачественных новообразований по основным локализациям в Краснодарском крае в 2013-2017 гг. (на 100
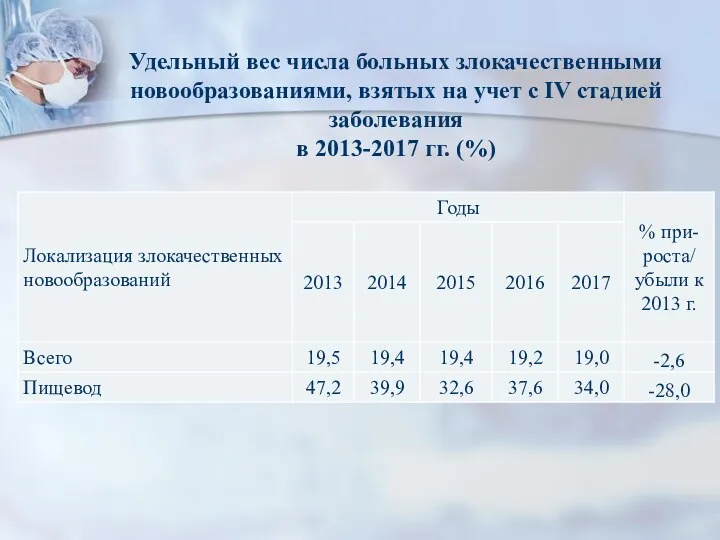
- 7. Удельный вес числа больных злокачественными новообразованиями, взятых на учет с IV стадией заболевания в 2013-2017 гг.
- 9. Синдром Пламмера – Винсона - хронический эзофагит, обусловленный недостатком железа, с фиброзными изменениями стенки пищевода и
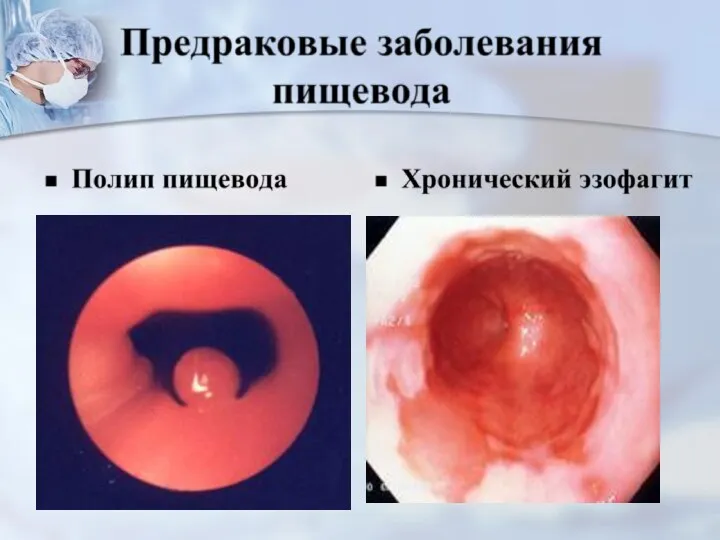
- 10. Предраковые заболевания пищевода Ахалазия – дилятация нижнегрудного отдела пищевода вследствие нарушения моторики и дисфункции кардиального жома
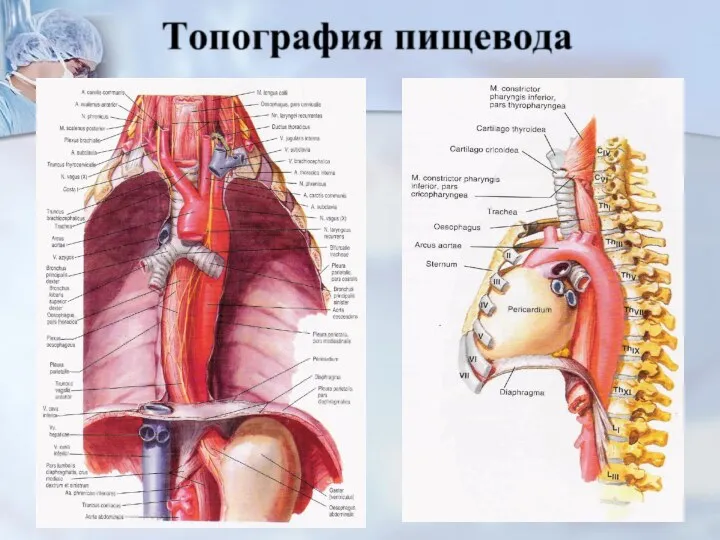
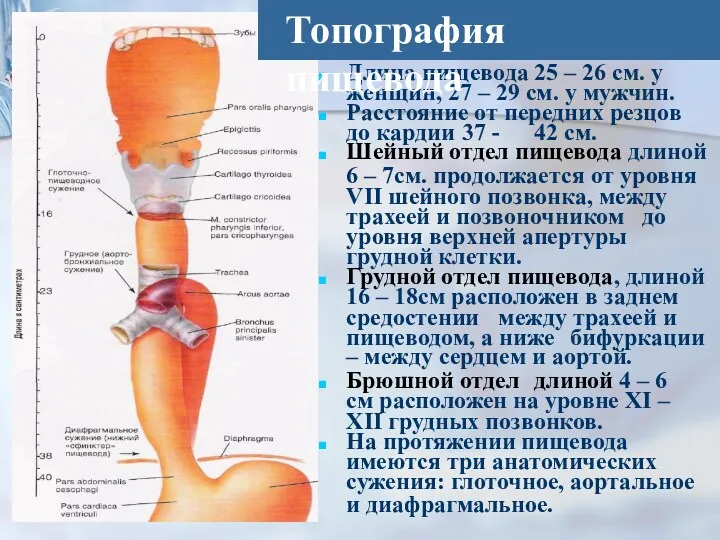
- 13. А Длина пищевода 25 – 26 см. у женщин, 27 – 29 см. у мужчин. Расстояние
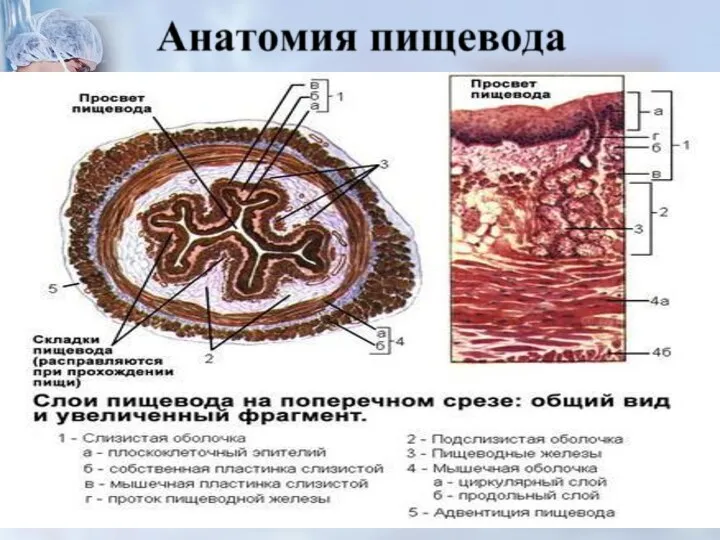
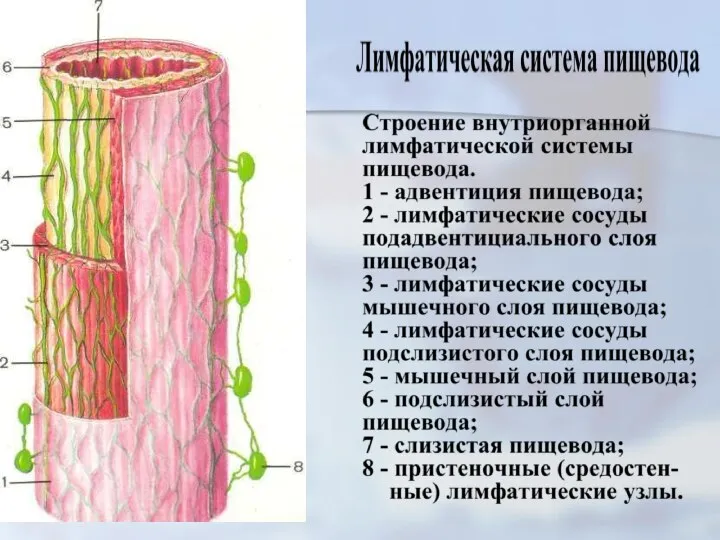
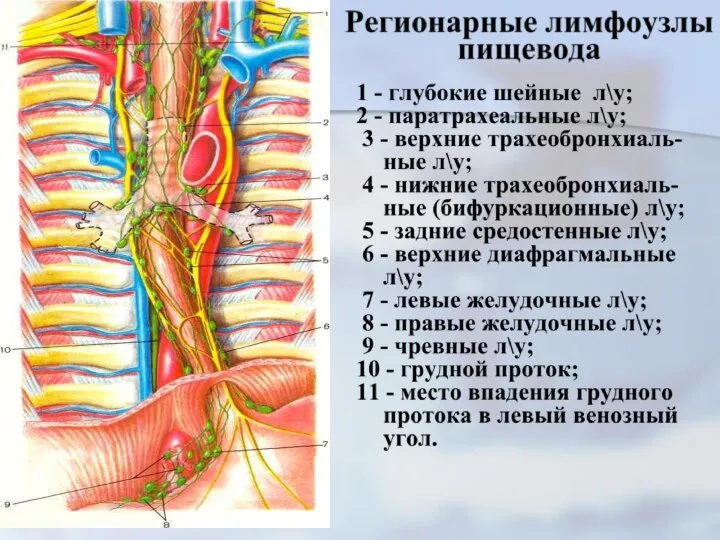
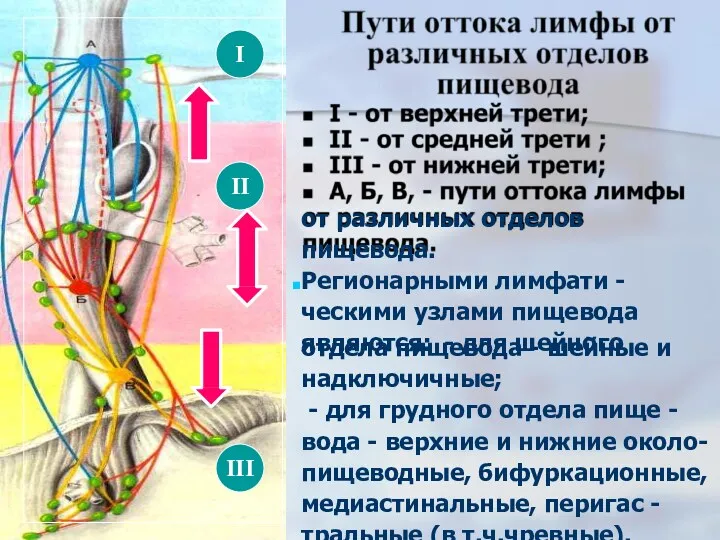
- 17. от различных отделов пищевода. Регионарными лимфати - ческими узлами пищевода являются: - для шейного отдела пищевода
- 18. Гистологическая классификация опухолей пищевода I. Эпителиальные опухоли. А. Доброкачественные – плоскоклеточная папиллома. Б. Злокачественные: плоскоклеточный рак,
- 19. Гистологическая классификация опухолей пищевода Плоскоклеточным рак составляет 60% – 90% злокачественных опухолей пищевода, аденокар- цинома встречается
- 20. Рак пищевода обладает высоким метастатическим потенциалом, метастазирует лимфогенным, гематогенным и имплантационным путями. Основным путем метастазирования является
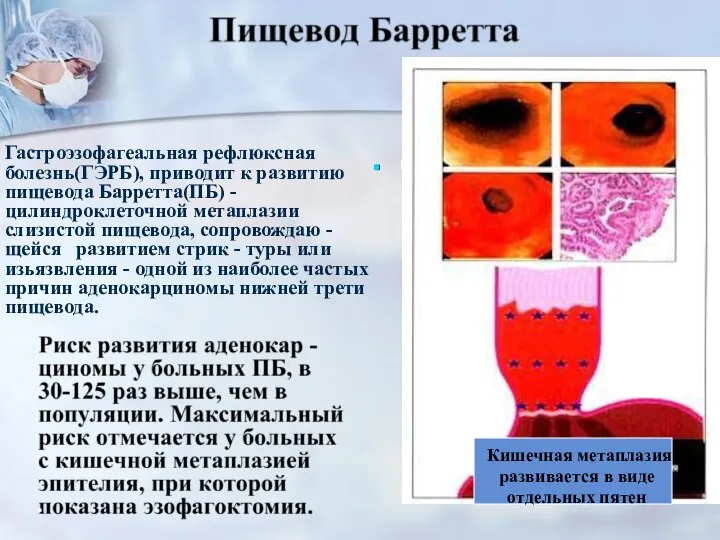
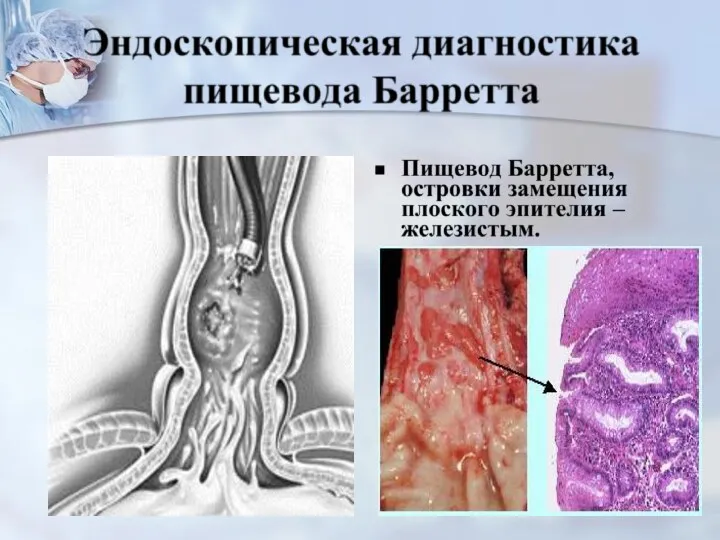
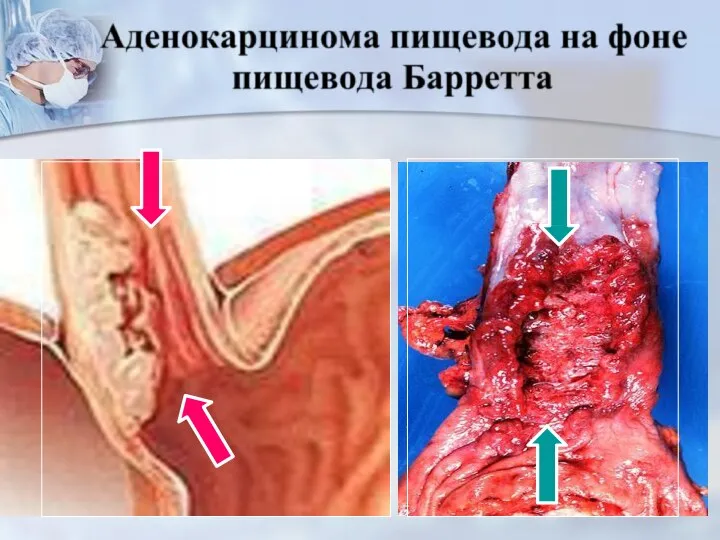
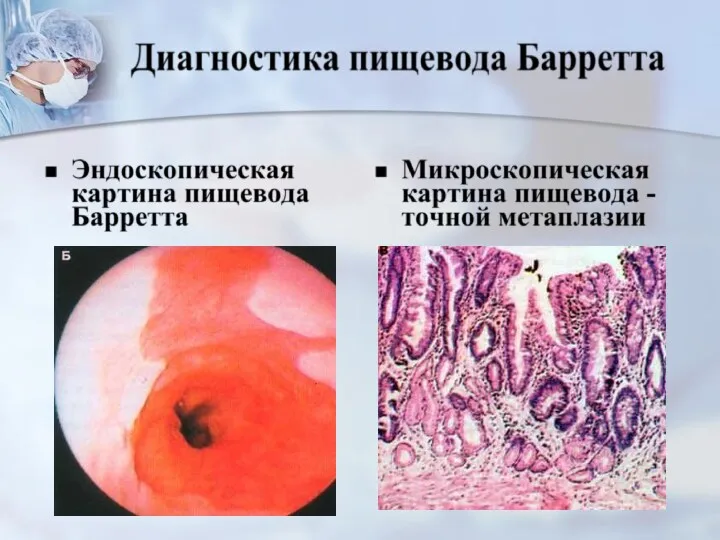
- 21. Гастроэзофагеальная рефлюксная болезнь(ГЭРБ), приводит к развитию пищевода Барретта(ПБ) - цилиндроклеточной метаплазии слизистой пищевода, сопровождаю - щейся
- 22. ПБ на фоне гастроэзофагеальной рефлюксной болезни(ГЭРБ) встречается у мужчин в 2,5 – 4 раза чаще, чем
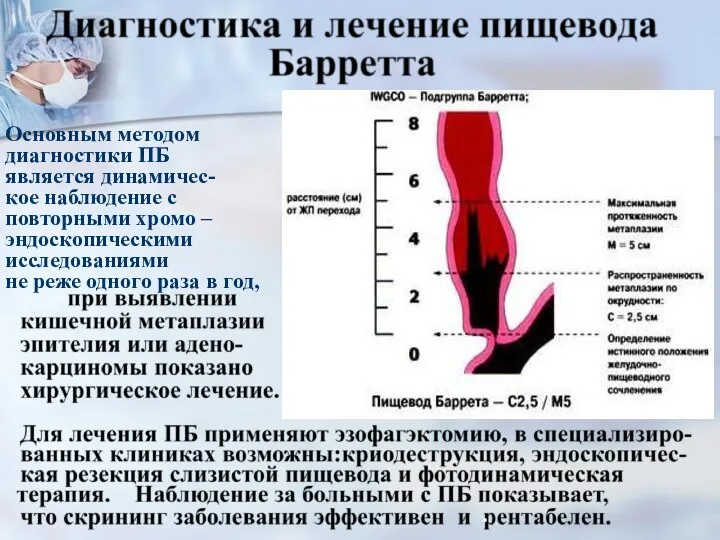
- 23. Основным методом диагностики ПБ является динамичес- кое наблюдение с повторными хромо – эндоскопическими исследованиями не реже
- 26. .
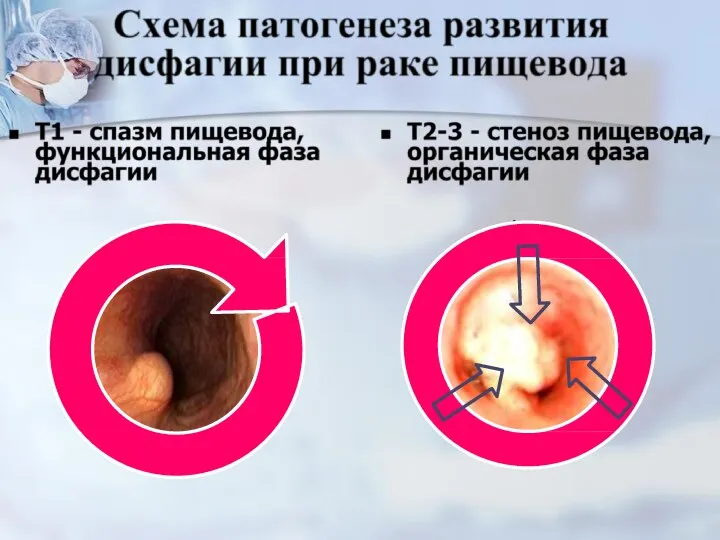
- 28. Ведущий симптом рака пищевода – дисфагия, ощущение затрудненного прохождения пищи по пищеводу(за грудиной). Дисфагия возникает относительно
- 29. Патогенез развития дисфагии при раке пищевода При поражении 2/3 окружности стенки пищевода и сужении его просвета
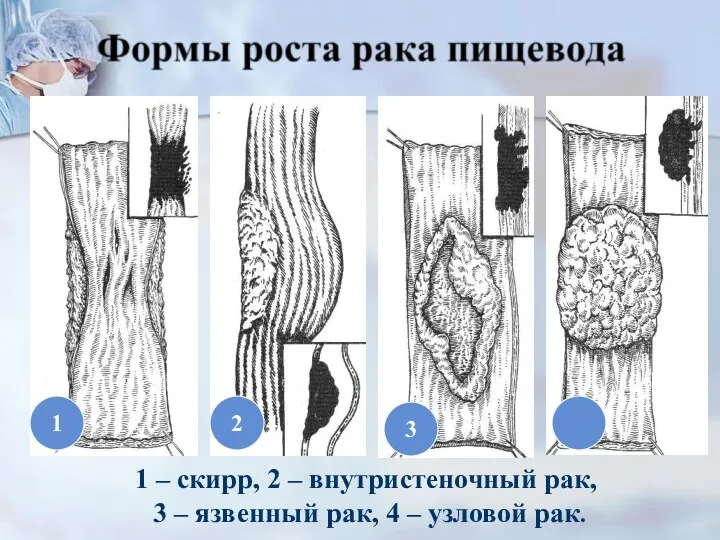
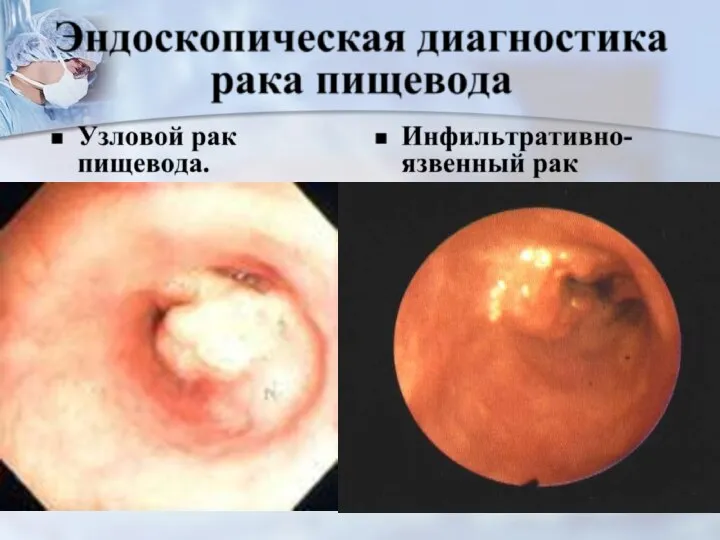
- 31. 2 4 3 1 1 – скирр, 2 – внутристеночный рак, 3 – язвенный рак, 4
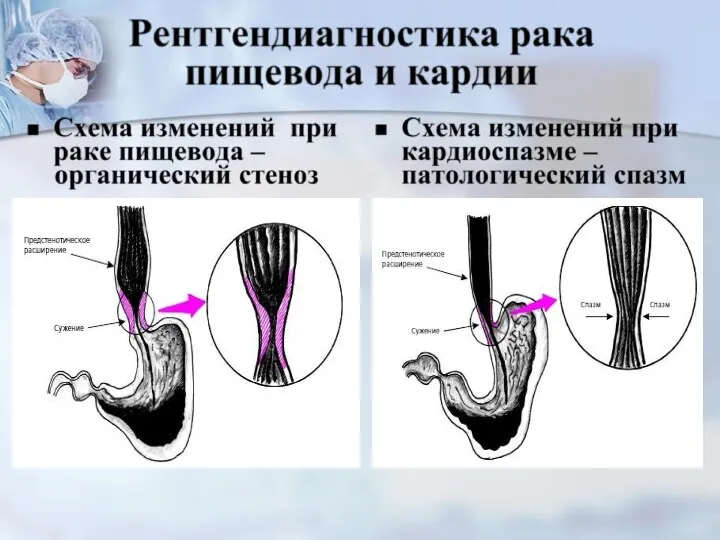
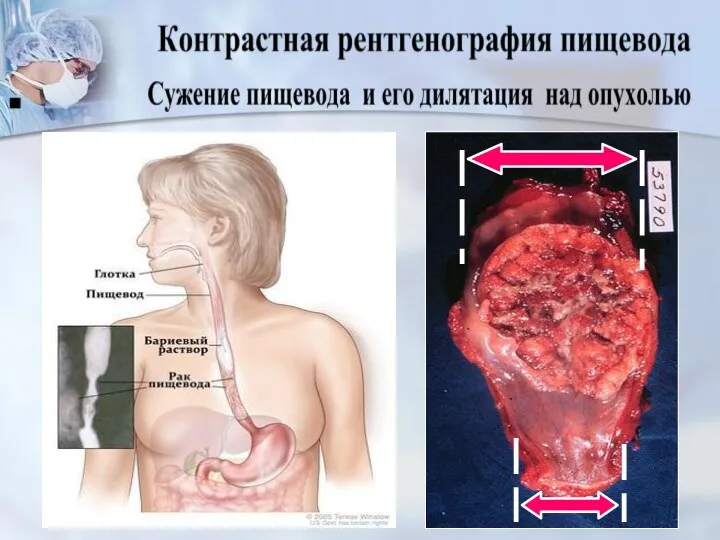
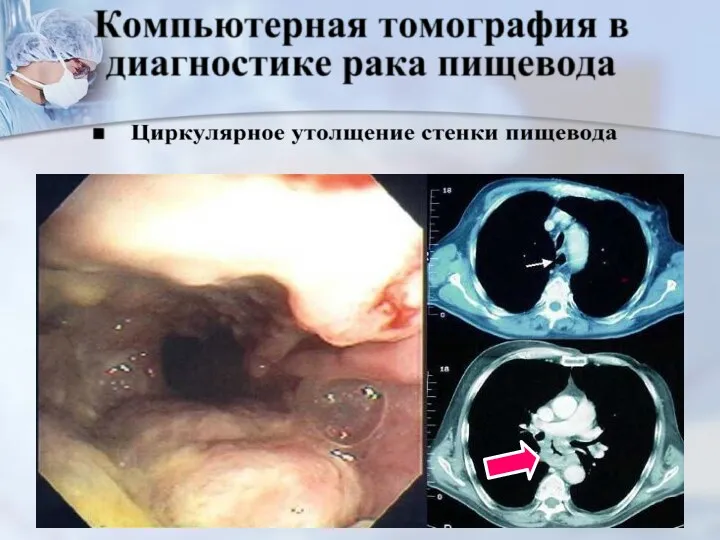
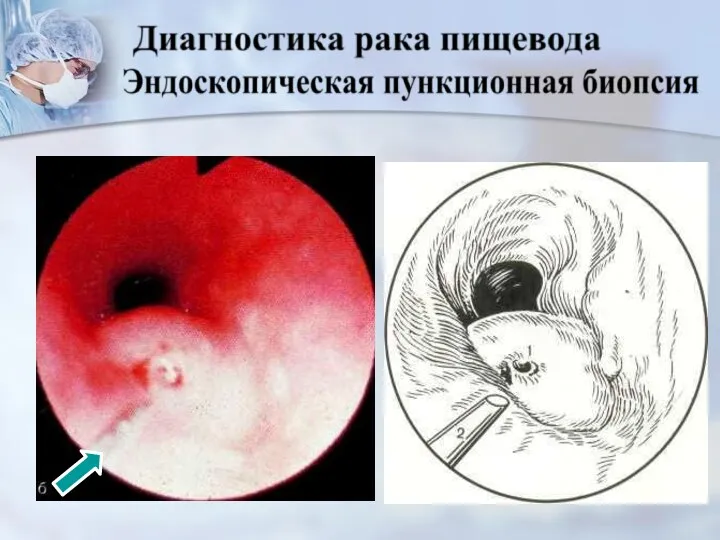
- 32. 1. Установление наличия внутри или внепищеводного заболевания, суживающего его просвет – контрастная рентгенография, эзофагогастроскопия. 2. Дифференцировка
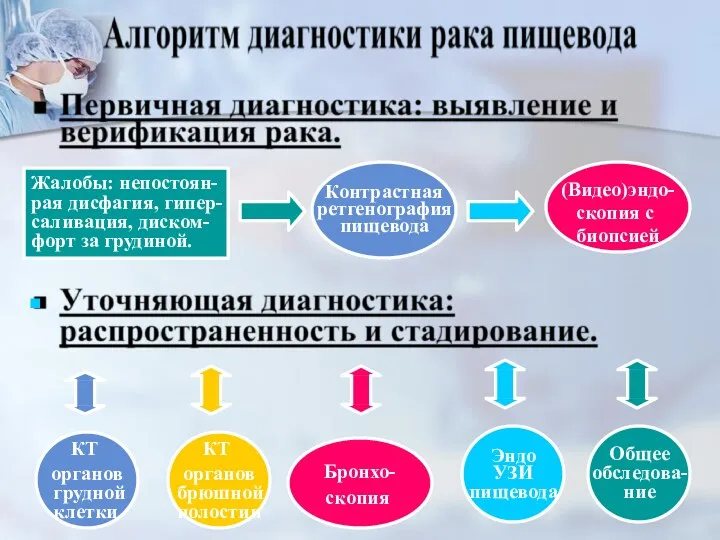
- 33. Жалобы: непостоян- рая дисфагия, гипер- саливация, диском- форт за грудиной. Контрастная ретгенография пищевода (Видео)эндо- скопия с
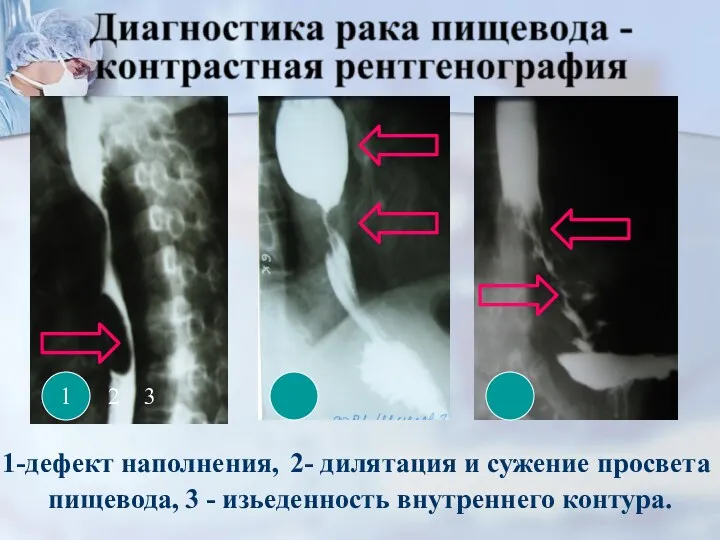
- 35. 1 2 3 1-дефект наполнения, 2- дилятация и сужение просвета пищевода, 3 - изьеденность внутреннего контура.
- 38. пищевода
- 42. Т – первичная опухоль Тx – недостаточно данных для оценки первичной опухоли. Т0 – первичная опухоль
- 43. М – отдаленные метастазы Мx – недостаточно данных для определения отдаленных метастазов. М0 – нет признаков
- 44. Классификация рака пищевода по стадиям Рак in situ, 0-стадия, при которой опухоль располагается только в слизистой
- 48. 1 2 3
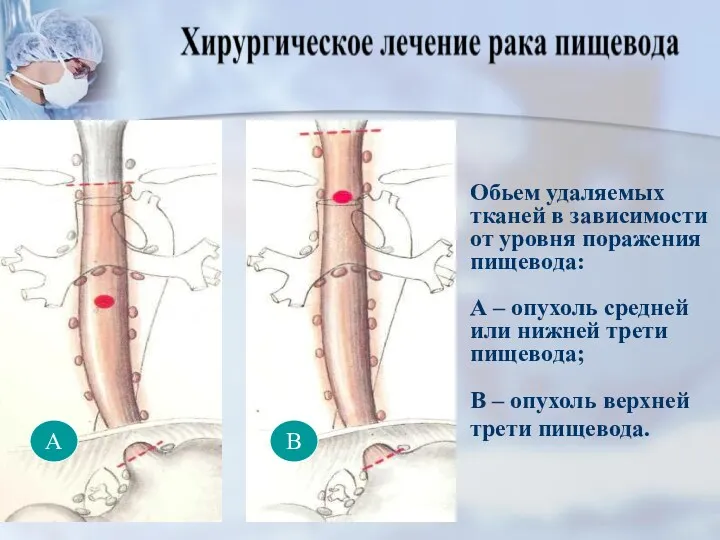
- 49. Ааа Обьем удаляемых тканей в зависимости от уровня поражения пищевода: А – опухоль средней или нижней
- 52. В А
- 61. Предоперационная лучевая терапия направлена на девитализацию опухолевых клеток и уменьшение размеров опухоли. Повреждение Элементов опухоли в
- 62. Лечение рака пищевода Стадия I-IIA (Т1–3N0M0) Стадия IIВ – III (Т1–2N1M0; Т3N1M0) Стадия III (Т4 или
- 63. Стадия I-IIA (Т1–3N0M0) Хирургический -основной метод лечения Химиолучевая терапия (локализация опухоли в шейном отделе пищевода, функциональные
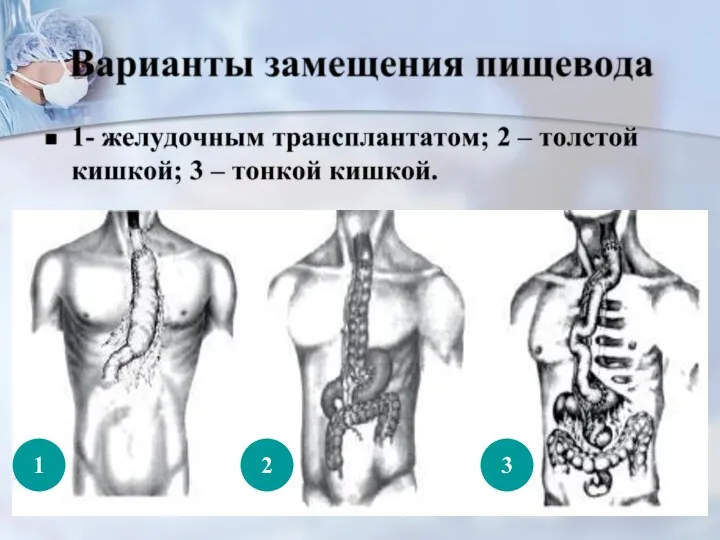
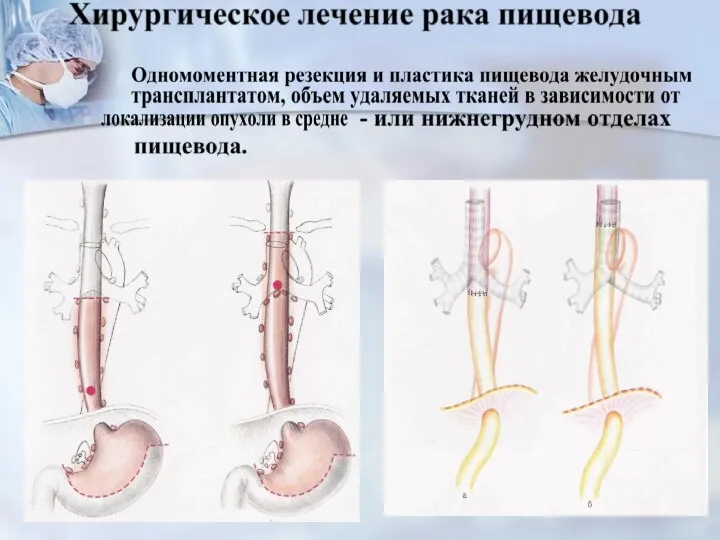
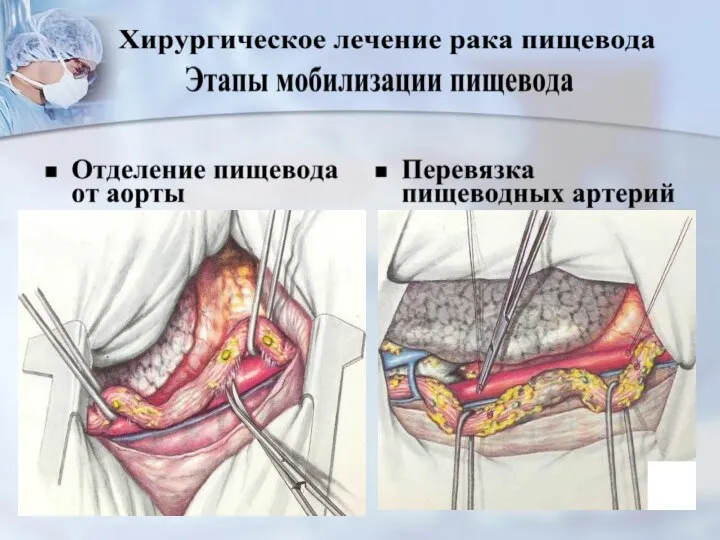
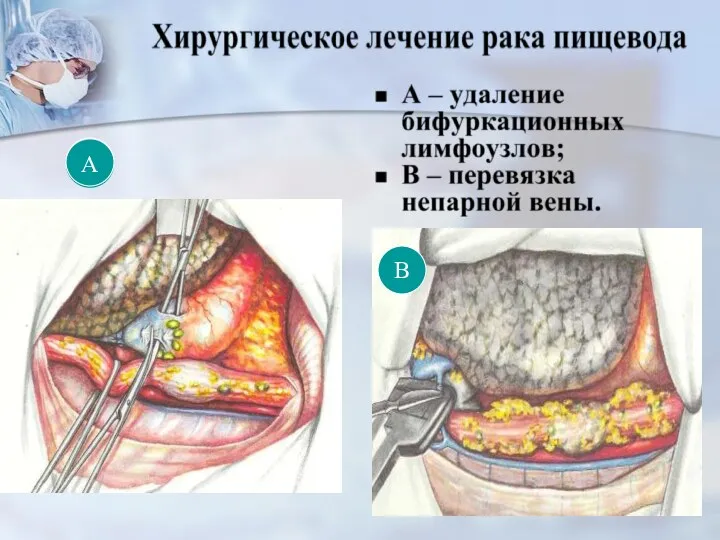
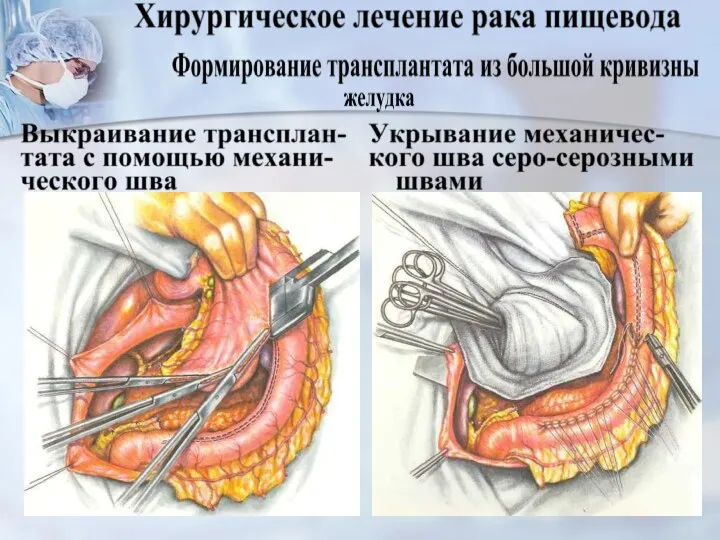
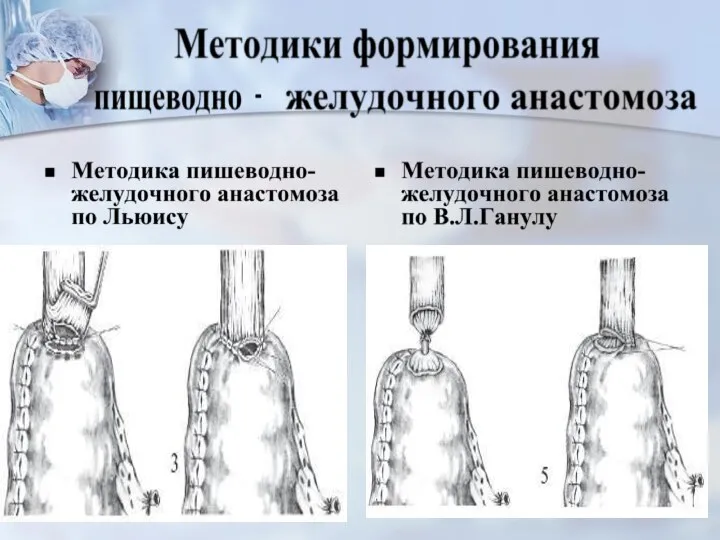
- 64. Стадия I-IIA (Т1–3N0M0)виды операций -трансторакальная субтотальная резекция пищевода с одном. внутриплев.пластикой стеблем желудка или сегм. толстой
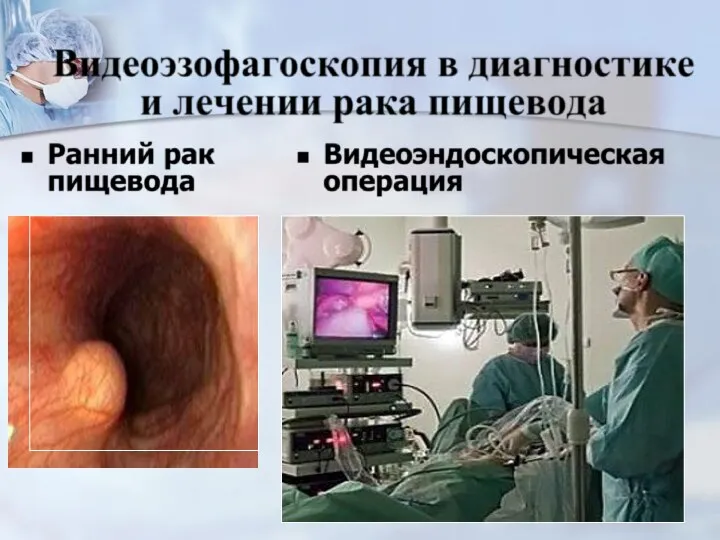
- 65. Виды операций эндоскопическая резекция -при росте опухоли в пределах слизистой оболочки (T1) при carcinoma in situ
- 66. Стадия IIВ – III (Т1–2N1M0; Т3N1M0) Варианты лечения: хирургическое; предоперационная химиотерапия + хирургическое лечение; предоперационная химиолучевая
- 67. Предоперационная (неоадъювантная) химиотерапия Достоверно эффективна при аденокарциноме, при плоскоклеточном раке небольшая эффективность. При аденокарциноме нижнегрудного отдела
- 68. Режимы химиотерапии -Цисплатин 75 мг/м2 1 день, 5-фторурацил75 0мг/м2 , 1-5 дни (120 часовая инфузия), каждые
- 69. Послеоперационная (адъювантная) химиотерапия При плоскоклеточном раке пищевода ее проведение не показано. При аденокарциноме нижнегрудного отдела пищевода
- 70. Предоперационная химиолучевая терапия Достоверна эффективна как при плоскоклеточном раке, так и при аденокарциноме. Перед химиолучевой терапией
- 71. Послеоперационная химиолучевая терапия Послеоперационная химиолучевая терапия может быть проведена пациентам при наличии микро- или макроскопической резидуальной
- 72. Самостоятельная химиолучевая терапия Применяется при невозможности проведения хирургического лечения. Позволяет достичь сопоставимой 5-летней общей выживаемости –
- 73. Стадия III (Т4 или множественные метастазы в регионарные лимфоузлы средостения) НЕРЕЗЕКТАБЕЛЬНЫЙ МЕСТНО‑РАСПРОСТРАНЕННЫЙ РАК ПИЩЕВОДА Основным методом
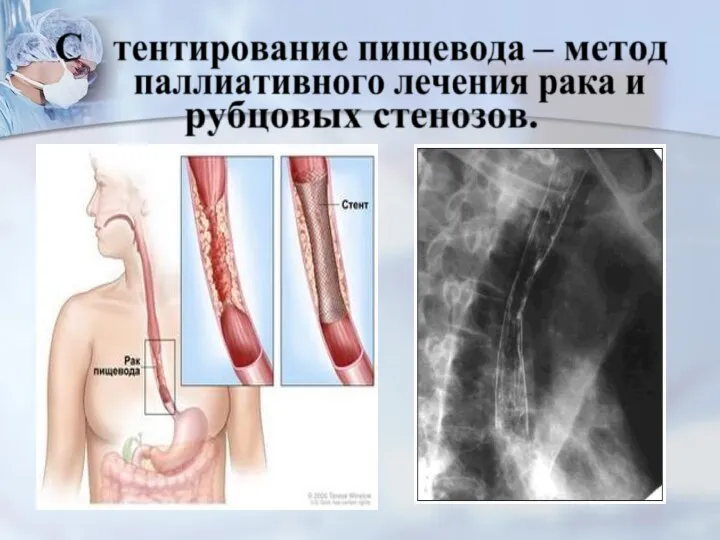
- 74. IV стадия восстановление проходимости пищевода (стентирование, реканализация) проведение химиотерапии: цисплатин, фторпиримидины, таксаны. (При аденокарциномах также эффективны
- 75. Паллиативное лечение Цель-продление жизни с удовлетворительным качеством, -эндоскопические процедуры с целью устранения дисфагии(баллонная дилатация, электро-, аргонно-плазменная
- 76. Показатели выживаемости при раке пищевода прямо зависят от наличия или отсутствия лимфогенных метастазов: при N0 –
- 77. По данным МНИОИ им. П.А. Герцена, при поражении верхней трети пищевода после хирургического лечения практически все
- 79. Скачать презентацию








































 Веноздық жүйе
Веноздық жүйе Организация деятельности медицинской сестры перевязочного кабинета
Организация деятельности медицинской сестры перевязочного кабинета Комбинированные оральные контрацептивы (КОК)
Комбинированные оральные контрацептивы (КОК) Основы трансфузиологии. Осложнения при переливании крови
Основы трансфузиологии. Осложнения при переливании крови Балалардағы асқазан мен он екі елі ішектің жара аурулары. Синдромдық негізде диагностика, ем және профилактика жүргізу
Балалардағы асқазан мен он екі елі ішектің жара аурулары. Синдромдық негізде диагностика, ем және профилактика жүргізу Редкие формы ранних токсикозов
Редкие формы ранних токсикозов Смешанные дистрофии. Нарушение минерального обмена. Образование камней
Смешанные дистрофии. Нарушение минерального обмена. Образование камней Смерть клиническая и биологическая
Смерть клиническая и биологическая Физическая реабилитация при заболеваниях сердечно-сосудистой системы у беременных
Физическая реабилитация при заболеваниях сердечно-сосудистой системы у беременных Жидкие лекарственные формы. Особенности использования различных форм
Жидкие лекарственные формы. Особенности использования различных форм 1 декабря - Всемирный день борьбы с синдромом приобретенного иммунодефицита (СПИД)
1 декабря - Всемирный день борьбы с синдромом приобретенного иммунодефицита (СПИД) Острые и хронические гломерулонефриты
Острые и хронические гломерулонефриты Экстракттар казакша
Экстракттар казакша Асептика и антисептика
Асептика и антисептика Средства, влияющие на холинергические синапсы
Средства, влияющие на холинергические синапсы Narcology: evolution, definition, subject objectives and methods. Substance abuse treatment
Narcology: evolution, definition, subject objectives and methods. Substance abuse treatment Внутриутробная инфекция
Внутриутробная инфекция Центральная нервная система
Центральная нервная система Жидкие лекарственные формы
Жидкие лекарственные формы Этапы организации Мониторинга факторов риска (реализации ЗОЖ). Обследование выборки. Образование идентификатора члена выборки
Этапы организации Мониторинга факторов риска (реализации ЗОЖ). Обследование выборки. Образование идентификатора члена выборки Острое инфекционное заболевание скарлатина
Острое инфекционное заболевание скарлатина Участие медицинской сестры в профилактике инсульта
Участие медицинской сестры в профилактике инсульта Гидрозольные препараты для экспрессной бесприборной диагностики различных заболеваний человека и животных
Гидрозольные препараты для экспрессной бесприборной диагностики различных заболеваний человека и животных Инновационный биоревитализант M.A.IN HYAL на основе Рекомбинантного Ангиогенина
Инновационный биоревитализант M.A.IN HYAL на основе Рекомбинантного Ангиогенина Liver, Biliary, and Exocrine Pancreas Diseases
Liver, Biliary, and Exocrine Pancreas Diseases Наркотическая зависимость от метамфетамина и экстази
Наркотическая зависимость от метамфетамина и экстази
 Вітамін С - потужний антиоксидант
Вітамін С - потужний антиоксидант