Содержание
- 2. Определение сепсиса? Этиология сепсиса? Патогенез сепсиса? Критерии диагностики сепсиса? Билет № 13
- 3. Определение: выбери любимое Сепсис – это генерализованное воспаление, возникающее в ответ на избыток микроорганизмов и/или их
- 4. Сепсис по А.Ф.Билибину (1967) Билибин описывает сепсис как «инфекционное заболевание лишенное типичных черт инфекционного заболевания». Сходство
- 5. Сепсис: добавь прилагательное характер течения (молниеносный, острый, подострый, хронический, рецидивирующий) характеристика и локализация входных ворот (раневой,
- 6. Этиология Грам (-) – 25-30% E. coli – 9-27% Pseudomonas aeruginosa – 8-15% Klebsiella pneumonia –
- 7. Бактериемия Наличие живых бактерий в крови Сепсис – 17% Тяжелый сепсис – 25% Септический шок –
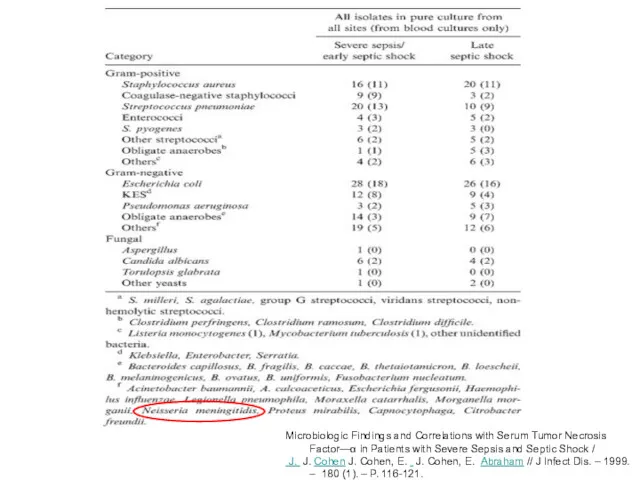
- 8. Microbiologic Findings and Correlations with Serum Tumor Necrosis Factor—α in Patients with Severe Sepsis and Septic
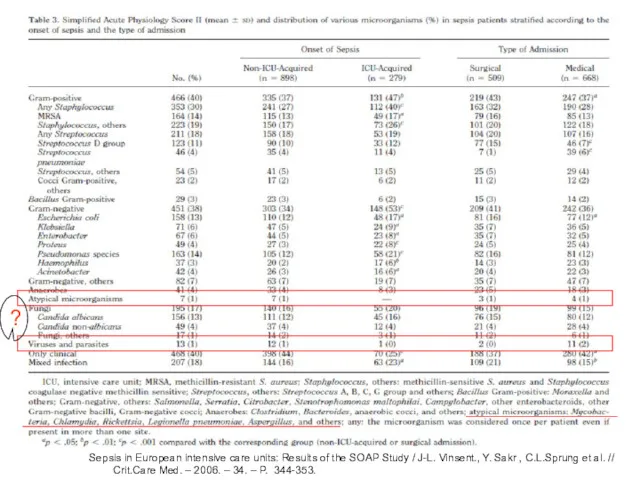
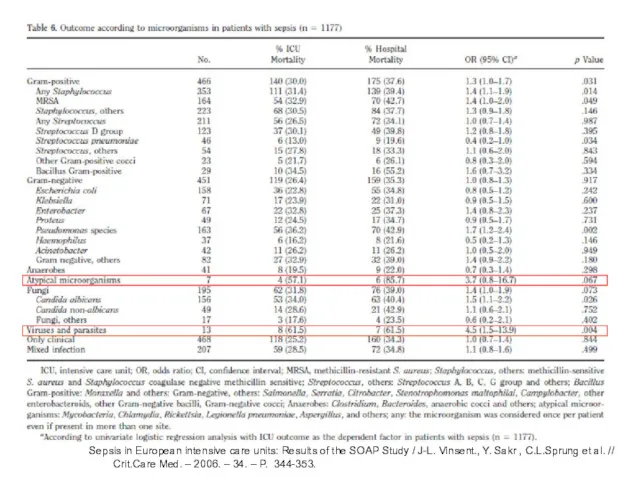
- 9. Sepsis in European intensive care units: Results of the SOAP Study / J-L. Vinsent., Y. Sakr
- 10. Sepsis in European intensive care units: Results of the SOAP Study / J-L. Vinsent., Y. Sakr
- 11. Некоторые компоненты нормальной микрофлоры человека
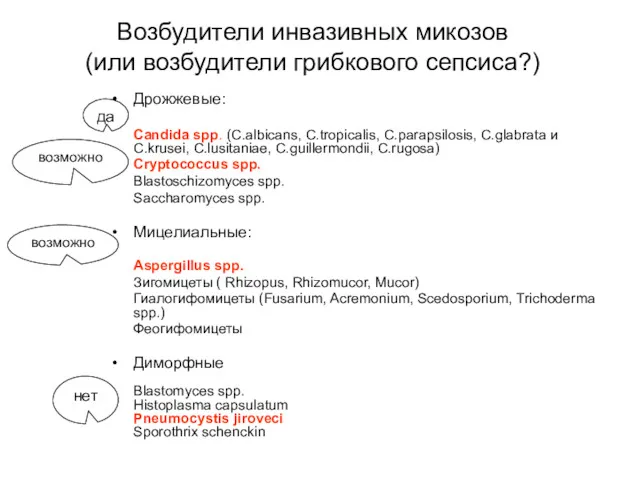
- 12. Возбудители инвазивных микозов (или возбудители грибкового сепсиса?) Дрожжевые: Candida spp. (C.albicans, C.tropicalis, C.parapsilosis, C.glabrata и C.krusei,
- 13. Вирусы и сепсис Облигатные патогены Клеточная стенка – нет Аппарат трансляции белка - нет Эндотоксин –
- 16. Патогенез Современные представления о патогенезе основаны на концепции синдрома системной воспалительной реакции (ССВР) как главной составляющей
- 17. Патогенез 2 Иммунная система: палеоиммунитет (врожденный, древний, базисный – секунды, минуты, часы) и неоиммунитет (адаптивный, приобретенный
- 18. Патогенез 3 Количество микроорганизмов, живущих на планете, так велико (а многие до сих пор не известны),
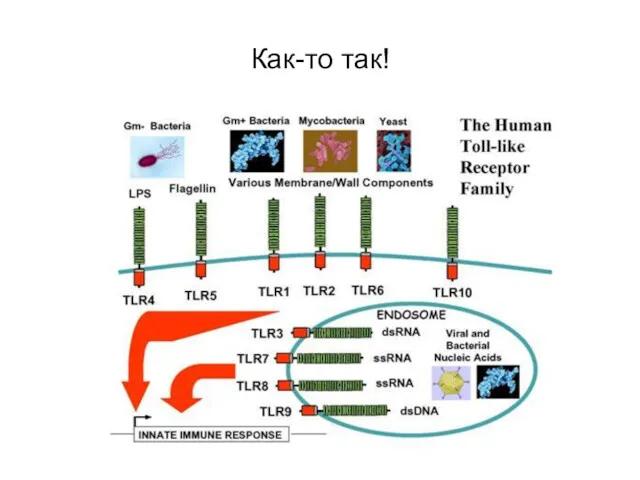
- 19. Патогенез 4 Среди всех PRR ключевая роль принадлежит TLR - толл-подобным рецепторам (TLR – Toll-like receptor).
- 20. Как-то так!
- 21. Патогенез 5 Ключевая роль в координации воспалительных механизмов принадлежит цитокинам. Они образуются почти всеми клетками организма
- 22. Патогенез 6 SIRS – Sistemic Inflammatory Response Syndrome (концепция гипервоспаления) CARS - Compensatory Antiinflammatory Reaction Syndrome
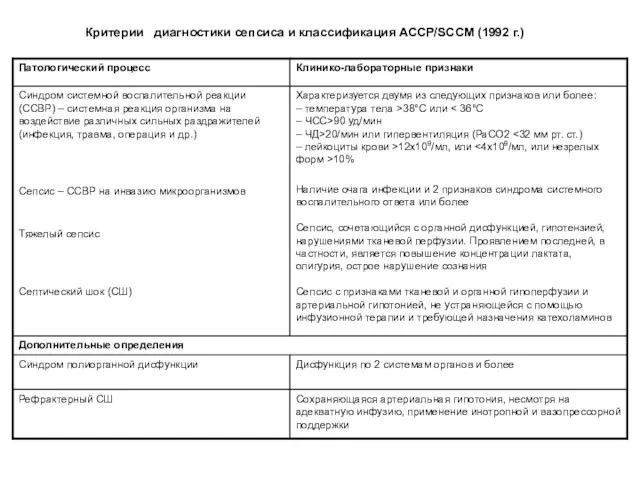
- 23. Критерии диагностики сепсиса и классификация АССР/SCCM (1992 г.)
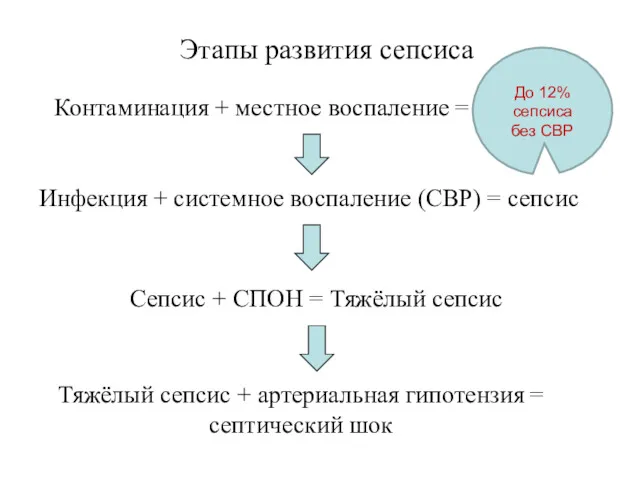
- 24. Контаминация + местное воспаление = инфекция Инфекция + системное воспаление (СВР) = сепсис Сепсис + СПОН
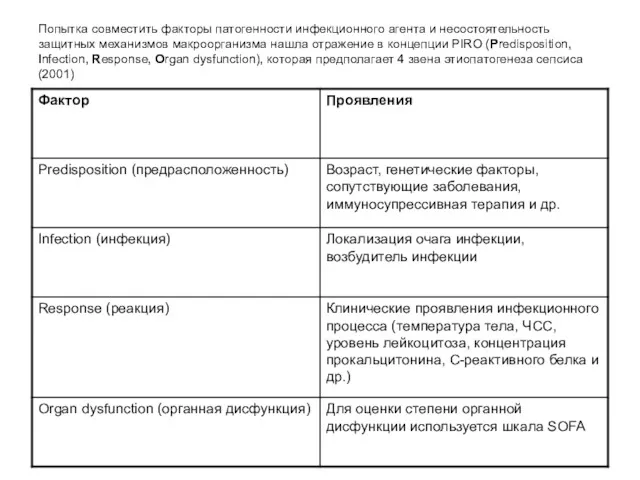
- 25. Попытка совместить факторы патогенности инфекционного агента и несостоятельность защитных механизмов макроорганизма нашла отражение в концепции PIRO
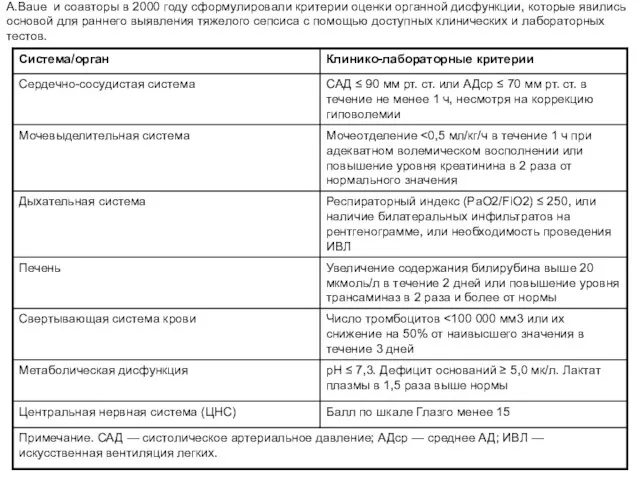
- 26. A.Baue и соавторы в 2000 году сформулировали критерии оценки органной дисфункции, которые явились основой для раннего
- 27. Клиника сепсиса (или нет?) Лихорадка - главный диагностический признак сепсиса (повышенный уровень IL - 1 и
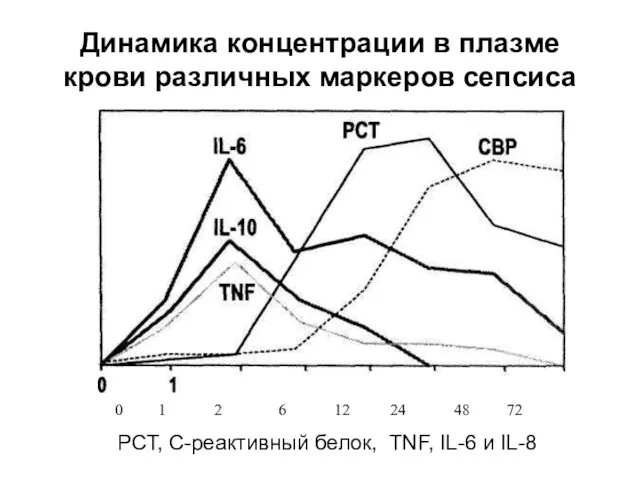
- 28. Динамика концентрации в плазме крови различных маркеров сепсиса РСТ, С-реактивный белок, TNF, IL-6 и IL-8 0
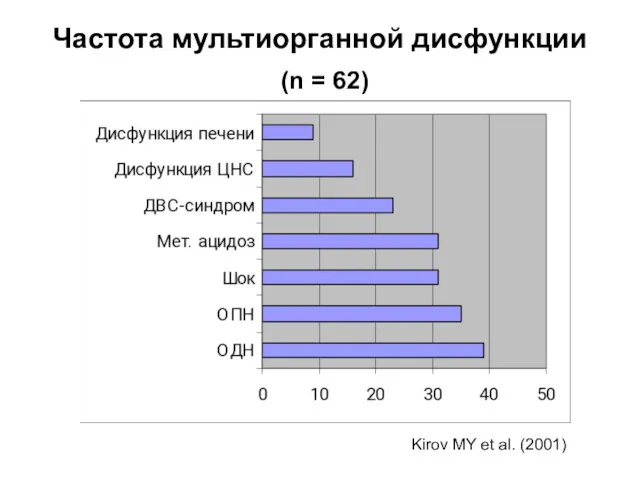
- 29. Частота мультиорганной дисфункции (n = 62) Kirov MY et al. (2001)
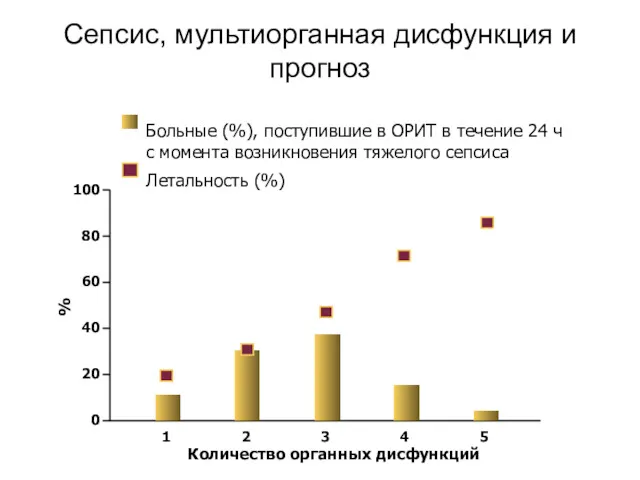
- 30. Сепсис, мультиорганная дисфункция и прогноз 1 3 5 100 80 60 40 20 0 Количество органных
- 31. Сепсис для «чайников» Сепсис = очаг инфекции + СВР ± СПОН ± СШ Диагностика: клиника +
- 32. Сепсис для «чайников» (версия 2.0) Сепсис = очаг инфекции + ССВО ± СПОН ± СШ Диагностика:
- 33. Не доказана эффективность Селен Эритропоетин Глюкокортикоиды Гранулоцит-стимулирующий фактор Пентаглобин? Коллоиды? Дротрекогин – доказан, но снят с
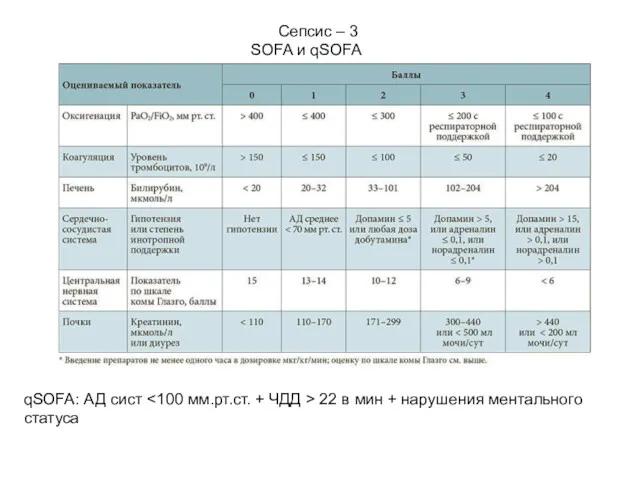
- 34. Сепсис – 3 SOFA и qSOFA qSOFA: АД сист 22 в мин + нарушения ментального статуса
- 36. Скачать презентацию




















 Диабетическая ретинопатия
Диабетическая ретинопатия Синдром полиорганной недостаточности. Метаболические основы. Принципы интенсивной терапии
Синдром полиорганной недостаточности. Метаболические основы. Принципы интенсивной терапии Гигиена детей и подростков
Гигиена детей и подростков Мышечная дистрофия
Мышечная дистрофия Стратегия лекарственного обеспечения населения Российской Федерации на период до 2025 года: намерения и реальность
Стратегия лекарственного обеспечения населения Российской Федерации на период до 2025 года: намерения и реальность Өкпе гистологиясы
Өкпе гистологиясы Equipment and instruments of dental clinic
Equipment and instruments of dental clinic Профессиональные заболевания лешмейкера
Профессиональные заболевания лешмейкера Несеп зәр шығару жүйесі
Несеп зәр шығару жүйесі Донорский марафон МарГУ Не бойся спасти чью-то жизнь!
Донорский марафон МарГУ Не бойся спасти чью-то жизнь! Биологическое оружие - оспа
Биологическое оружие - оспа Эпидемический паротит
Эпидемический паротит Метаболизм. Биосинтез белка
Метаболизм. Биосинтез белка Операции на почках
Операции на почках Гипоксия. Классификация гипоксий
Гипоксия. Классификация гипоксий Хроническая болезнь почек
Хроническая болезнь почек Фармацевтическая номенклатура
Фармацевтическая номенклатура Пороки осанки. Сколиоз. Причины, клинические признаки, методы лечения, профилактика и реабилитация
Пороки осанки. Сколиоз. Причины, клинические признаки, методы лечения, профилактика и реабилитация Заболевания прямой кишки
Заболевания прямой кишки Острая боль и ее лечение
Острая боль и ее лечение 1 жасқа дейінгі балаларды табиғи тамақтандыру
1 жасқа дейінгі балаларды табиғи тамақтандыру Морфологія оборотного і необоротного ушкодження клітин і тканин. Внутрішньоклітинне накопичення білків, вуглеводів та ліпідів
Морфологія оборотного і необоротного ушкодження клітин і тканин. Внутрішньоклітинне накопичення білків, вуглеводів та ліпідів Жизнь без ВИЧ
Жизнь без ВИЧ Аритмия. Причины аритмий
Аритмия. Причины аритмий Сравнение санирующей слухосохраняющей операции на среднем ухе с традиционной радикальной операцией
Сравнение санирующей слухосохраняющей операции на среднем ухе с традиционной радикальной операцией Спонтанды пневмоторакс кезіндегі визуалды зерттеу әдістері
Спонтанды пневмоторакс кезіндегі визуалды зерттеу әдістері Хирургический инструментарий
Хирургический инструментарий Повреждения, нанесённые тупыми предметами
Повреждения, нанесённые тупыми предметами