Система допуска на рынок Республики Казахстан безопасных, эффективных и качественных лекарственных средств презентация
Содержание
- 2. Содержание: Государственное регулирование в области здравоохранения в Республике Казахстан Структура системы здравоохранения в Республике Казахстан Структура
- 3. Государственное регулирование в области здравоохранения в Республике Казахстан Государственное регулирование в области здравоохранения осуществляется путем проведения
- 4. Государственное регулирование в области здравоохранения в Республике Казахстан измененийврегистрационноедосьеЛС, ИМНиМТ, отдельныхвидовпродукцииивеществ, оказывающихвредноевоздействиеназдоровьечеловека; ?6) подтверждениясоответствиятоваров(работ, услуг) вобластиздравоохранениятребованиям,
- 5. Структура системы здравоохранения в Республике Казахстан Министерство здравоохранения Республики Казахстан Комитетгосударственногосанитарно-эпидемиологическогонадзора Комитетмедицинскихуслуг Комитетконтролямедицинскойифармацевтическойдеятельности Организации, находящиесявведенииМЗ(НИИ, Медицинскиеобразовательныеорганизации,
- 6. Структура системы государственного контроля в сфере обращения ЛС Государственный контроль в сфере обращения ЛС и обеспечение
- 7. История создания. Основные функции РГП на ПХВ «Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и
- 8. Функции Национального центра Проведениеэкспертизылекарственныхсредств, изделиймедицинскогоназначенияимедицинскойтехникипригосударственнойрегистрации ОсуществлениесертификацииЛС РазработкаГосударственнойфармакопеиРК ПроведениедоклиническихиспытанийЛСииспытанийнабиоэквивалентностьЛС УчастиевфармаконадзореимониторингепобочныхдействийЛС Участитевразработкенормативныхправовыхактов Осуществлениеэкспертизырекламныхматериалов ВедениебазыданныхГосударственногореестраЛС Изданиеинформационно-аналитическогожурнала«ФармацияКазахстана» Ведениеведомственногоархиварегистрационныхдосье
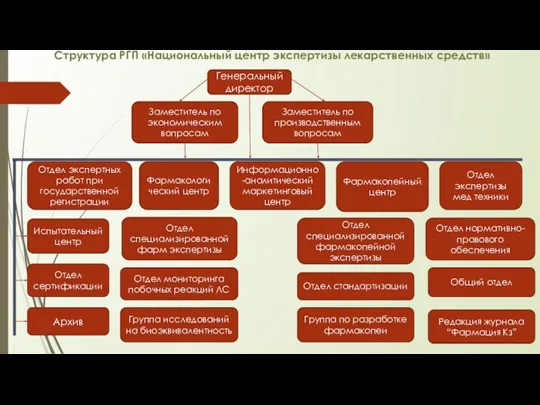
- 9. Структура РГП «Национальный центр экспертизы лекарственных средств» Генеральный директор Заместитель по производственным вопросам Заместитель по экономическим
- 10. Испытательный центр ИЦ аккредитован в государственной системе технического регулирования РК на соответствие требованиям СТ РК ИСО/МЭК
- 11. Структурные подразделения ИЦ Республиканскаяиммунобиологическаялаборатория; Физико-химическаялаборатория; Микробиологическаялаборатория; Токсикологическаялаборатория; Лабораториянеклиническихиклиническихисследований; Виварий.
- 12. Фармакопейный центр Осуществлениенаучнойспециализированнойфармацевтическойэкспертизыдокументоврегистрационногодосье РазработкаиподготовкакизданиюГосударственнойфармакопеиРК ВнесениепредложенийпоизменениямидополнениямвГосударственныйреестрлекарственныхсредствРеспубликиКазахстан(внесениеновыхэффективныхибезопасныхлекарственныхсредствиисключениеустаревших, малоэффективныхпрепаратов)
- 13. Фармакологический центр ОсуществлениенаучнойспециализированнойфармакологическойэкспертизыЛСнапредметихбезопасностииэффективности; Разработкавпределахсвоейкомпетенциимер, направленныхнаобеспечениевнутреннегорынкаРКбезопасными, эффективнымиикачественнымиЛС ОсуществлениенаучногоруководстваорганизациейикоординациейработподоклиническимиклиническимисследованиямфармакологическихилекарстнныхсредстввсоответствиисGLP иGСP, включаяисследованиебиоэквивалентностивоспроизведенныхпрепаратов; Фармаконадзоримониторингпобочногодействиялекарственныхсредствиразработкамерпоснижениюрискаопасностиприменениялекарственныхсредсв;
- 14. Подтверждение соответствия лекарственных средств В соответствии со статьей 17 Кодекса РК «О здоровье народа и системе
- 15. Стандартизация лекарственных средств Издана Государственная фармакопея Республики Казахстан вдвух томах на государственном и русском языках I
- 16. Международное сотрудничество КомиссияЕвропейскойфармакопеи МеждународнаяпрограммаВОЗпомониторингупобочныхдействийЛС Межгосударственнаякомиссияпостандартизации, регистрациииконтролюкачестваЛС, ИМНиМТгосударств-участниковСНГ Евразийскоеэкономическоесообщество(ЕврАзЭС) Таможенныйсоюз ЕвропейскийДиректоратпоконтролюкачестваЛСимедицинскихуслугСоветаЕвропы(EDQM)
- 17. Научный информационно- аналитический журнал «Фармация Казахстана» Издается с 2001 года. Журнал «Фармация Казахстана» входит в перечень
- 18. Государственная регистрация ЛС, ИМН и МТ ГосударственнаярегистрацияЛС, ИМНиМТосуществляетсяККМФДМЗРК ЭкспертизуЛС, ИМНиМТпроводитРГП«НациональныйцентрэкспертизыЛС, ИМНиМТ»МЗРК. ТребованияКазахстанаприпроведениигосударственнойрегистрациилекарственныхсредствприближеныигармонизированысостандартамиЕвропейскосообщества, странСНГ–России, Украины. ТакаясистемагосударственногоконтролявРеспубликеКазахстанзаоборотомидопускомнарыноклекарственныхсредствэффективноработаетуже10 лет.
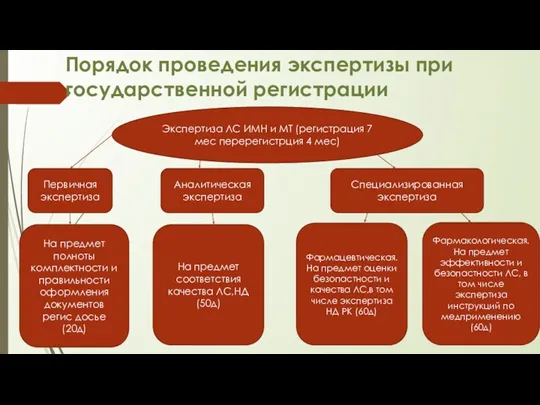
- 19. Порядок проведения экспертизы при государственной регистрации Экспертиза ЛС ИМН и МТ (регистрация 7 мес перерегистрция 4
- 20. Государственная регистрация ЛС, ИМН, МТ После завершения экспертизы ЛС составляется заключение о безопасности, эффективности и качестве
- 21. Оценка производства и системы обеспечения качества при государственной регистрации В соответствии с приказом МЗРК от19 ноября2009
- 22. Использованные материалы: Материалы сайта WHO Collaborating Centre for Drug Statistics Methodology: http://www.whocc.no/atcddd/ Материалы сайта http://www.apteka.ua Астапенко
- 24. Скачать презентацию



















 Кардиогенный шок. Дефиниции: термины и понятия
Кардиогенный шок. Дефиниции: термины и понятия Жанұя денсаулығы. Бала денсаулығы
Жанұя денсаулығы. Бала денсаулығы Подходы к организации логопедической работы с детьми при нарушении зрения
Подходы к организации логопедической работы с детьми при нарушении зрения Пищевая аллергия
Пищевая аллергия Балалардағы ішек дисбактериозы
Балалардағы ішек дисбактериозы Профилактика внутрибольничной инфекции
Профилактика внутрибольничной инфекции Бюгельные протезы
Бюгельные протезы Нурофен для детей
Нурофен для детей Жидкие лекарственные формы
Жидкие лекарственные формы Стероид резистентті нефротикалық синдром
Стероид резистентті нефротикалық синдром Становление естественнонаучных знаний в эпоху Возрождения
Становление естественнонаучных знаний в эпоху Возрождения Перикардит. Перикардиттің даму себептері мен жіктелісі
Перикардит. Перикардиттің даму себептері мен жіктелісі Аборт – экстренная контрацепция или убийство?
Аборт – экстренная контрацепция или убийство? СУ при кровотечениях
СУ при кровотечениях Ақшаның мәні және атқаратын қызметтері
Ақшаның мәні және атқаратын қызметтері Адам ағзасындағы фотохимиялық түрленулер
Адам ағзасындағы фотохимиялық түрленулер Хронические гепатиты у детей
Хронические гепатиты у детей
 Қан құюдан кейінгі асқынулар. Уақытында диагностикалау. Емдеу тактикасы
Қан құюдан кейінгі асқынулар. Уақытында диагностикалау. Емдеу тактикасы Рак шейки матки (клиника, диагностика, лечение)
Рак шейки матки (клиника, диагностика, лечение) Инфекциялық үрдістің патофизиологиясы
Инфекциялық үрдістің патофизиологиясы Психология пациента
Психология пациента Вирус ГРИППа
Вирус ГРИППа Pacienta komforta nodrošinājums un pacienta drošība
Pacienta komforta nodrošinājums un pacienta drošība История, предмет и задачи гигиены и экологии человека
История, предмет и задачи гигиены и экологии человека Чистые руки
Чистые руки Вторичный период сифилиса. Скрытый сифилис. Серологическая диагностика сифилиса
Вторичный период сифилиса. Скрытый сифилис. Серологическая диагностика сифилиса Хроническая сердечная недостаточность
Хроническая сердечная недостаточность