Содержание
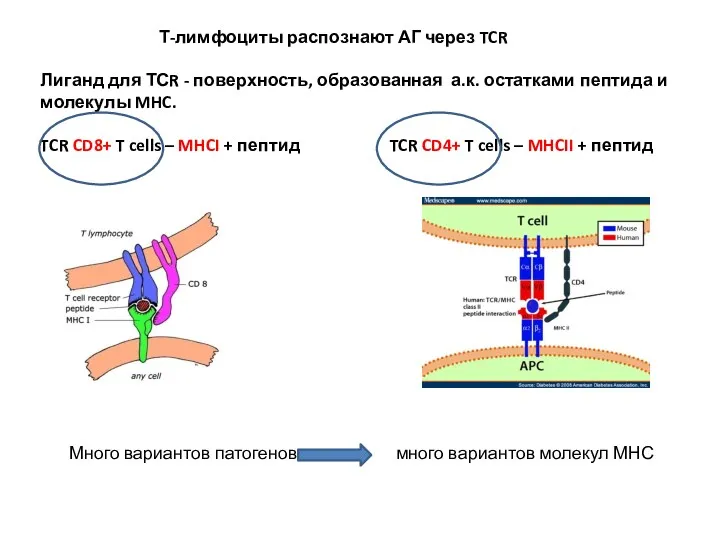
- 2. Т-лимфоциты распознают АГ через TCR Лиганд для ТСR - поверхность, образованная а.к. остатками пептида и молекулы
- 3. Молекулы MHC. Функция – связывать пептиды внутриклеточных патогенов и представлять их на своей поверхности для узнавания
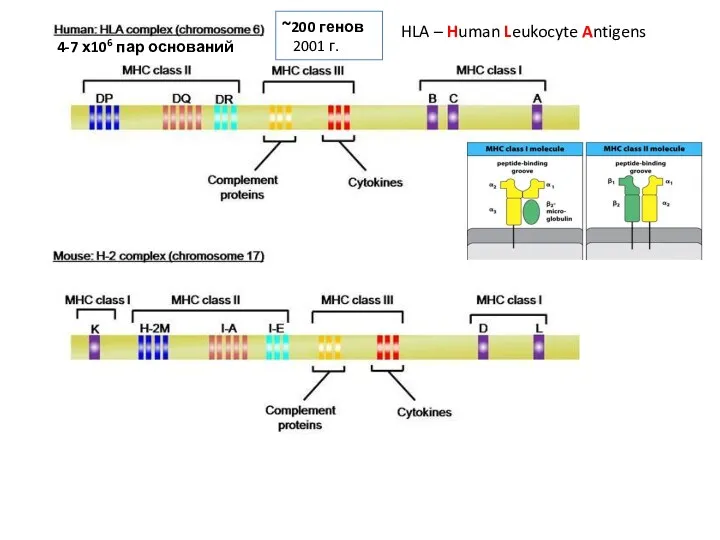
- 4. HLA – Human Leukocyte Antigens ~200 генов 2001 г. 4-7 х106 пар оснований
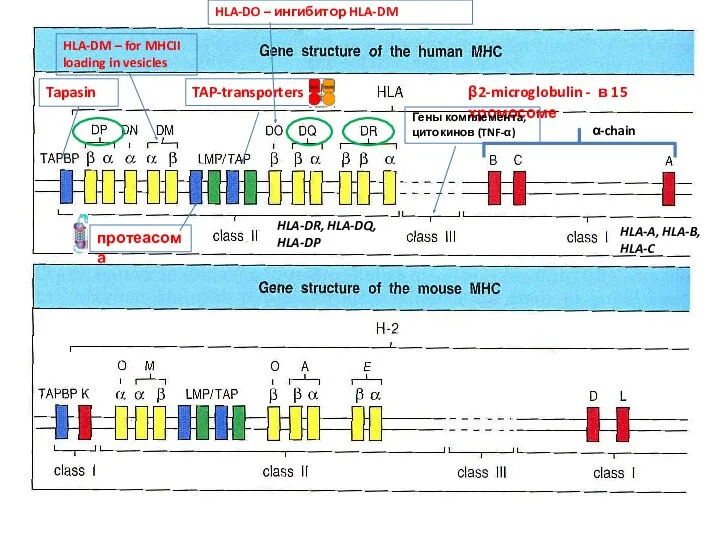
- 5. β2-microglobulin - в 15 хромосоме протеасома α-chain HLA-DM – for MHCII loading in vesicles HLA-A, HLA-B,
- 6. Генетическая карта MHC человека Гены комплемента, цитокинов Гены молекул МНС, доставляющих пептиды патогенов из клетки наружу,
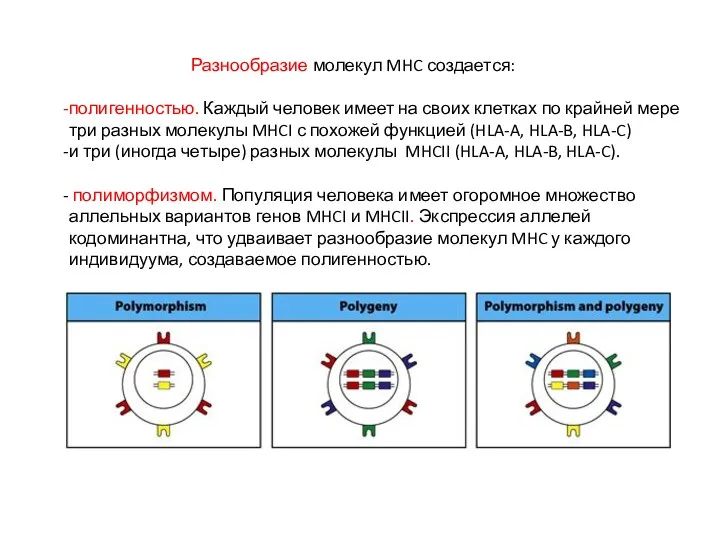
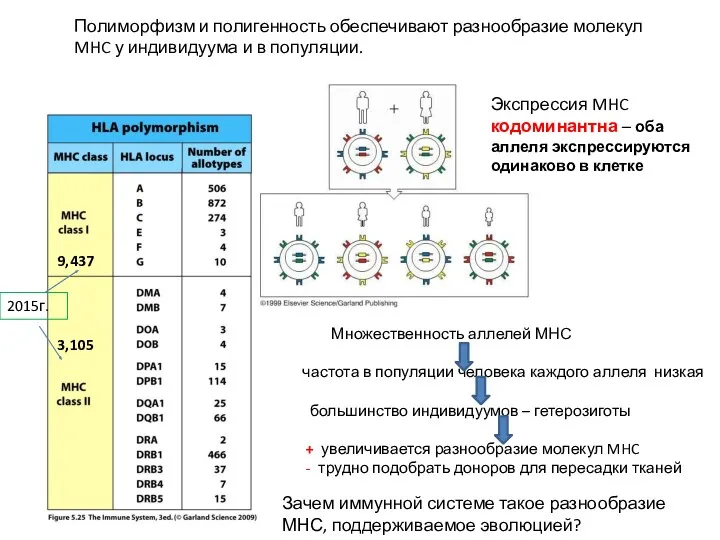
- 7. Разнообразие молекул MHC создается: полигенностью. Каждый человек имеет на своих клетках по крайней мере три разных
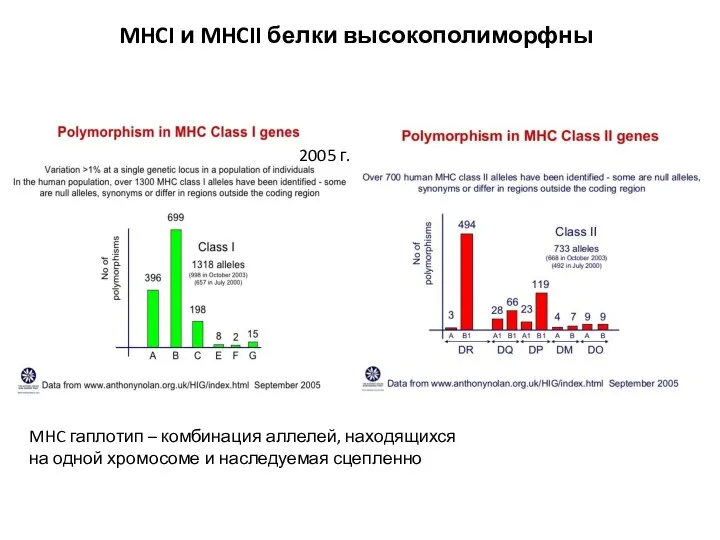
- 8. MHCI и MHCII белки высокополиморфны MHC гаплотип – комбинация аллелей, находящихся на одной хромосоме и наследуемая
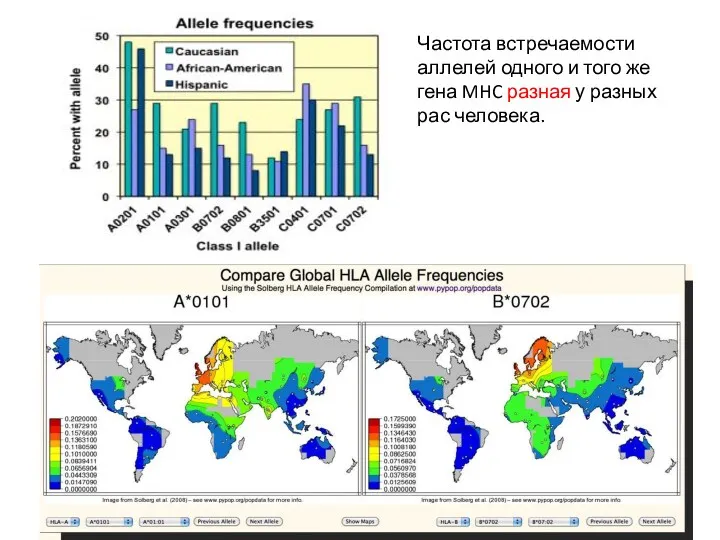
- 9. Частота встречаемости аллелей одного и того же гена MHC разная у разных рас человека.
- 10. Экспрессия MHC кодоминантна – оба аллеля экспрессируются одинаково в клетке Полиморфизм и полигенность обеспечивают разнообразие молекул
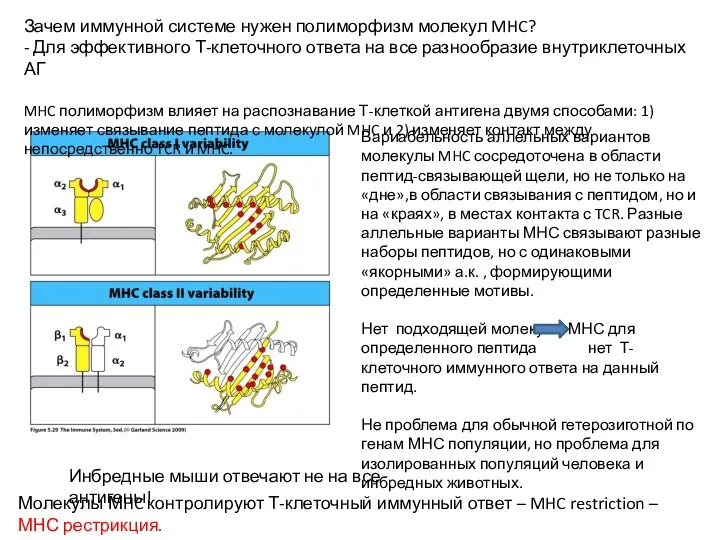
- 11. Зачем иммунной системе нужен полиморфизм молекул MHC? - Для эффективного Т-клеточного ответа на все разнообразие внутриклеточных
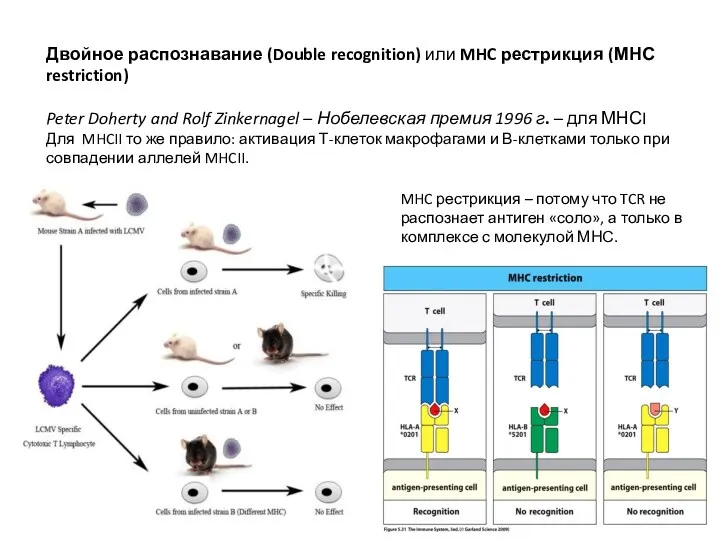
- 12. Двойное распознавание (Double recognition) или MHC рестрикция (МНС restriction) Peter Doherty and Rolf Zinkernagel – Нобелевская
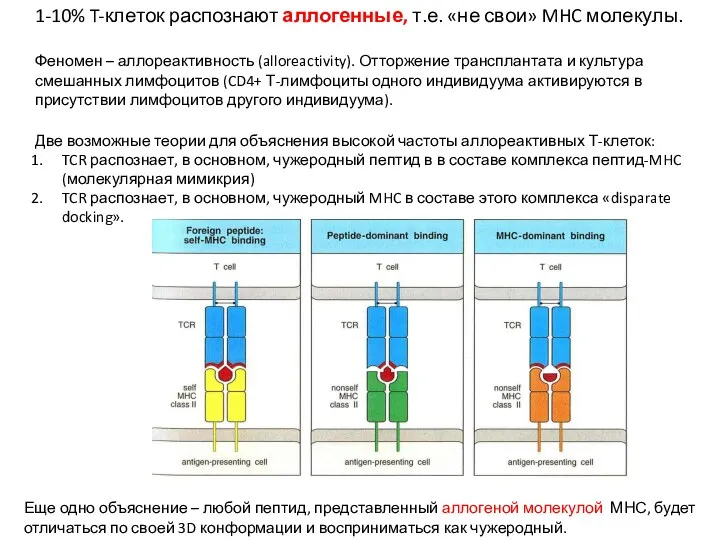
- 13. 1-10% T-клеток распознают аллогенные, т.е. «не свои» MHC молекулы. Феномен – аллореактивность (alloreactivity). Отторжение трансплантата и
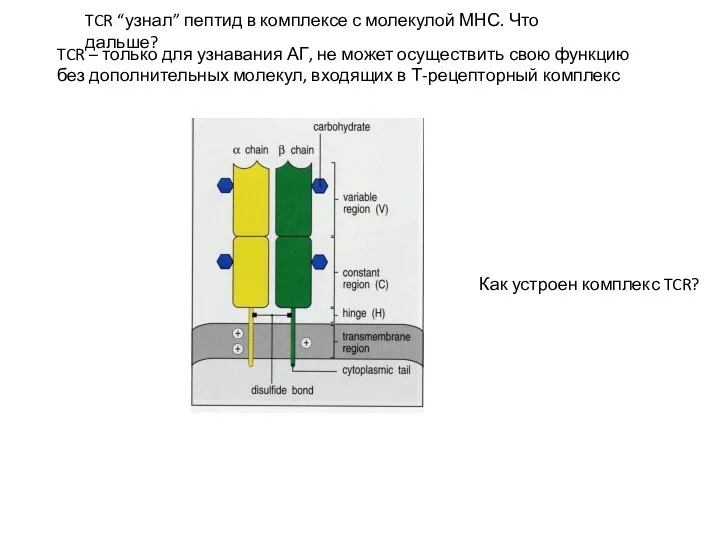
- 14. TCR – только для узнавания АГ, не может осуществить свою функцию без дополнительных молекул, входящих в
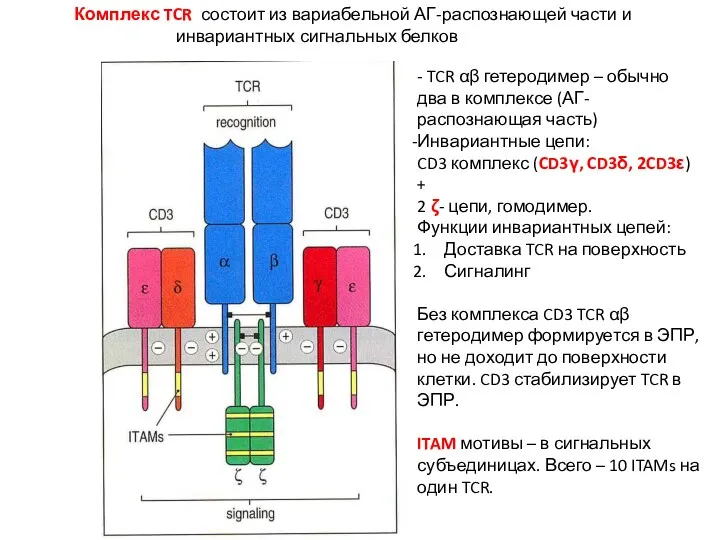
- 15. Комплекс TCR состоит из вариабельной АГ-распознающей части и инвариантных сигнальных белков - TCR αβ гетеродимер –
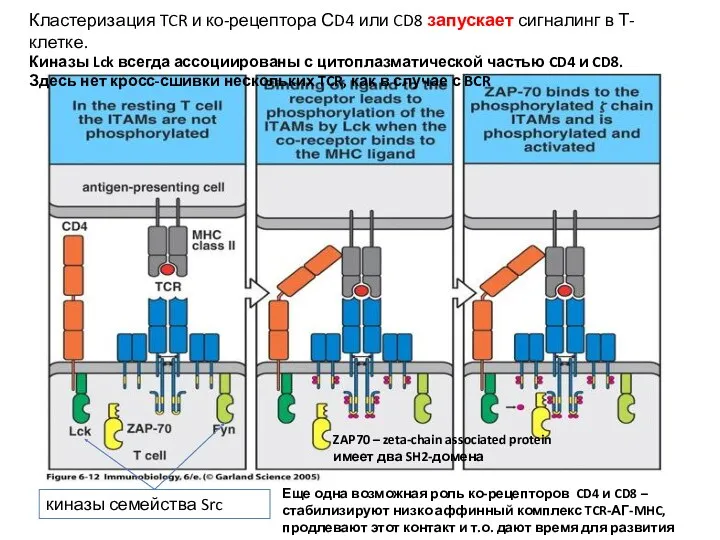
- 16. Кластеризация TCR и ко-рецептора СD4 или CD8 запускает сигналинг в Т-клетке. Киназы Lck всегда ассоциированы с
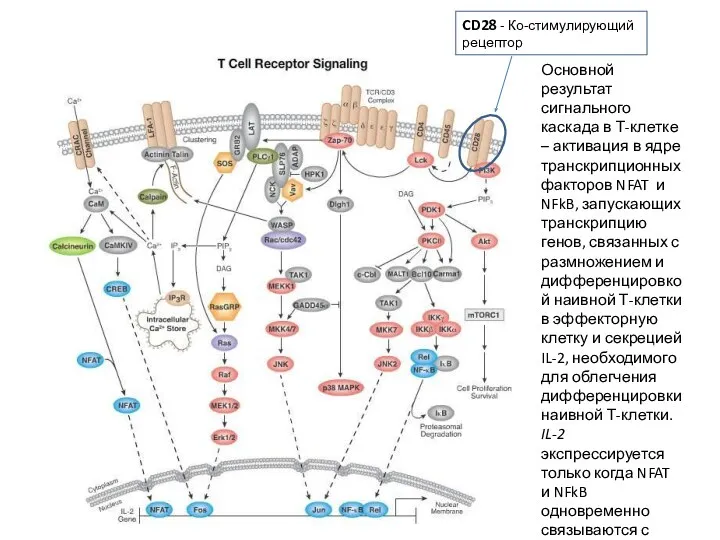
- 17. Основной результат сигнального каскада в Т-клетке – активация в ядре транскрипционных факторов NFAT и NFkB, запускающих
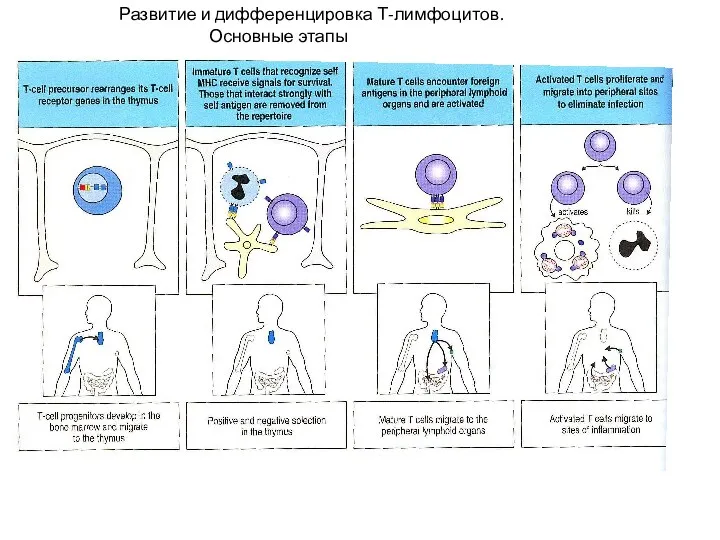
- 18. Развитие и дифференцировка Т-лимфоцитов. Основные этапы
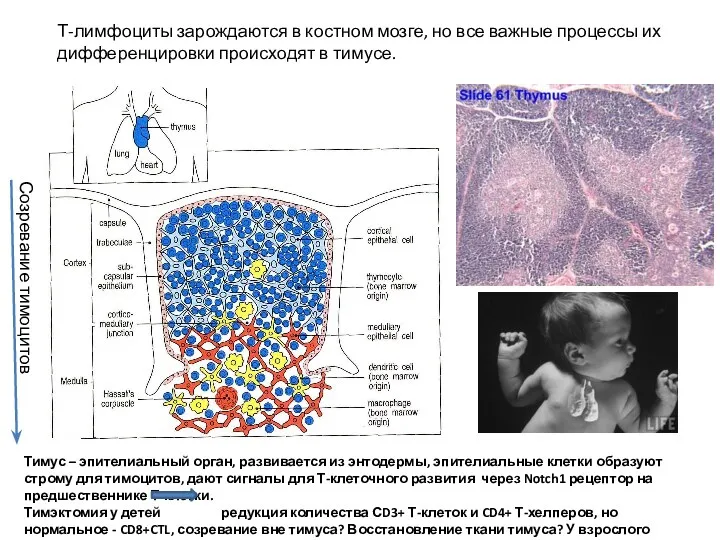
- 19. Т-лимфоциты зарождаются в костном мозге, но все важные процессы их дифференцировки происходят в тимусе. Тимус –
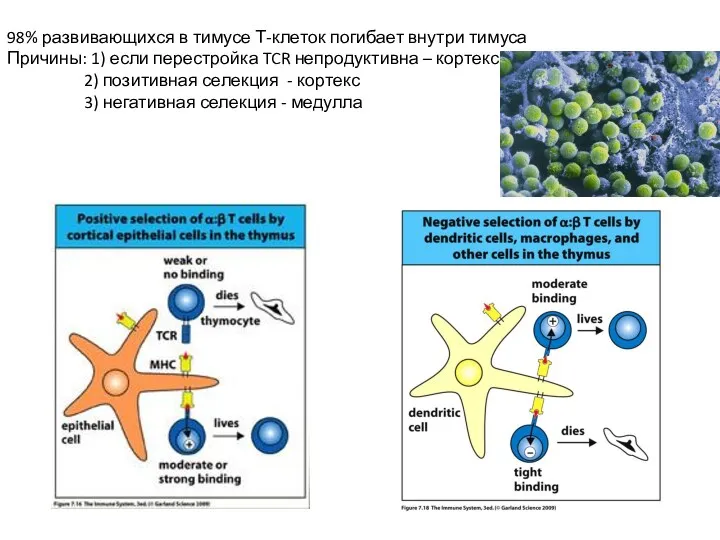
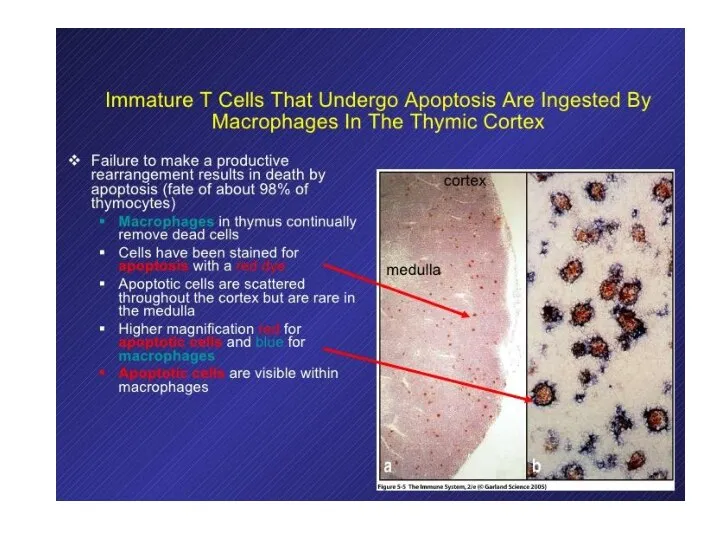
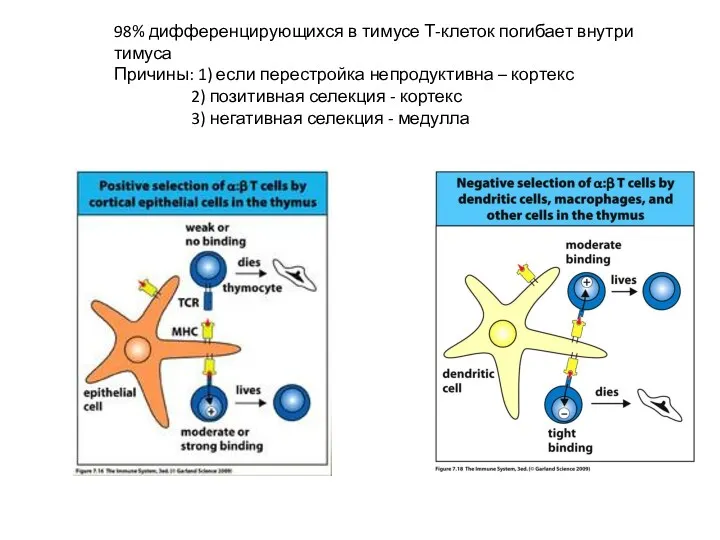
- 20. 98% развивающихся в тимусе Т-клеток погибает внутри тимуса Причины: 1) если перестройка TCR непродуктивна – кортекс
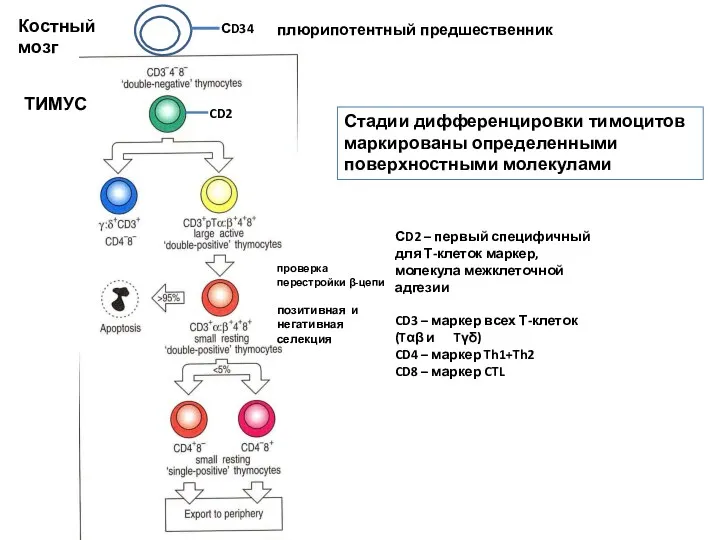
- 22. Стадии дифференцировки тимоцитов маркированы определенными поверхностными молекулами СD2 – первый специфичный для Т-клеток маркер, молекула межклеточной
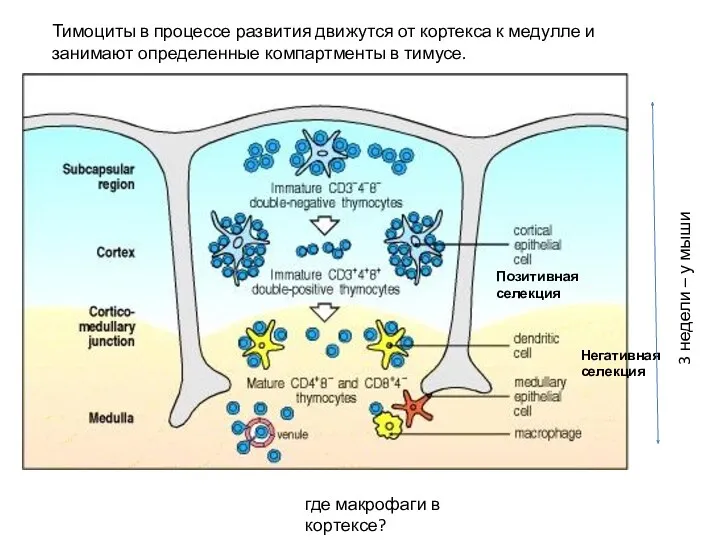
- 23. Тимоциты в процессе развития движутся от кортекса к медулле и занимают определенные компартменты в тимусе. где
- 24. В тимусе в Т-клетках происходит ряд перестроек генных сегментов. Задача – 1) собрать для TCR функциональный
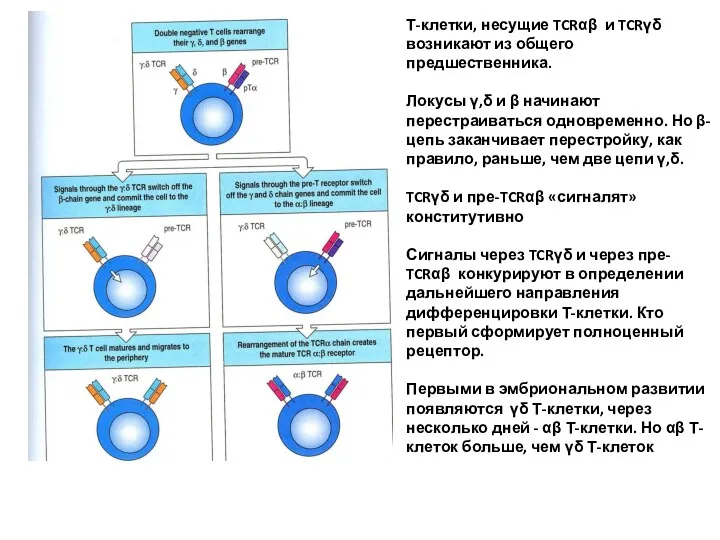
- 25. Т-клетки, несущие TCRαβ и TCRγδ возникают из общего предшественника. Локусы γ,δ и β начинают перестраиваться одновременно.
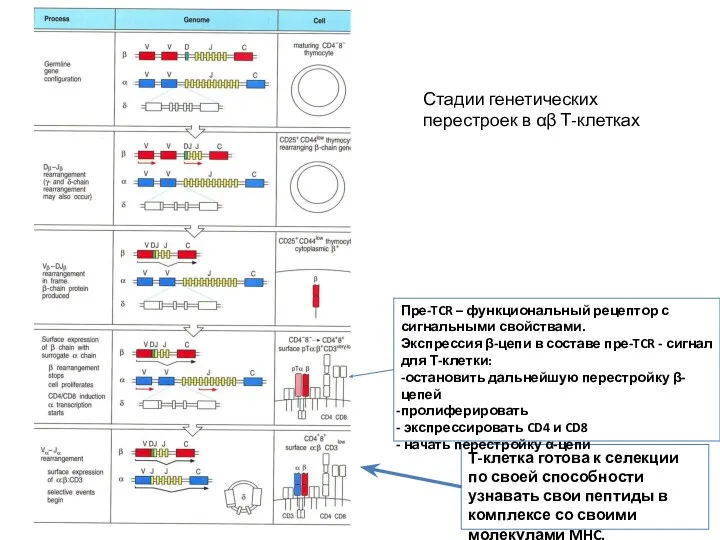
- 26. Стадии генетических перестроек в αβ Т-клетках Пре-TCR – функциональный рецептор с сигнальными свойствами. Экспрессия β-цепи в
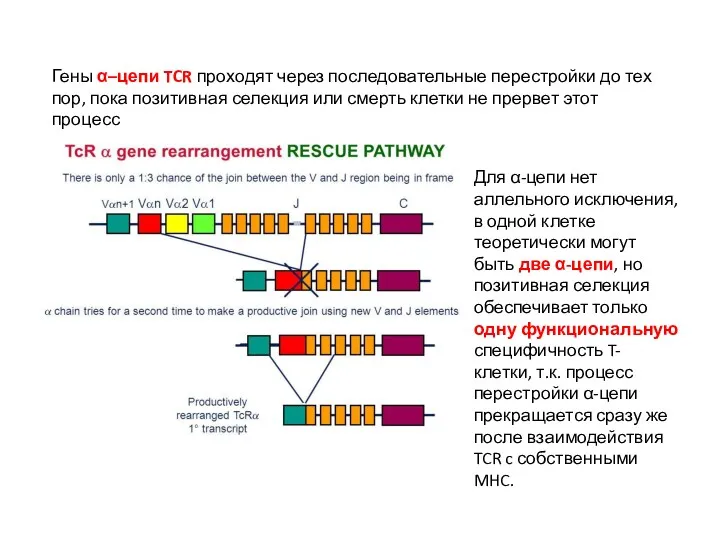
- 27. Гены α–цепи TCR проходят через последовательные перестройки до тех пор, пока позитивная селекция или смерть клетки
- 28. 98% дифференцирующихся в тимусе Т-клеток погибает внутри тимуса Причины: 1) если перестройка непродуктивна – кортекс 2)
- 29. Позитивная селекция: Определяет репертуар TCR. Тимоциты, имеющие TCR, который не может взаимодействовать с комплексом собственный MHC:собственный
- 31. Скачать презентацию




 Особенности вляния цвета на психику и настроение
Особенности вляния цвета на психику и настроение Заболевания передающиеся половым путем
Заболевания передающиеся половым путем Faculty of clinical psychology. Perm state medical university named after E.A. Wagner
Faculty of clinical psychology. Perm state medical university named after E.A. Wagner Заболевания эндокринной системы
Заболевания эндокринной системы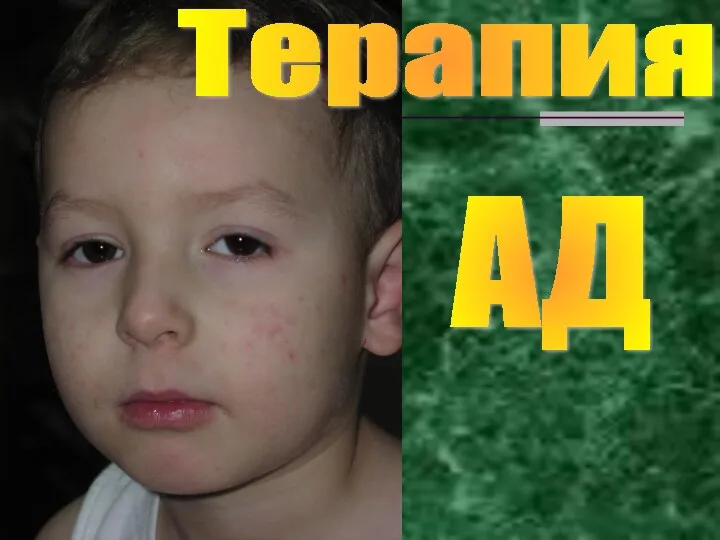 Лечение атопического дерматита
Лечение атопического дерматита Creation of radiographs and sonograms for cardiovascular system
Creation of radiographs and sonograms for cardiovascular system Особенности сестринского ухода за пациентами при лейкозах
Особенности сестринского ухода за пациентами при лейкозах OKI
OKI Қазақстан республикасы бойынша Конго-Қырым геморрагиялық қызбасымен сырқаттанушылықты талдау
Қазақстан республикасы бойынша Конго-Қырым геморрагиялық қызбасымен сырқаттанушылықты талдау Респираторный дистресс-синдром новорождённых
Респираторный дистресс-синдром новорождённых Патология сальных желез
Патология сальных желез Осторожно: грипп и орви
Осторожно: грипп и орви Науқастарды тасмалдау кезіндегі қорғау
Науқастарды тасмалдау кезіндегі қорғау Заболевания нервной системы у детей и их профилактика
Заболевания нервной системы у детей и их профилактика Вирусные гепатиты
Вирусные гепатиты Острый панкреатит. Лечение в условиях реанимации и интенсивной терапии
Острый панкреатит. Лечение в условиях реанимации и интенсивной терапии Психотропные средства
Психотропные средства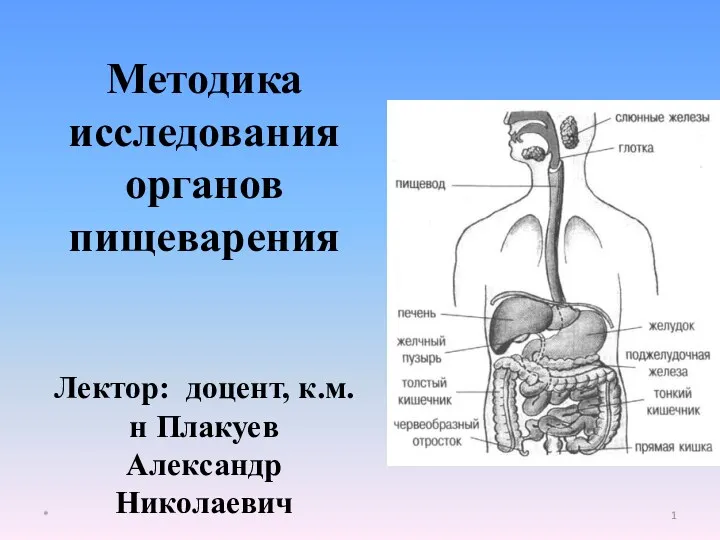 Методика исследования органов пищеварения
Методика исследования органов пищеварения Туберкулез, сифилис, актиномикоз ЧЛО
Туберкулез, сифилис, актиномикоз ЧЛО Синдром поликистозных яичников
Синдром поликистозных яичников Заболевания тонкой и толстой кишки
Заболевания тонкой и толстой кишки Гнойные заболевания пальцев кисти
Гнойные заболевания пальцев кисти Бактериальные инфекции
Бактериальные инфекции Сифіліс. Класифікація сифілісу
Сифіліс. Класифікація сифілісу Употребление и злоупотребление кокаином
Употребление и злоупотребление кокаином Реанимация. Методы реанимации. Реанимация и интенсивная терапия при внезапной остановке кровообращения
Реанимация. Методы реанимации. Реанимация и интенсивная терапия при внезапной остановке кровообращения Всероссийская служба медицины катастроф. Основы лечебно-эвакуационного обеспечения населения в ЧС мирного и военного времени
Всероссийская служба медицины катастроф. Основы лечебно-эвакуационного обеспечения населения в ЧС мирного и военного времени Проблема расстройств менструальной функции. Нейроэндокринные синдромы в гинекологии
Проблема расстройств менструальной функции. Нейроэндокринные синдромы в гинекологии