2.1 KHÁI NIỆM
"Xây dựng cho phù hợp chiến lược và kế
hoạch quốc gia để thành lập của hệ thống cho việc đánh giá, lập kế hoạch,mua sắm và quản lý công nghệ y tế đặc biệt là thiết bị y tế, phối hợp với nhân viên tham gia giám định sức khoẻ-công nghệ và kỹ thuật y sinh “[1]
Giới thiệu quản lí công nghệ y tế ở Mỹ thông qua Cục quản lí thực phẩm và dược phẩm Hoa Kì (FDA) -cơ quan liên bang duy nhất được Quốc hội giao nhiệm vụ điều chỉnh các thiết bị y tế để đảm bảo an toàn và hiệu quả.Gồm các vấn đề:
- Quy định đổi mới về thiết bị y tế
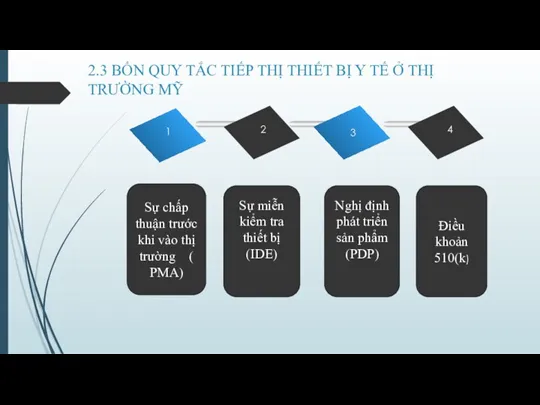
- Bốn quy tắc chính để tiếp thị thiết bị y tế ở thị trường Mỹ
- Vấn đề đạo đức trong những nghiên cứu khả thi
- Y đức trong trường hợp cấp cứu.
- Vấn đề đạo đức trong sử dụng điều trị [2]
[1] World Health Organization , Health technology assessment of medical devives, Switzerland, 2011
[2] John D. Enderle, Joseph D. Bronzino , Introduction to Biomedical Engineering,Connecticut, 2011






![ĐÁNH GIÁ CÔNG NGHỆ Y TẾ Ở VIỆT NAM [3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/303073/slide-8.jpg)



![2.4 NGHIÊN CỨU KHẢ THI [2] [2] John D. Enderle,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/303073/slide-13.jpg)

![2.6 VẤN ĐỀ ĐẠO ĐỨC TRONG ĐIỀU TRỊ [2] FDA](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/303073/slide-15.jpg)
![4. TÀI LIỆU THAM KHẢO [1] World Health Organization ,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/303073/slide-17.jpg)
 Загальні положення фармацевтичної опіки
Загальні положення фармацевтичної опіки Кардиомиопатия у детей. Лечение
Кардиомиопатия у детей. Лечение Диагностика и лечение анемий
Диагностика и лечение анемий Чувствительность. Проводящие пути. Типы чувствительных расстройств. ЧМН, обонятельный и зрительный нервы. (Занятие 3)
Чувствительность. Проводящие пути. Типы чувствительных расстройств. ЧМН, обонятельный и зрительный нервы. (Занятие 3) Ожирение. Основы профилактики
Ожирение. Основы профилактики Хирургия паразитарных заболеваний
Хирургия паразитарных заболеваний Анемический сидром
Анемический сидром Омыртқа жотасының иіліс сатыларының анықтығына сәйкес дене түрлерін анықтау
Омыртқа жотасының иіліс сатыларының анықтығына сәйкес дене түрлерін анықтау Хламидийная инфекция
Хламидийная инфекция Роль фельдшера в лечении бронхитов
Роль фельдшера в лечении бронхитов Отологиядағы синдромдар
Отологиядағы синдромдар История ФР. Лекция № 2 (картинки)
История ФР. Лекция № 2 (картинки) Острые отравления лекарственными средствами
Острые отравления лекарственными средствами Тератогенез. Факторы риска возникновения врожденных аномалий развития
Тератогенез. Факторы риска возникновения врожденных аномалий развития Лицензирование фармацевтической деятельности
Лицензирование фармацевтической деятельности Биотехнология изготовления вакцин
Биотехнология изготовления вакцин Нарушения гидродинамики глаза
Нарушения гидродинамики глаза Гентские критерии синдрома Марфана и малые аномалии развития сердца и сосудов
Гентские критерии синдрома Марфана и малые аномалии развития сердца и сосудов СНК кафедры семейной медицины
СНК кафедры семейной медицины Методы детоксикации в лечении больных, находящихся в критическом состоянии в различных областях медицины
Методы детоксикации в лечении больных, находящихся в критическом состоянии в различных областях медицины Развитие и прорезывание временных и постоянных зубов
Развитие и прорезывание временных и постоянных зубов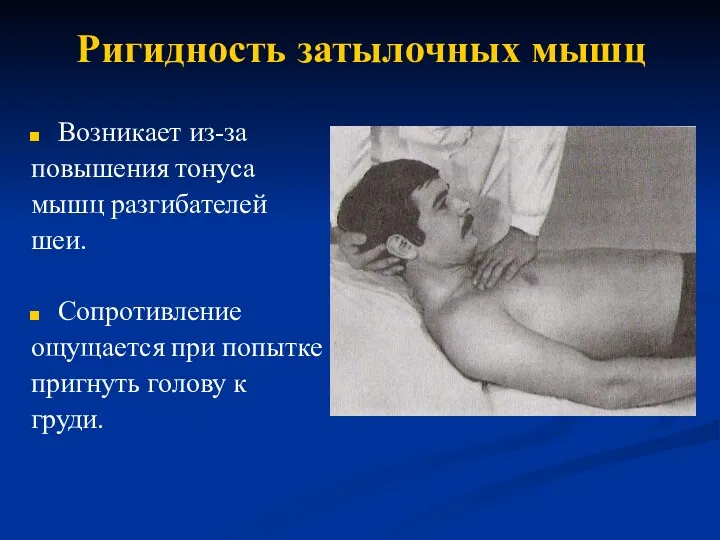 Ригидность затылочных мышц
Ригидность затылочных мышц Медицинская паразитология
Медицинская паразитология Перикардиты. Анатомия перикарда
Перикардиты. Анатомия перикарда Осложнения инфаркта миокарда
Осложнения инфаркта миокарда Дифференциальная диагностика псориатического артрита
Дифференциальная диагностика псориатического артрита Теміртапшылық анемияның диагностикалық критерийлері
Теміртапшылық анемияның диагностикалық критерийлері Виды недержания мочи и способы коррекции
Виды недержания мочи и способы коррекции