Слайд 2

Биопсия (от греч. bios – жизнь и opsis – зрительное восприятие,
рассмотрение) – иссечение каких-либо тканей из живого организма с последующим морфологическим исследованием иссеченного материала (биоптата) в целях определения характера патологического процесса.
Слайд 3

Задачи биопсии:
уточнение клинического диагноза,
установление диагноза в клинически неясных случаях,
определение начальных стадий
заболевания (наиболее ранних признаков болезни),
дифференциальная диагностика различных по форме и этиологии воспалительных, гиперпластических и опухолевых процессов,
определение радикальности проведенных операций,
изучение структурных изменений, возникающих в тканях под влиянием лечения.
Слайд 4

Слайд 5

Забор материала для гистологического исследования
Слайд 6
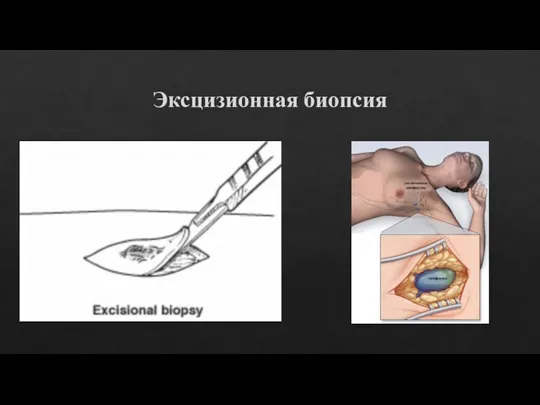
Слайд 7
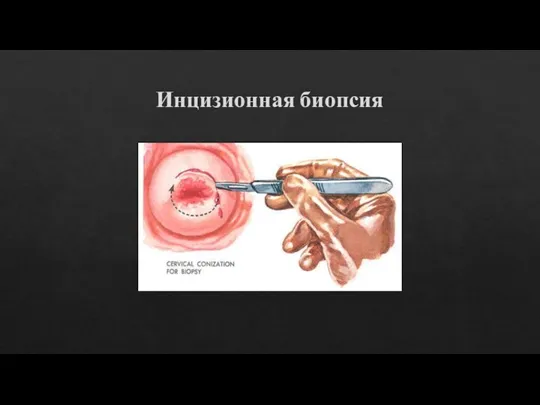
Слайд 8
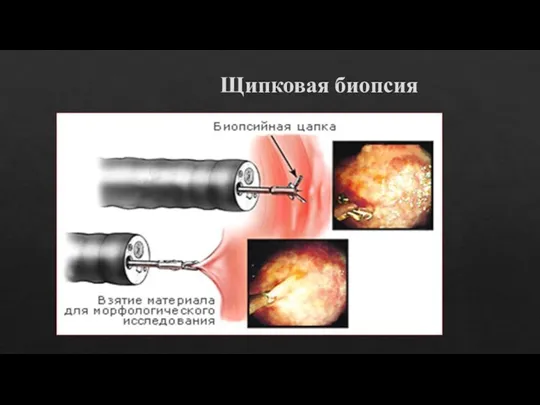
Слайд 9
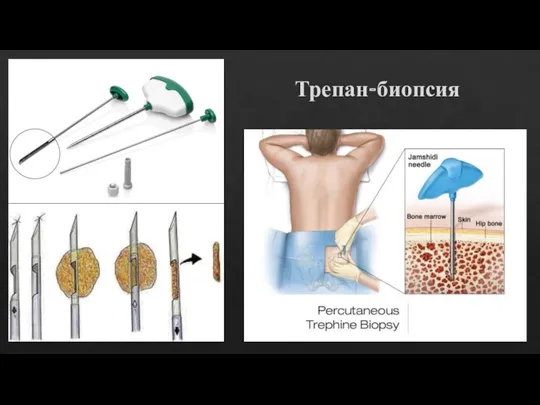
Слайд 10
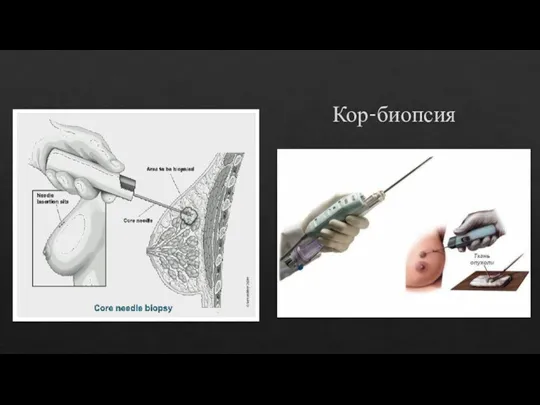
Слайд 11
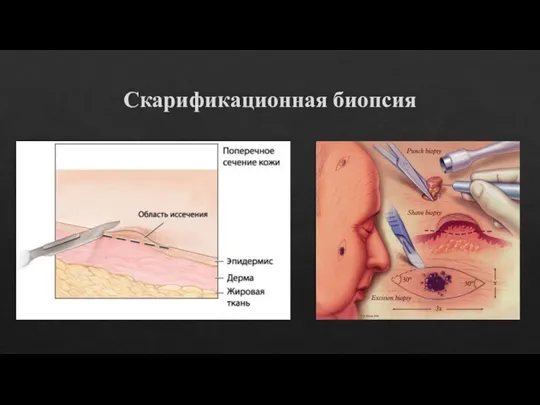
Слайд 12
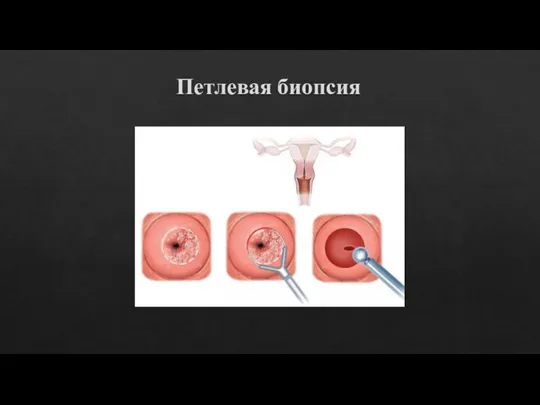
Слайд 13

Забор материала для цитологического исследования
Слайд 14
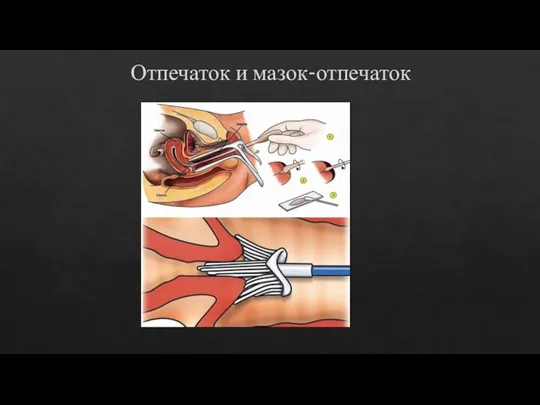
Отпечаток и мазок-отпечаток
Слайд 15
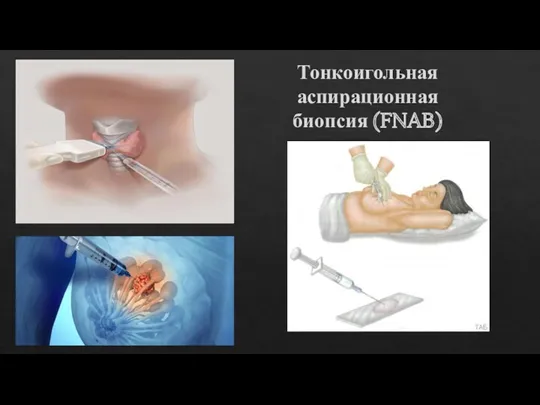
Тонкоигольная аспирационная биопсия (FNAB)
Слайд 16
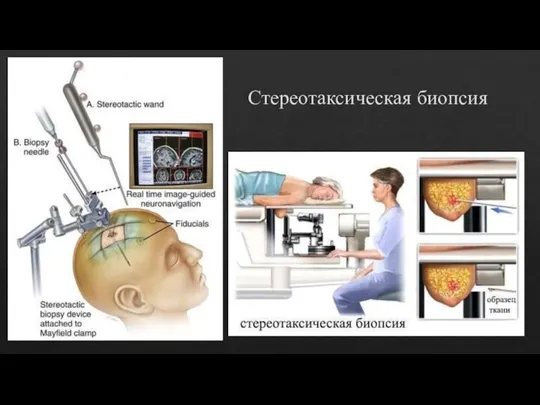
Стереотаксическая биопсия
Слайд 17

Электронная микроскопия
- трудоемкий и дорогостоящий метод, его применяют только в
тех случаях, когда другие методы исчерпали себя. Чаще всего такая необходимость возникает в онкоморфологии и вирусологии для диагностики определенных видов гистиоцитозов, например, гистиоцитоза-Х - опухоли из отростчатых эпидермальных макрофагов, маркером которых являются гранулы Бирбека. Другой пример, рабдомиосаркома, маркером ее являются Z-диски в опухолевых клетках. Существуют два основных метода ЭМ: трансмиссионная и сканирующая. Трансмиссионная ЭМ – микроскопия в проходящем пучке электронов – позволяет получить изображение, подобное светооптическому, но с гораздо большим увеличением (в тысячи и десятки тысяч раз). Сканирующая ЭМ основана на эффекте отражения пучка электронов от поверхности объекта, что позволяет изучить его рельеф и трехмерную структуру на ультрамикроскопическом уровне.
Слайд 18
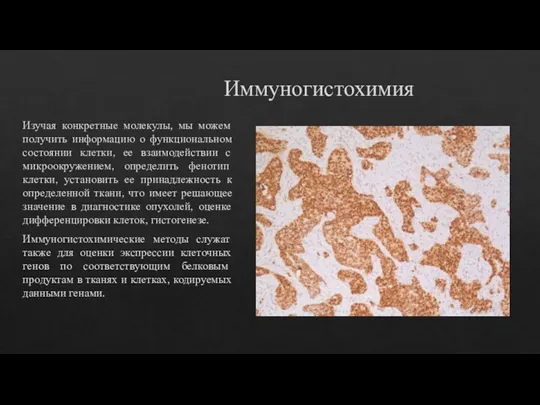
Иммуногистохимия
Изучая конкретные молекулы, мы можем получить информацию о функциональном состоянии клетки,
ее взаимодействии с микроокружением, определить фенотип клетки, установить ее принадлежность к определенной ткани, что имеет решающее значение в диагностике опухолей, оценке дифференцировки клеток, гистогенезе.
Иммуногистохимические методы служат также для оценки экспрессии клеточных генов по соответствующим белковым продуктам в тканях и клетках, кодируемых данными генами.
Слайд 19

Гибридизация на месте
– цитогенетический метод, который применяют для детекции и определения
положения специфической последовательности ДНК на метафазных хромосомах или в интерфазных ядрах in situ. Кроме того, FISH используют для выявления специфических мРНК в образце ткани. В последнем случае метод FISH позволяет установить пространственно-временные особенности экспрессии генов в клетках и тканях.
Преимуществом данного метода является возможность не только идентификации нуклеиновых кислот, но и корреляции с морфологическими данными.
Слайд 20

При флуоресцентной гибридизации in situ используют ДНК-зонды (ДНК-пробы), которые связываются с
комплементарными мишенями в образце. В состав ДНК-зондов входят нуклеозиды, меченные флюорофорами (прямое мечение) или такими конъюгатами, как биотин или дигоксигенин (непрямое мечение). При прямом мечении связавшийся с мишенью ДНК-зонд можно наблюдать при помощи флуоресцентного микроскопа сразу по завершении гибридизации. В случае непрямого мечения необходима дополнительная процедура окрашивания, в ходе которой биотин выявляют при помощи флуоресцентно-меченного авидина или стрептавидина, а дигоксигенин — при помощи флюоресцентно-меченых антител. Хотя непрямой вариант мечения ДНК-проб требует дополнительных реактивов и временных затрат, этот способ позволяет добиться обычно более высокого уровня сигнала за счёт присутствия на молекуле антитела или авидина 3—4 молекул флюорохрома. Кроме того, в случае непрямого мечения возможно каскадное усиление сигнала.
Слайд 21

Типы зондов:
локус-специфичные зонды, связывающиеся с определенными участками хромосом. Данные зонды используются
для идентификации имеющейся короткой последовательности выделенной ДНК, которая используется для приготовления меченого зонда и его последующей гибридизации с набором хромосом,
альфоидные или центромерные зонды-повторы представляют собой повторяющиеся последовательности центромерных областей хромосом. С их помощью каждая хромосома может быть окрашена в различный цвет, что позволяет быстро определить число хромосом и отклонения от нормального их числа,
зонды на всю хромосому являются набором небольших зондов, комплементарных к отдельным участкам хромосомы, но в целом покрывающими всю ее длину. Используя библиотеку таких зондов можно "раскрасить" всю хромосому и получить дифференциальный спектральный кариотип индивида. Данный тип анализа применяется для анализа хромосомных аберраций, например транслокаций, когда кусочек одной хромосомы переносится на плечо другой.
Слайд 22

На первом этапе происходит конструирование зондов. Размер зонда должен быть достаточно
большим для того, чтобы гибридизация происходила по специфическому сайту, но и не слишком большой (не более 1 тыс. п. о.), чтобы не препятствовать процессу гибридизации. При выявлении специфических локусов или при окраске целых хромосом надо заблокировать гибридизацию ДНК-проб с неуникальными повторяющимися ДНК-последовательностями путём добавления в гибридизационную смесь немеченой ДНК повторов (например, Cot-1 DNA). Если ДНК-зонд представляет собой двуцепочечную ДНК, то перед гибридизацией её необходимо денатурировать.
На следующем этапе приготавливают препараты интерфазных ядер или метафазных хромосом. Клетки фиксируют на субстрате, как правило, на предметном стекле, затем проводят денатурацию ДНК. Для сохранения морфологии хромосом или ядер денатурацию проводят в присутствии формамида, что позволяет снизить температуру денатурации до 70 °C.
Далее к препарату добавляют зонды и осуществляют гибридизацию около 12 часов. Затем проводят несколько стадий отмывок для удаления всех негибридизовавшихся зондов.
Визуализацию связавшихся ДНК-зондов проводят при помощи флуоресцентного микроскопа. Интенсивность флуоресцентного сигнала зависит от многих факторов — эффективности мечения зондом, типа зонда и типа флуоресцентного красителя.
Слайд 23























 Пищевые токсикоинфекции
Пищевые токсикоинфекции Сумен қамтамасыз ету көздерінің санитарлық күзет аймағы
Сумен қамтамасыз ету көздерінің санитарлық күзет аймағы Грыжа пищеводного отверстия диафрагмы
Грыжа пищеводного отверстия диафрагмы Ознаки біологічної та клінічної смерті
Ознаки біологічної та клінічної смерті Хронический рецидивирующий афтозный стоматит у детей
Хронический рецидивирующий афтозный стоматит у детей Налоги и налогообложение в здравоохранении
Налоги и налогообложение в здравоохранении Серологические реакции
Серологические реакции Индивидуальное развитие детей школьного возраста
Индивидуальное развитие детей школьного возраста Комбинированный остеосинтез в лечении дефектов и дефект-псевдоартозов длинных трубчатых костей
Комбинированный остеосинтез в лечении дефектов и дефект-псевдоартозов длинных трубчатых костей Медицинская информатика: основы защиты данных. Лекция 1
Медицинская информатика: основы защиты данных. Лекция 1 Соматизированная депрессия
Соматизированная депрессия :Пародонтоз аурулары. Патогенез. Алдын алу және емдеу
:Пародонтоз аурулары. Патогенез. Алдын алу және емдеу Гипоксия. Этиология и патогенез экзогенной гипоксии
Гипоксия. Этиология и патогенез экзогенной гипоксии Средства, влияющие на функции органов дыхания
Средства, влияющие на функции органов дыхания Средства, влияющие на систему крови
Средства, влияющие на систему крови Жаңа туған балаларда кездесетін анемиялық синдром
Жаңа туған балаларда кездесетін анемиялық синдром Симптоматология острого и хронического гломерулонефрита, пиелонефрита, почечной недостаточности
Симптоматология острого и хронического гломерулонефрита, пиелонефрита, почечной недостаточности Наследственные заболевания и синдромы с аномалиями размеров и формы зубов
Наследственные заболевания и синдромы с аномалиями размеров и формы зубов Неотложные состояния в пульмонологии и гематологии
Неотложные состояния в пульмонологии и гематологии Дәрумендер, олардың балалардың дұрыс дамуындағы маңызы, дәрумендерге жас ерекшеліктеріне байланысты физиологиялық мұқтаждығы
Дәрумендер, олардың балалардың дұрыс дамуындағы маңызы, дәрумендерге жас ерекшеліктеріне байланысты физиологиялық мұқтаждығы Организация травматологической помощи в амбулаторных и стационарных условиях. Травмпункт
Организация травматологической помощи в амбулаторных и стационарных условиях. Травмпункт Лекарственные средства, влияющие на афферентную иннервацию
Лекарственные средства, влияющие на афферентную иннервацию Хронический пиелонефрит: дифференциальная диагностика мочевого синдрома
Хронический пиелонефрит: дифференциальная диагностика мочевого синдрома Физиология системы крови
Физиология системы крови Артикуляция и окклюзия. Биомеханика нижней челюсти
Артикуляция и окклюзия. Биомеханика нижней челюсти Экзогенная безлекарственная профилактика кариеса зубов в стоматологии
Экзогенная безлекарственная профилактика кариеса зубов в стоматологии Печёночная кома. Интенсивная терапия
Печёночная кома. Интенсивная терапия Несеп айдағыш дәрілер
Несеп айдағыш дәрілер