Содержание
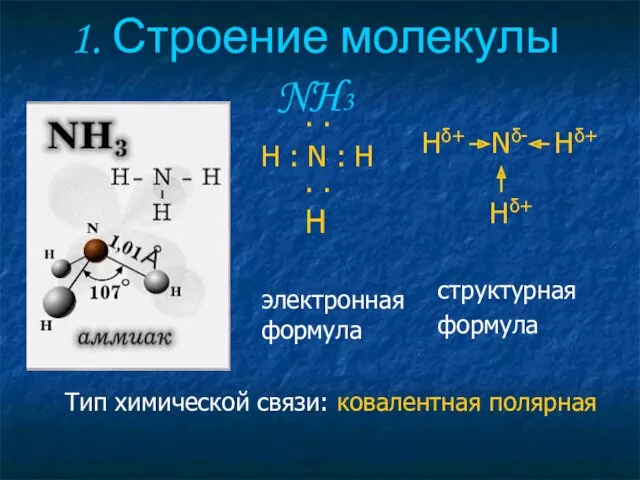
- 2. 1. Строение молекулы NH3 Hδ+ Nδ- Hδ+ Hδ+ структурная формула . . H : N :
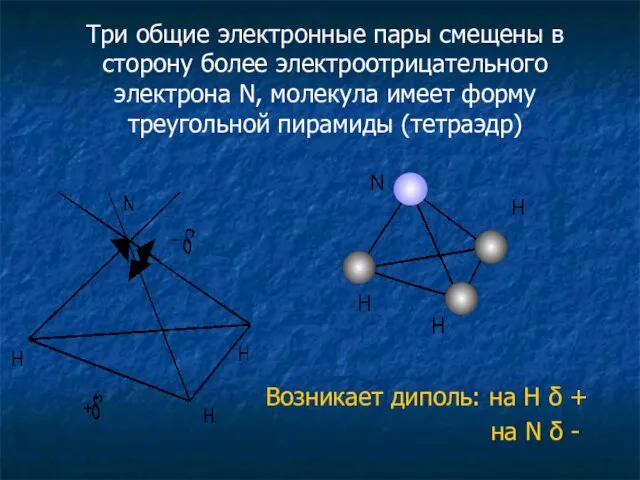
- 3. Три общие электронные пары смещены в сторону более электроотрицательного электрона N, молекула имеет форму треугольной пирамиды
- 4. Водородная связь – это химическая связь между атомами водорода одной молекулы и атомами сильно электроотрицательных элементов
- 5. H H H | | | Н – N · · · H – N ·
- 6. 2. Физические свойства бесцветный газ с резким запахом, едким вкусом; ядовит; почти в 2 раза легче
- 7. легко сжимается при t=-33,4 ºС и обычном давлении. При испарении NH3 жид. дает сильное охлаждение (поглощает
- 8. 3. Химические свойства I. Реакции, связанные с изменением степени окисления азота: 1) Разложение при t (непрочное
- 9. 2) Горение в кислороде ( при t, без катализатора) – некаталитическое окисление, т.е. смесь NH3 и
- 10. 3) Каталитическое окисление NH3 Катализаторы – Pt – оксиды Cr и Fе t, кат. NH3 +
- 11. 4) Взаимодействие с FeO (CuO) при нагревании t FeO + NH3 Fe + N20 + H2O
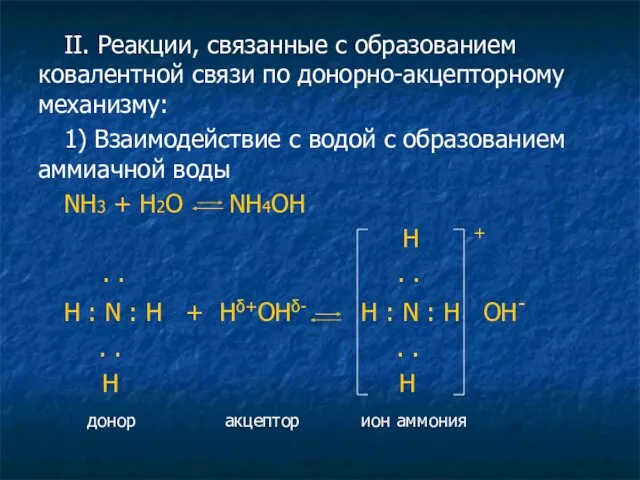
- 12. II. Реакции, связанные с образованием ковалентной связи по донорно-акцепторному механизму: 1) Взаимодействие с водой с образованием
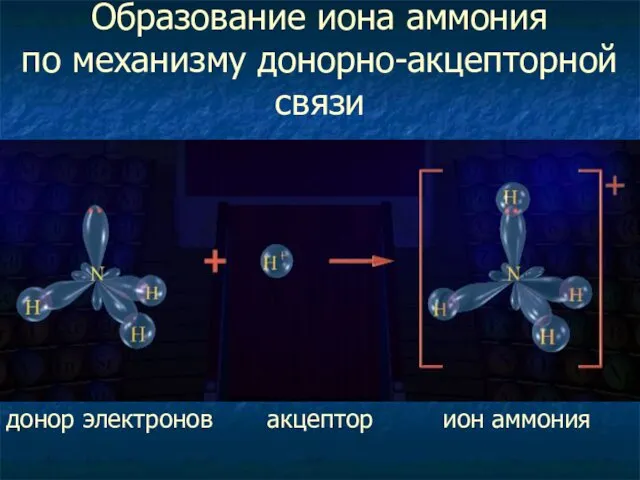
- 13. Образование иона аммония по механизму донорно-акцепторной связи донор электронов акцептор ион аммония
- 14. Катион NH4+ – играет роль катиона металла Донор Акцептор Атом, предоставляющий Атом, приобретающий общую электронную пару
- 15. NH4OH NH4++OH- ион гидроксид аммония ион Среда щелочная лакмус синий фенолфталеин малиновый При температуре окраска исчезнет
- 16. Донорно-акцепторный механизм образования ковалентной связи, которая возникает за счет свободной электронной пары, имеющейся у одного из
- 17. 2) Взаимодействие с кислотами с образованием солей аммония NH3 + HCl NH4 Cl хлорид аммония Вывод:
- 18. Образует кислые и средние соли: NH3 + H2SO4 NH4+HSO4- гидросульфат аммония 2 NH3 + H2SO4 (NH4)2+SO4
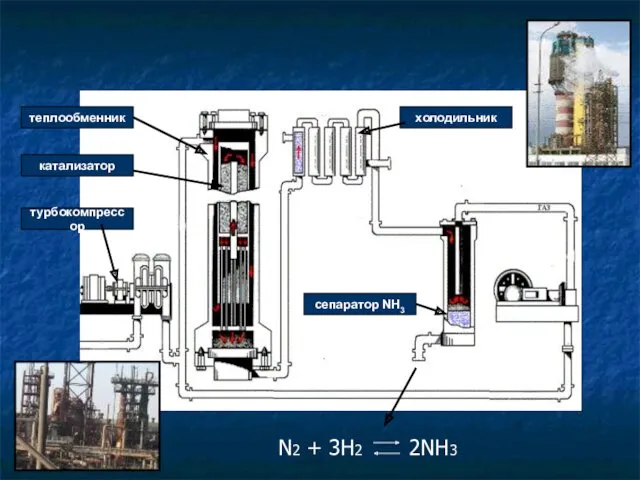
- 19. Получение NH3 1) В промышленности прямым синтезом N2 + 3H2 2 NH3 р = 30 мПа
- 20. теплообменник катализатор турбокомпрессор сепаратор NH3 холодильник N2 + 3H2 2NH3
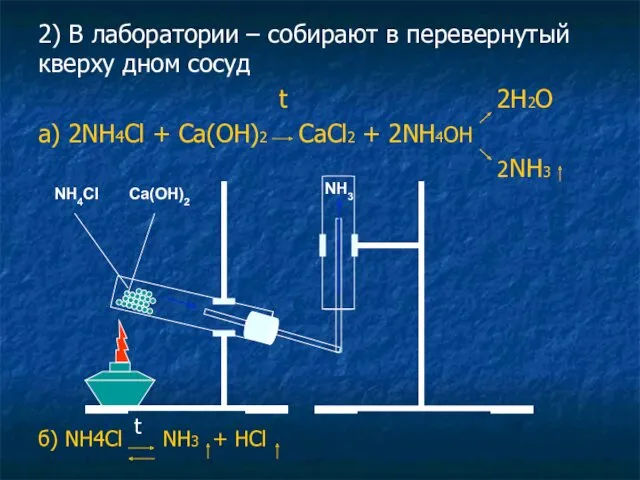
- 21. 2) В лаборатории – собирают в перевернутый кверху дном сосуд t 2H2O а) 2NH4Cl + Ca(OH)2
- 22. Применение NH3 1) Производство HNO3 2) Получение азотных удобрений 3) Получение аммиачной воды В качестве удобрений
- 23. Соли аммония Соли аммония – это сложные вещества, в состав которых входят ионы NH4+, соединенные с
- 24. NH4+ катион (ион аммония) – играет роль катиона металла Cl- анион (хлорид-ион) – кислотный остаток
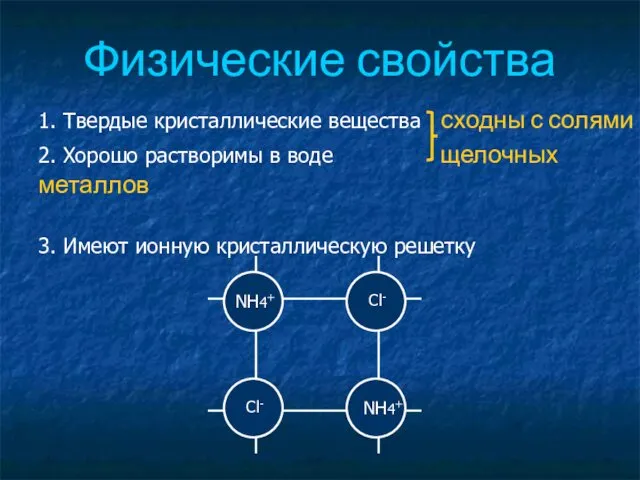
- 25. Физические свойства 1. Твердые кристаллические вещества сходны с солями 2. Хорошо растворимы в воде щелочных металлов
- 26. Химические свойства I. Общие для всех солей а) сильные электролиты – диссоциация на ионы (NH4)2SO4 2NH4+
- 27. в) взаимодействие с солями (если выпадает осадок) NH4Cl + AgNO3 NH4NO3 + AgCl Ag+ + Cl-
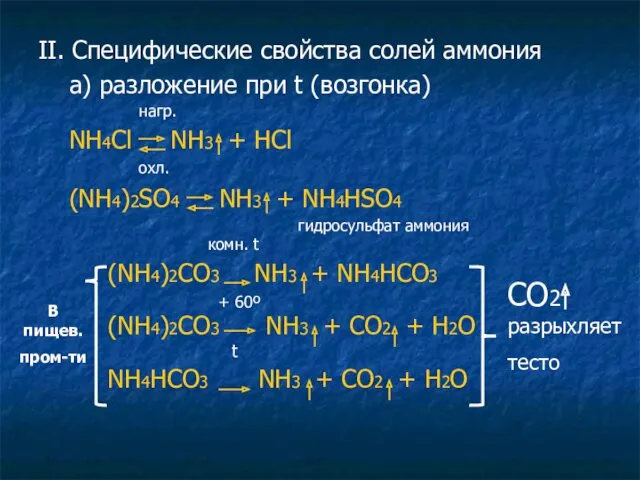
- 28. II. Специфические свойства солей аммония а) разложение при t (возгонка) нагр. NH4Cl NH3 + HCl охл.
- 29. б) со щелочами – взаимодействуют иначе, чем все соли: с образованием NH3 и Н2О – качественные
- 31. Скачать презентацию




















 Файлы и файловая система
Файлы и файловая система База поддержки морских операций. Схема организации территории ТОО Батыс Мунай Транс
База поддержки морских операций. Схема организации территории ТОО Батыс Мунай Транс Дифференциальная диагностика катарально - респираторного синдрома
Дифференциальная диагностика катарально - респираторного синдрома Проект Дмитрий Донской
Проект Дмитрий Донской Практическое применение логарифмической и показательной функций в различных областях естествознания и математики
Практическое применение логарифмической и показательной функций в различных областях естествознания и математики Презентация по теме Зимняя Олимпиада для электронной интерактивной доски SMART Board.
Презентация по теме Зимняя Олимпиада для электронной интерактивной доски SMART Board. Education in Britain
Education in Britain Сущность предпринимательства
Сущность предпринимательства Финансовая подушка безопасности
Финансовая подушка безопасности Пропаганда здорового образа жизни
Пропаганда здорового образа жизни Отчет о ходе внедрения проекта 5С, ТРМ и Процессного подхода (шаблон)
Отчет о ходе внедрения проекта 5С, ТРМ и Процессного подхода (шаблон) Алмазы легенды и действительность
Алмазы легенды и действительность Внимание и личность
Внимание и личность Otoczenie konkurencyjne przedsiębiorstwa
Otoczenie konkurencyjne przedsiębiorstwa Методика обучения чтению на иностранном языке
Методика обучения чтению на иностранном языке Наш фотоальбом
Наш фотоальбом Мектепке информатика пәнін енгізудің мақсаттары мен міндеттері
Мектепке информатика пәнін енгізудің мақсаттары мен міндеттері Сельскохозяйственные животные. Значение животноводства
Сельскохозяйственные животные. Значение животноводства Тундра
Тундра Рисованная история или создание комикса на уроке изобразительного искусства
Рисованная история или создание комикса на уроке изобразительного искусства презентация к уроку
презентация к уроку Презентация Помоги птицам-поможешь себе!
Презентация Помоги птицам-поможешь себе! Город Старый Оскол
Город Старый Оскол Древняя Русь. Наследие предков. Гиперборея или Даария
Древняя Русь. Наследие предков. Гиперборея или Даария Моё место работы
Моё место работы Материалы для подготовки к ГИА
Материалы для подготовки к ГИА Все вокруг-геометрия! Мастер-класс. Элементы Пентамино
Все вокруг-геометрия! Мастер-класс. Элементы Пентамино Рыцарские ордена
Рыцарские ордена