Слайд 2

Жану реакциясы қалай жүреді?
Экзотермиялық реакция деген не?
Эндотермиялық реакция деген не?
Жылу эффекті
Термохимиялық реакцияға анықтама
Жылу эффектінің температураға тәуелділігі
Жанудың басталуы және оны тоқтату
Слайд 3

Кім біледі?
Ауаның құрамына қандай газдар кіреді?
Авагадро санын еске түсіре отырып,ол нещеге
тең екенін айталық?
Молекула дегеніміз не?
Слайд 4

Итальяндық ғалым А.Авогадро
«Газдар құрамына кіретін жай заттардың молекуласы екі атомнан
тұрады»
Мысалы: сутек Н2,оттек О2,азот N2,хлор СІ2
Слайд 5

А.Авогадро заңы (1811 ж)
«Бірдей жағдайда
( температура мен қысымда) әртүрлі газдардың
бірдей көлеміндегі молекулалар саны бірдей болады.
Слайд 6
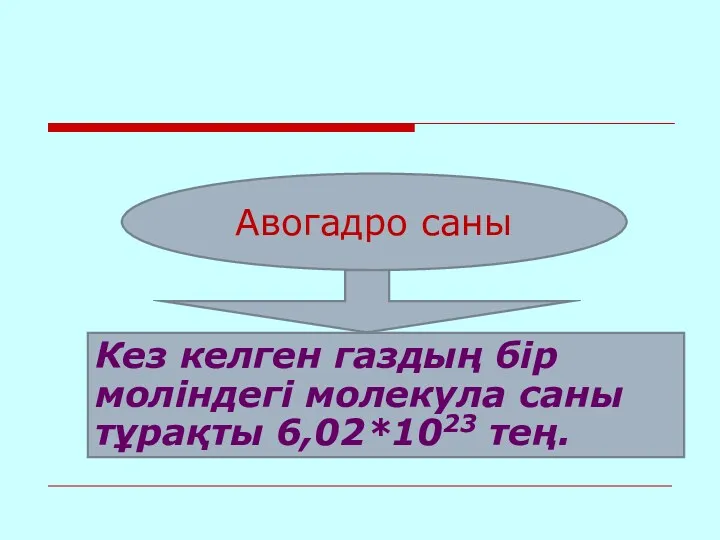
Авогадро саны
Кез келген газдың бір моліндегі молекула саны тұрақты 6,02*1023 тең.
Слайд 7

Қалыпты жағдайда (қ.ж.),яғни 00С температурада, 1 атмосфералық қысымда (101,325 кПа) кез
келген газдың бір молі 22,4л көлем алады.Оны молярлық көлем деп атайды.
Слайд 8

Молярлық көлем берілген газ көлемінің зат мөлшеріне қатынасына тең
=>
;
Слайд 9

Әртүрлі газдардың қалыпты жағдайда молярлық көлемдері бірдей болғанымен,молярлық массалары әртүрлі болады.
Слайд 10
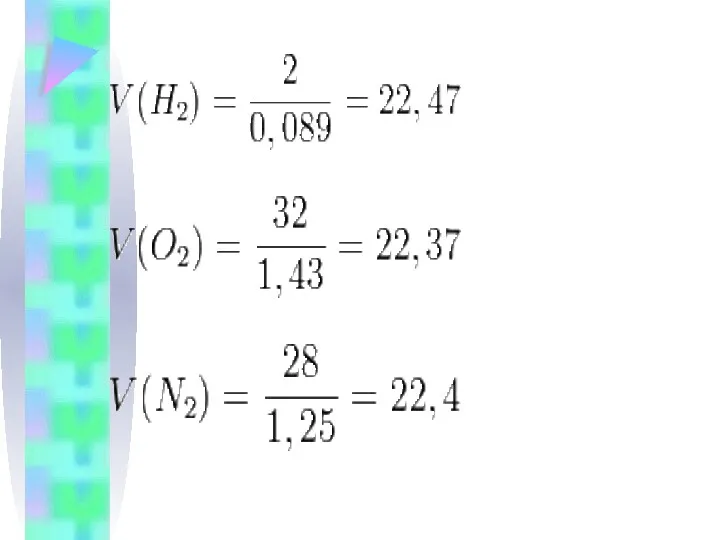
Слайд 11
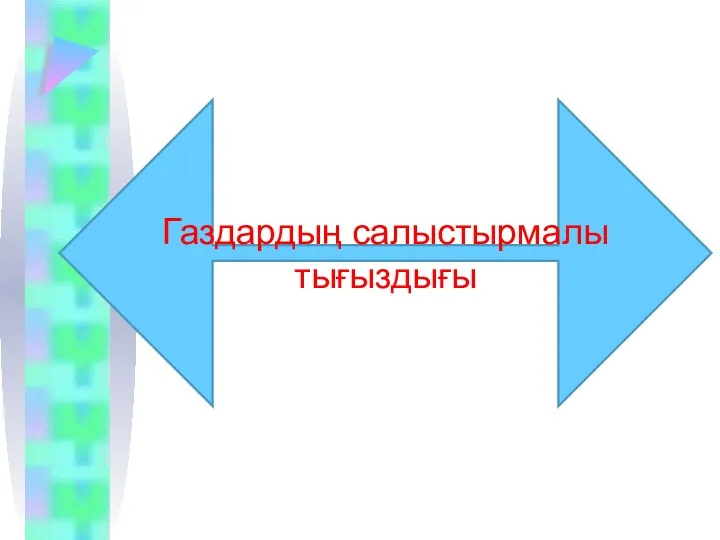
Газдардың салыстырмалы тығыздығы
Слайд 12

Бірдей жағдайда тең көлемде алынған ғаздардың массаларының қатынасын салыстырмалы тығыздық деп
атайды.
Слайд 13
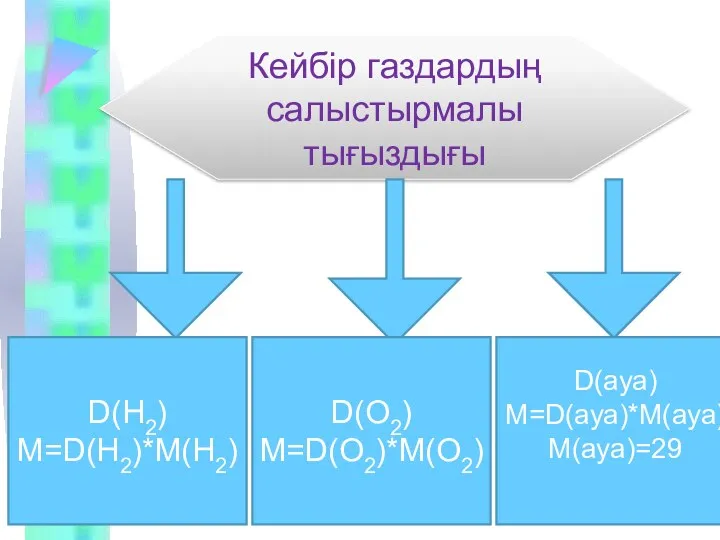
Кейбір газдардың салыстырмалы тығыздығы
D(H2)
M=D(H2)*M(H2)
D(O2)
M=D(O2)*M(O2)
D(ауа)
M=D(ауа)*M(ауа)
M(ауа)=29
Слайд 14
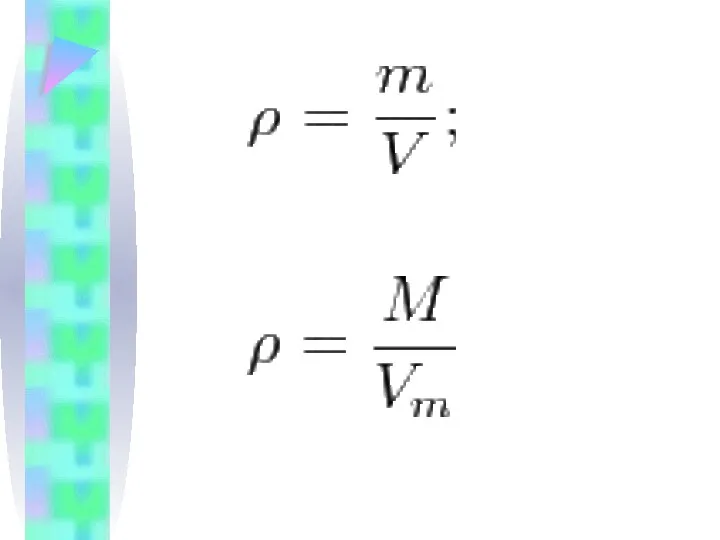
Слайд 15
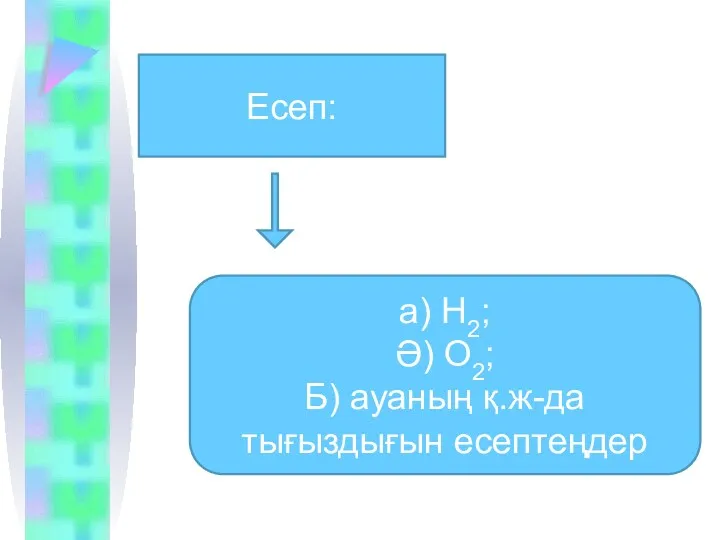
Есеп:
а) Н2;
Ә) О2;
Б) ауаның қ.ж-да тығыздығын есептеңдер








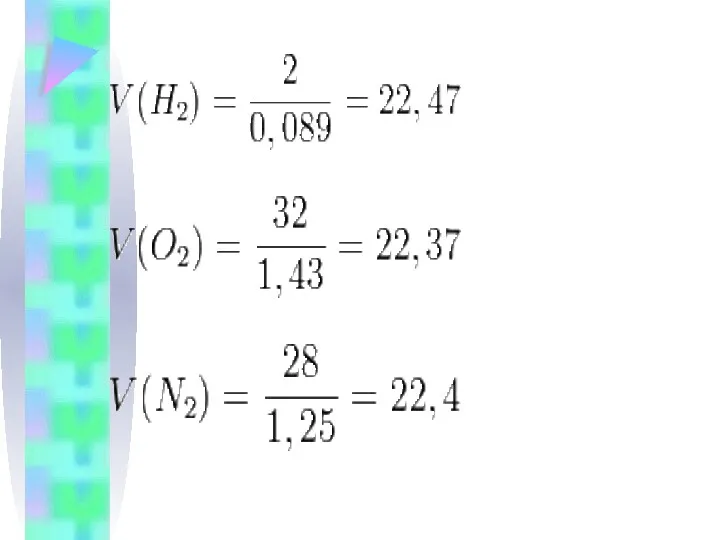



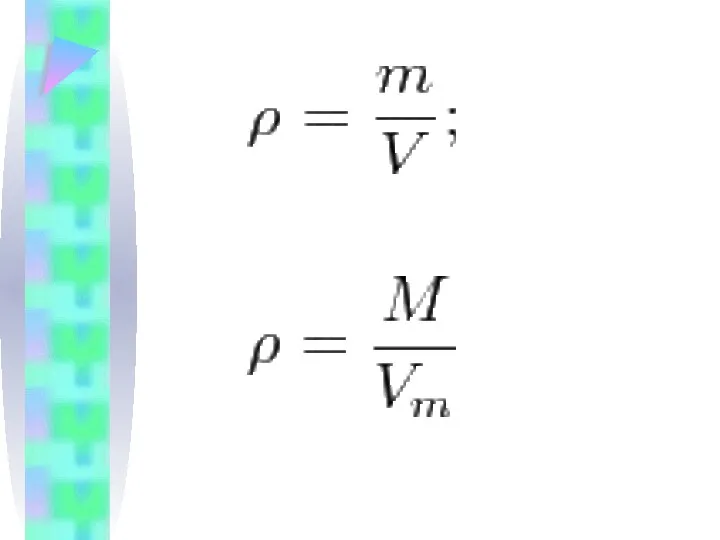

 Нарушение водно-электролитного баланса. Расстройства кровообращения
Нарушение водно-электролитного баланса. Расстройства кровообращения Чем гордится Россия
Чем гордится Россия История развития волейбола, основные правила игры
История развития волейбола, основные правила игры Денежная система Германии
Денежная система Германии Конспект индивидуального логопедического занятия Автоматизация звука Р в словах
Конспект индивидуального логопедического занятия Автоматизация звука Р в словах Семья. Традиции. Обычаи. Семейные ценности
Семья. Традиции. Обычаи. Семейные ценности Тест – программа мониторинга уровня физического развития
Тест – программа мониторинга уровня физического развития Лекция 1. Общая характеристика психологии как науки
Лекция 1. Общая характеристика психологии как науки Многоэтажный жилой дом в Екатеринбурге
Многоэтажный жилой дом в Екатеринбурге Викторина. Евангельские сюжеты в искусстве
Викторина. Евангельские сюжеты в искусстве Мониторинг уровня сформированности у детей коммуникативных умений
Мониторинг уровня сформированности у детей коммуникативных умений Особливості окремих складових третинного сектору. Формування інформаційного суспільства
Особливості окремих складових третинного сектору. Формування інформаційного суспільства Дикунов
Дикунов Профилактика передачи ВИЧ-инфекции в работе медицинской сестры
Профилактика передачи ВИЧ-инфекции в работе медицинской сестры Роль семьи в развитии творческих способностей гиперактивных детей дошкольного возраста(презентация)
Роль семьи в развитии творческих способностей гиперактивных детей дошкольного возраста(презентация) Почвы России урок в 8 классе по УМК Алексеева
Почвы России урок в 8 классе по УМК Алексеева Основы логики
Основы логики Электронды техника ќўраушылары. Заттыѕ ќўрылысы туралы негізгі тїсініктер
Электронды техника ќўраушылары. Заттыѕ ќўрылысы туралы негізгі тїсініктер Жалпы гигиена және экология Бөлменің радиациялық фоны.Радон мен оның өнімдерінің гигиеналық маңызы
Жалпы гигиена және экология Бөлменің радиациялық фоны.Радон мен оның өнімдерінің гигиеналық маңызы Риски предприятий, их предупреждение и страхование
Риски предприятий, их предупреждение и страхование Дидактические игры по математике для дошкольников
Дидактические игры по математике для дошкольников Проект:Сохрани свое здоровье сам
Проект:Сохрани свое здоровье сам Христианство: история и современность. Лекция № 12
Христианство: история и современность. Лекция № 12 Danone. Пищевая промышленность. Продукция: молочные продукты, минеральная вода, детское питание
Danone. Пищевая промышленность. Продукция: молочные продукты, минеральная вода, детское питание Походная геометрия
Походная геометрия Оценивание регулятивного компонента деятельности педагогического работника
Оценивание регулятивного компонента деятельности педагогического работника Список художественной литературы, рекомендованной для семейного чтения с учащимися 1 класса
Список художественной литературы, рекомендованной для семейного чтения с учащимися 1 класса Особенности развития архитектуры и дизайна в странах Восточной Европы во второй половине ХХ века
Особенности развития архитектуры и дизайна в странах Восточной Европы во второй половине ХХ века