Содержание
- 2. БЕЛКИ = ПРОТЕИНЫ (от греч. protos – первый, главный)
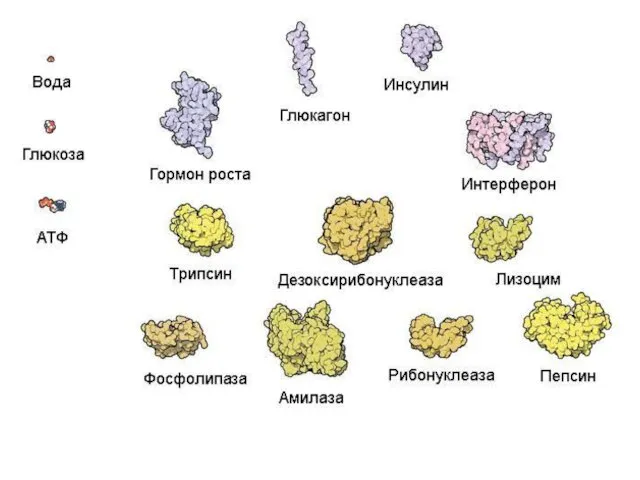
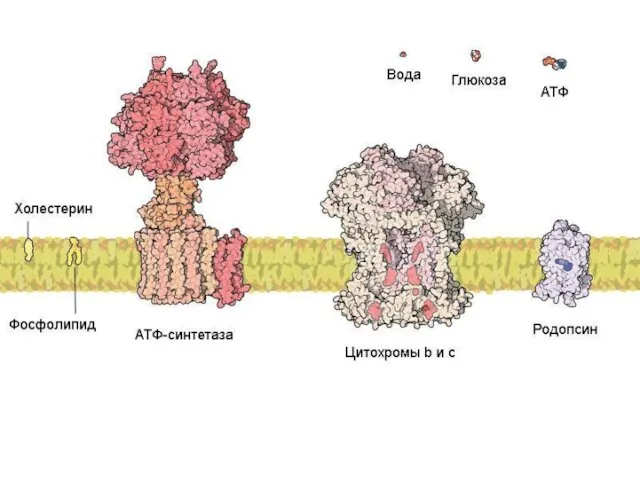
- 6. Животная клетка содержит около 10 миллиардов молекул белков (1010) примерно 10 тысяч видов
- 7. Белки – нерегулярные полимеры, мономерами которых являются аминокислоты Мономеры – 20 аминокислот неразветвленные
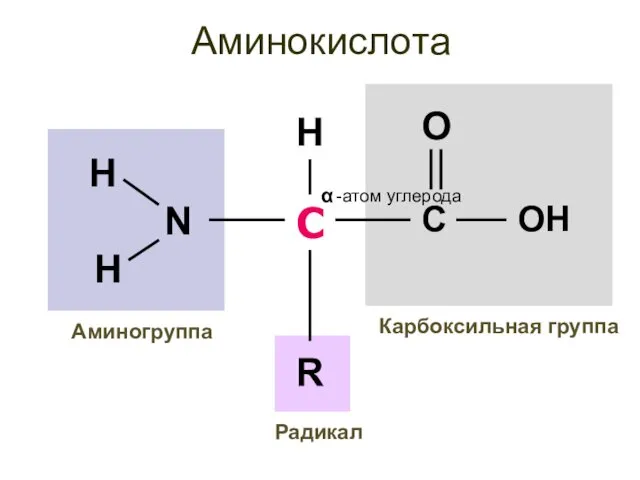
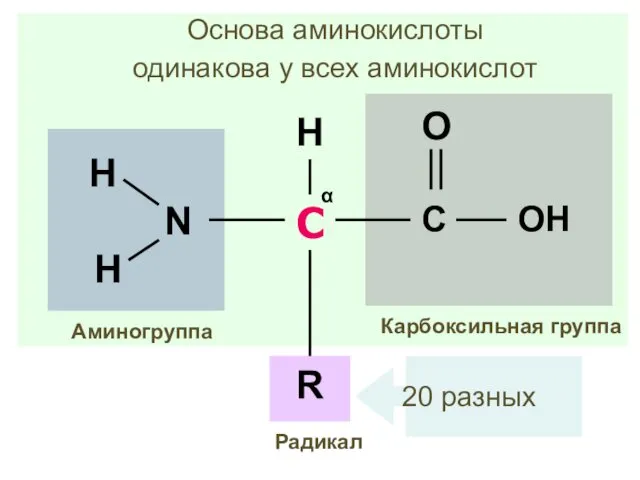
- 8. Аминокислота С -атом углерода α Карбоксильная группа Аминогруппа R H Радикал
- 9. С α Карбоксильная группа Аминогруппа R H Радикал Основа аминокислоты одинакова у всех аминокислот 20 разных
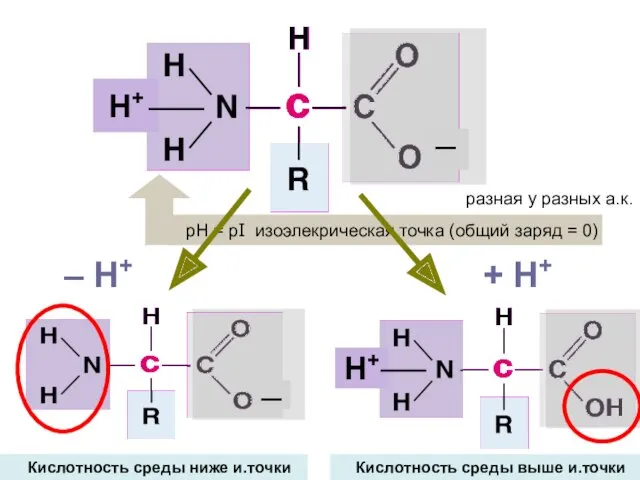
- 10. ─ Н+ разная у разных а.к. + H+ – H+ Кислотность среды выше и.точки Кислотность среды
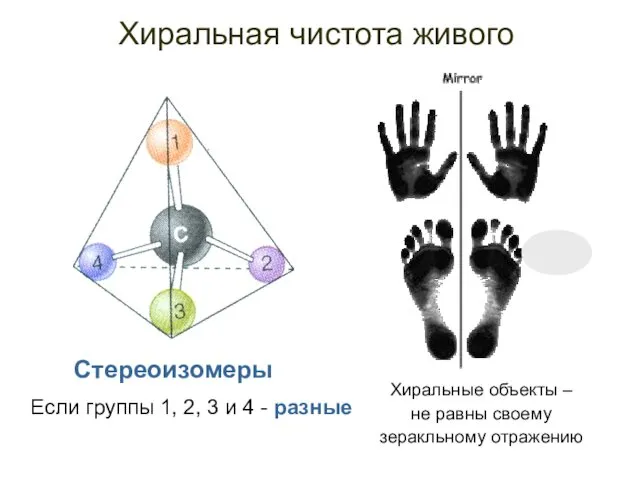
- 11. Хиральная чистота живого Если группы 1, 2, 3 и 4 - разные Хиральные объекты – не
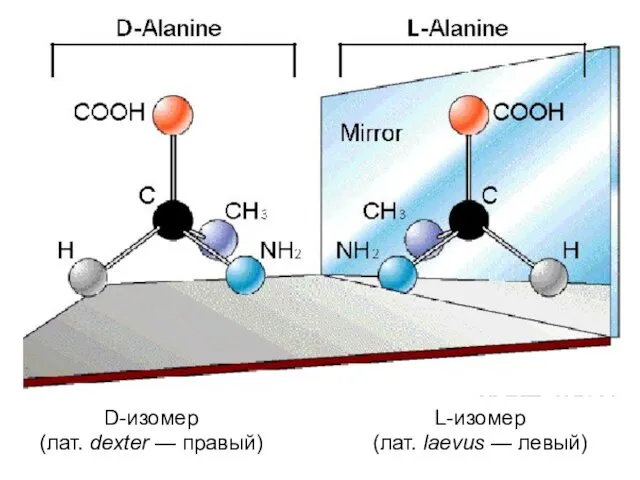
- 12. D-изомер (лат. dexter — правый) L-изомер (лат. laevus — левый)
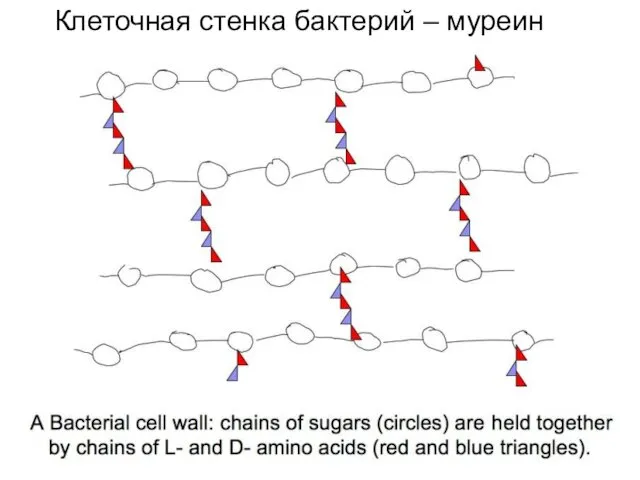
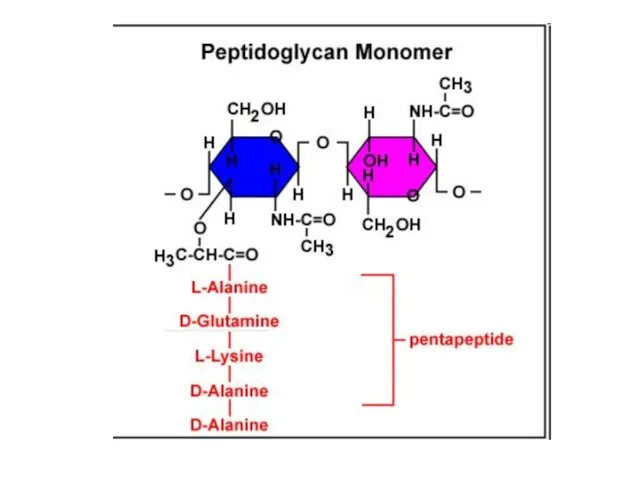
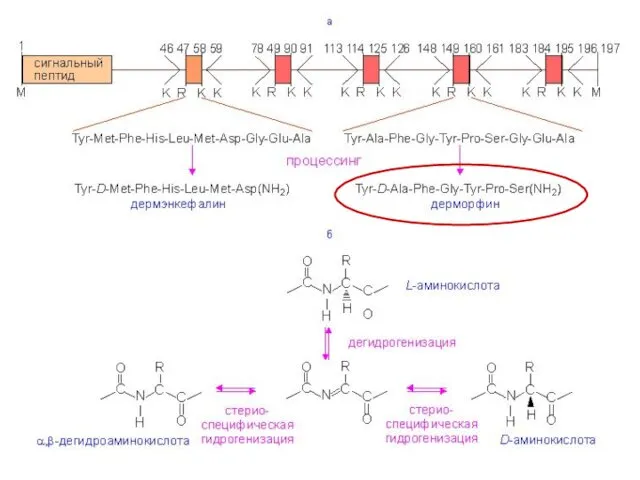
- 13. D-аминокислоты могут входить в состав некоторых коротких пептидов (особенно у бактерий) Эти пептиды синтезируются не на
- 14. Клеточная стенка бактерий – муреин
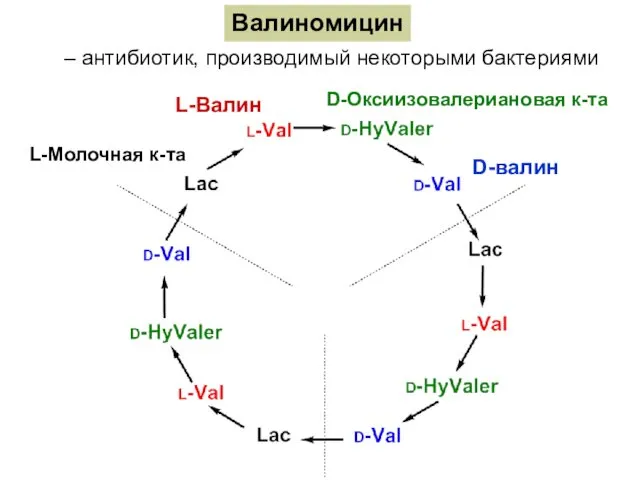
- 16. Валиномицин – антибиотик, производимый некоторыми бактериями
- 17. Tyr – D-Ala – Phe – Gly – Tyr – Pro – Ser-NH2 Дерморфин Пептид из
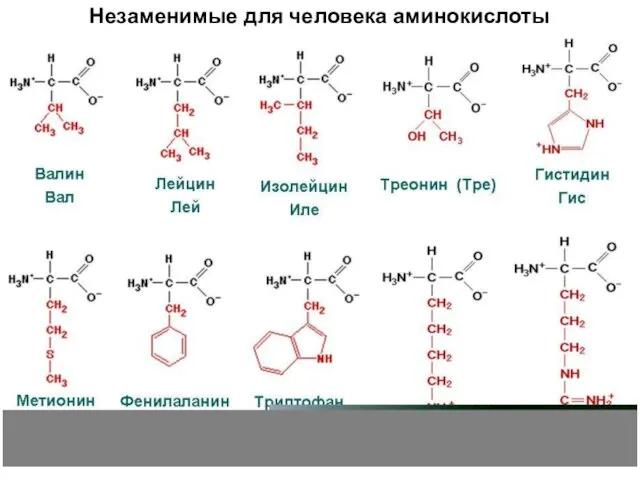
- 20. Незаменимые аминокислоты Организм не может синтезировать сам → должны поступать с пищей. Для человека это 10
- 21. Незаменимые для человека аминокислоты
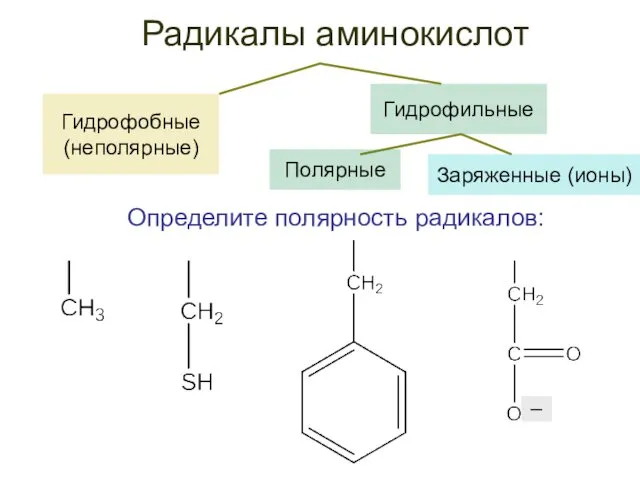
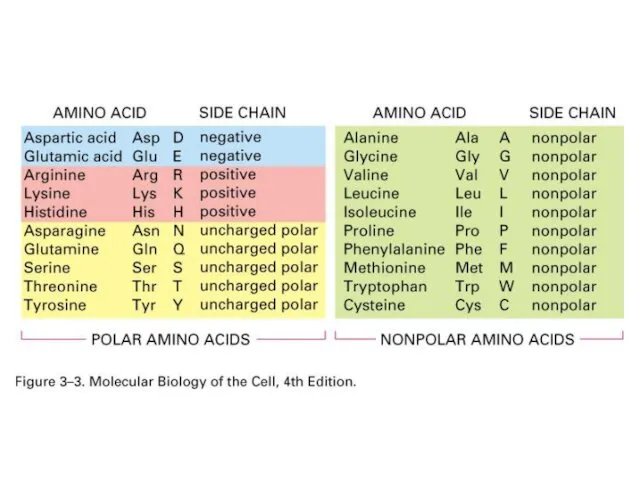
- 22. Гидрофобные (неполярные) Радикалы аминокислот Гидрофильные Определите полярность радикалов:
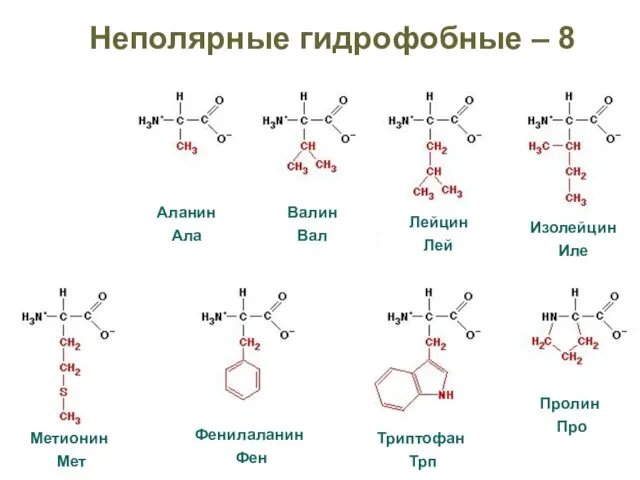
- 23. Неполярные гидрофобные – 8
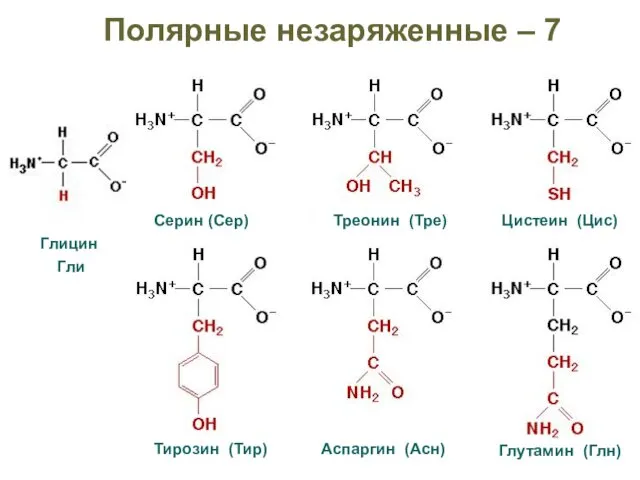
- 24. Полярные незаряженные – 7 Глицин Гли
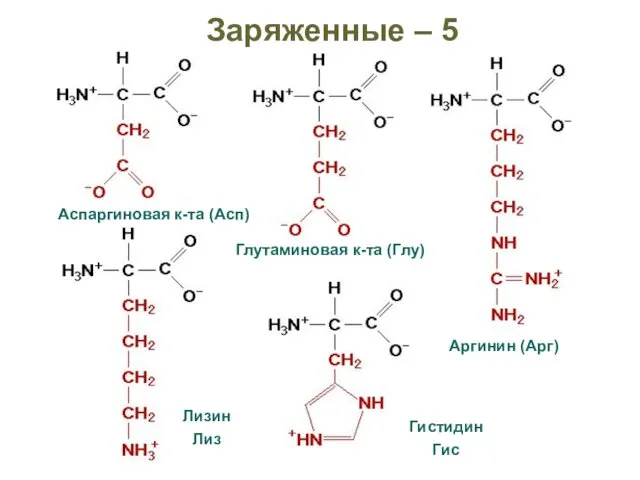
- 25. Заряженные – 5
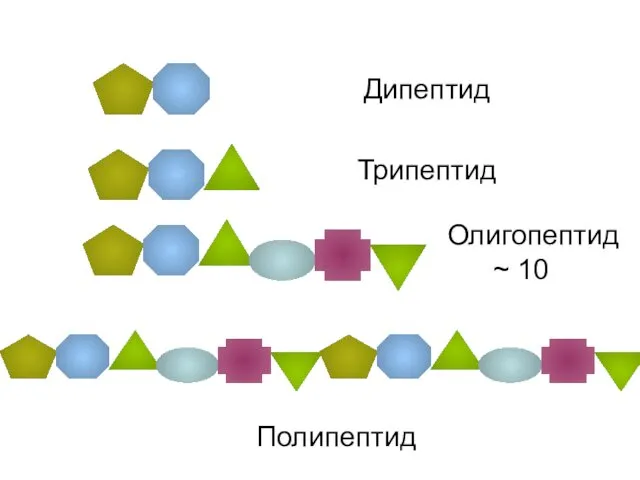
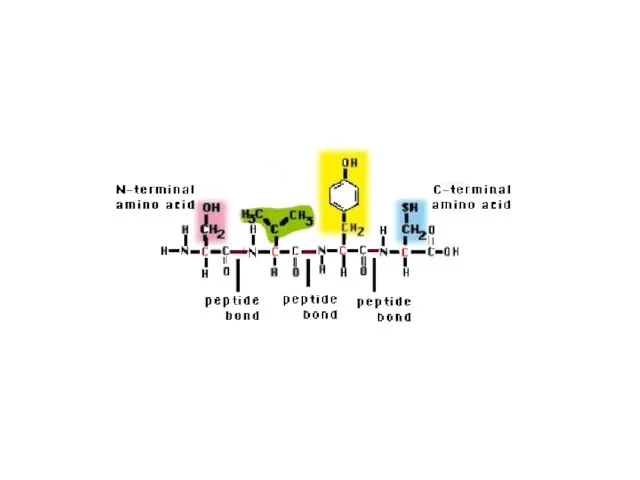
- 28. Дипептид Трипептид Олигопептид ~ 10 Полипептид
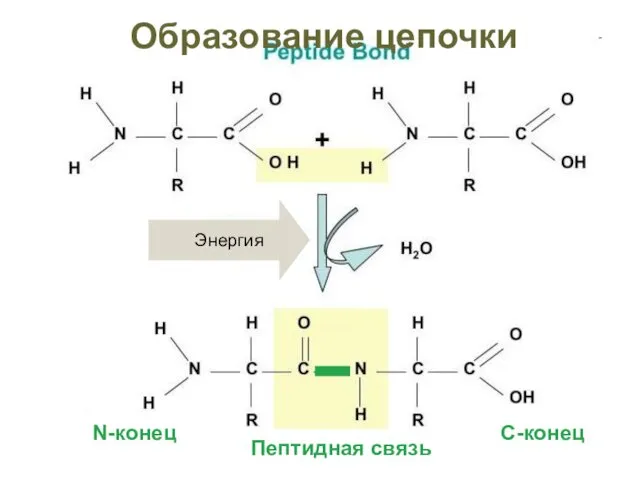
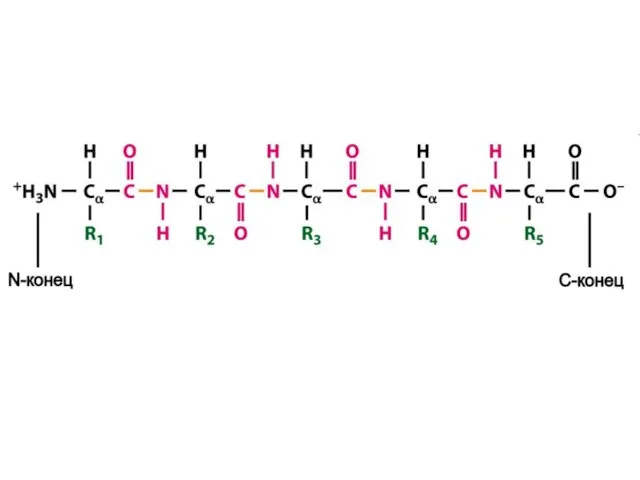
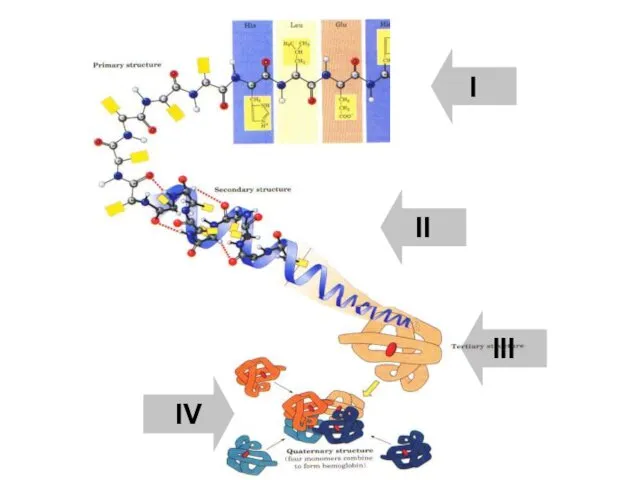
- 29. Первичная структура белка – это последовательность аминокислот в полипептидной цепочке, записанная в порядке N……..C. (соответствует направлению
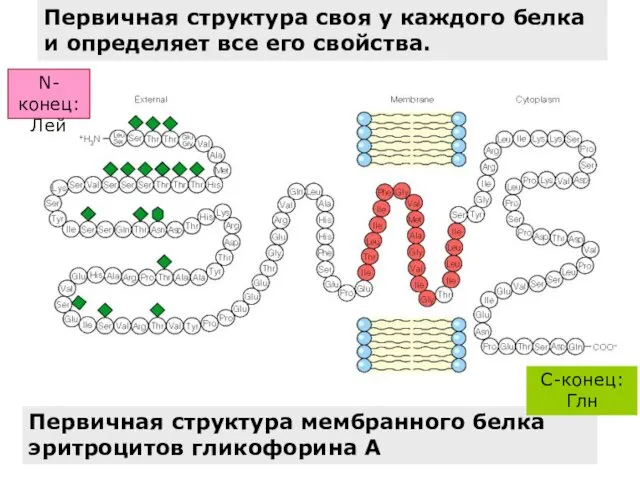
- 31. Первичная структура мембранного белка эритроцитов гликофорина А C-конец: Глн Первичная структура своя у каждого белка и
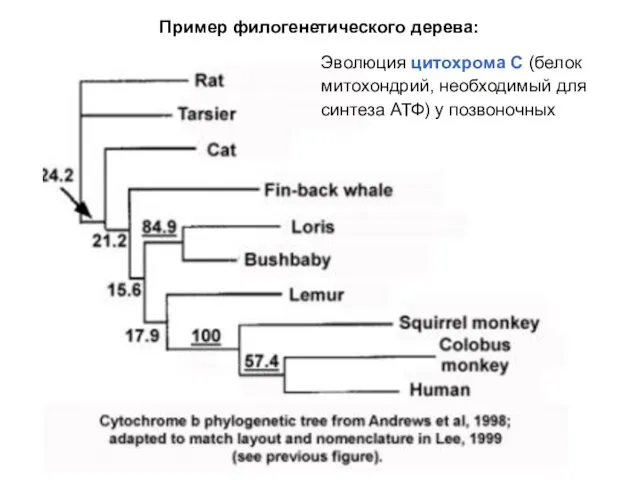
- 32. Белки с одной функцией у родственных видов имеют сходную I структуру Количество отличий отражает время их
- 33. Эволюция цитохрома С (белок митохондрий, необходимый для синтеза АТФ) у позвоночных Пример филогенетического дерева:
- 34. Эволюция шаперонина-60 за ~1.5 млрд.лет Растения и грибы Животные Простейшие Бактерии Найдите участки белка, эволюционирующие быстро
- 35. Сколько разных белков длиной в n мономеров можно построить из 20 а.к.? 20n Средний белок: 300
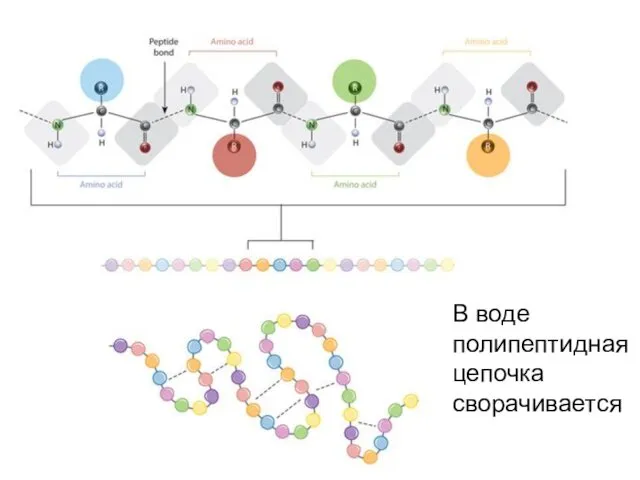
- 36. В воде полипептидная цепочка сворачивается
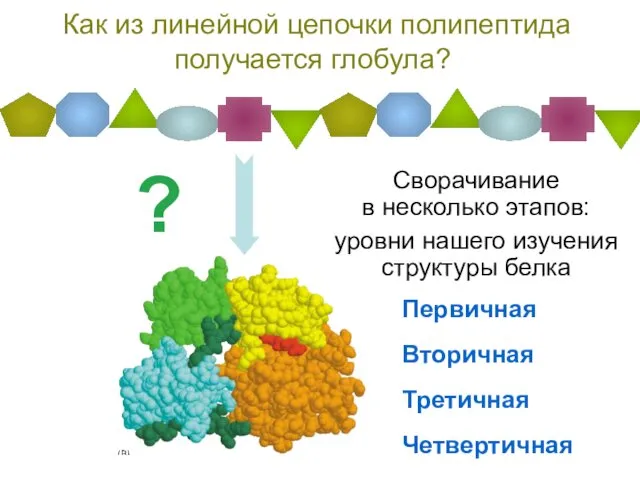
- 37. Как из линейной цепочки полипептида получается глобула? Сворачивание в несколько этапов: уровни нашего изучения структуры белка
- 38. I II III IV
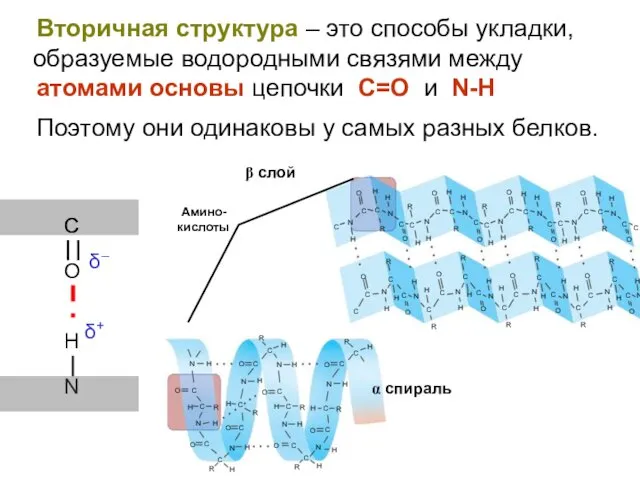
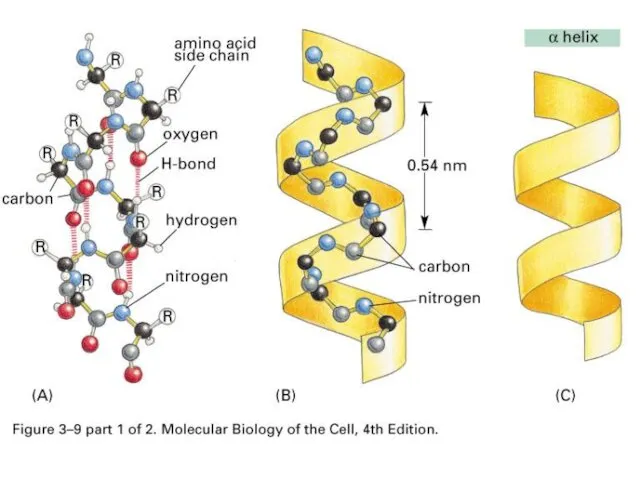
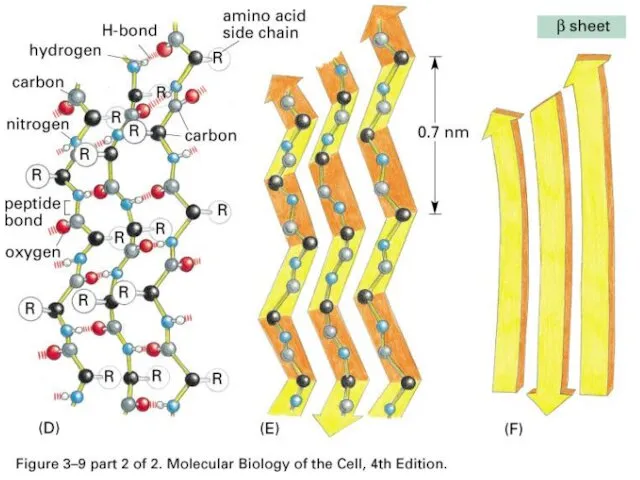
- 39. Вторичная структура – это способы укладки, образуемые водородными связями между атомами основы цепочки С=O и N-H
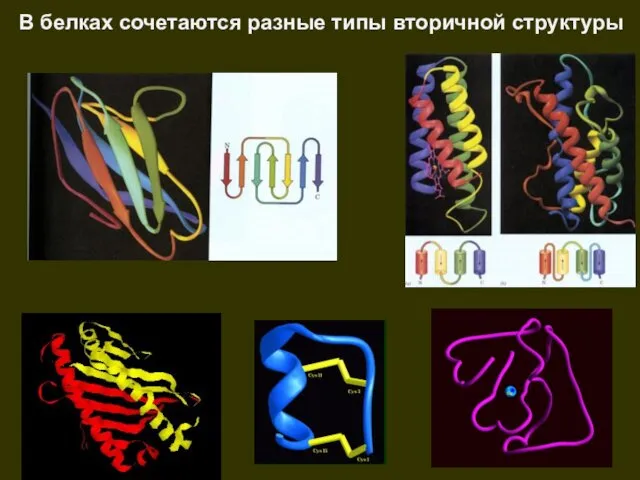
- 43. В белках сочетаются разные типы вторичной структуры
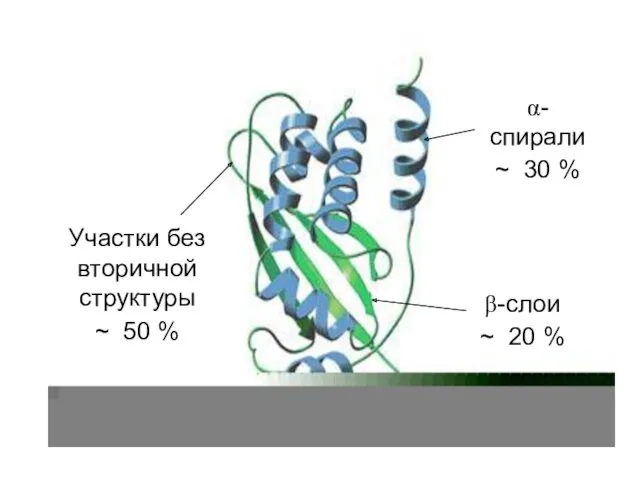
- 44. Встречаемость в белках разных вторичных структур 28% – 35% 18% – 26% 40% – 50% Нет
- 45. α-спирали ~ 30 % β-слои ~ 20 % Участки без вторичной структуры ~ 50 %
- 46. Лайнус Полинг Открытие α-спирали в 1951
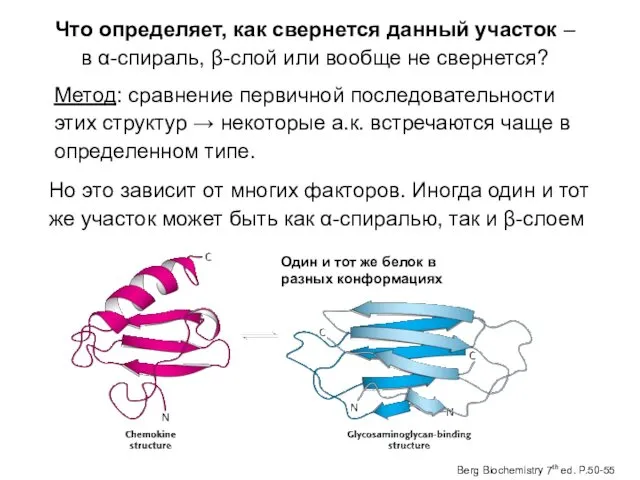
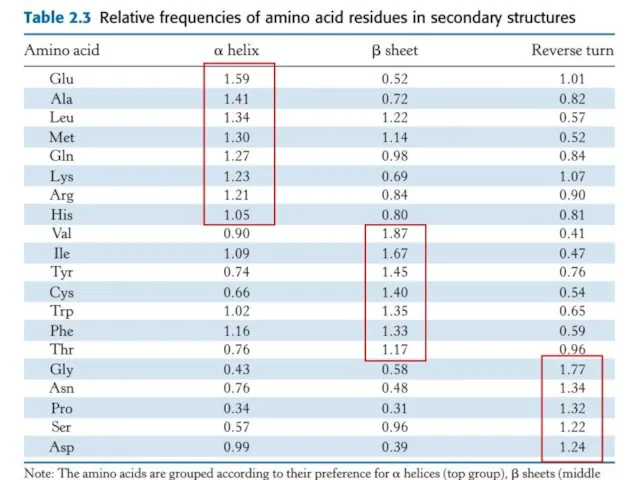
- 47. Что определяет, как свернется данный участок – в α-спираль, β-слой или вообще не свернется? Метод: сравнение
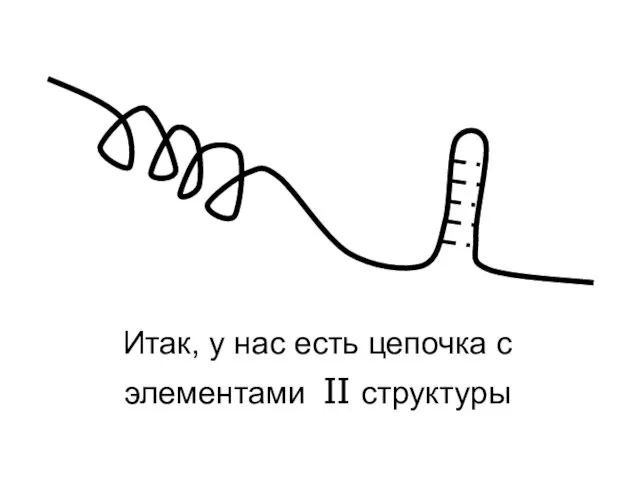
- 49. Итак, у нас есть цепочка с элементами II структуры
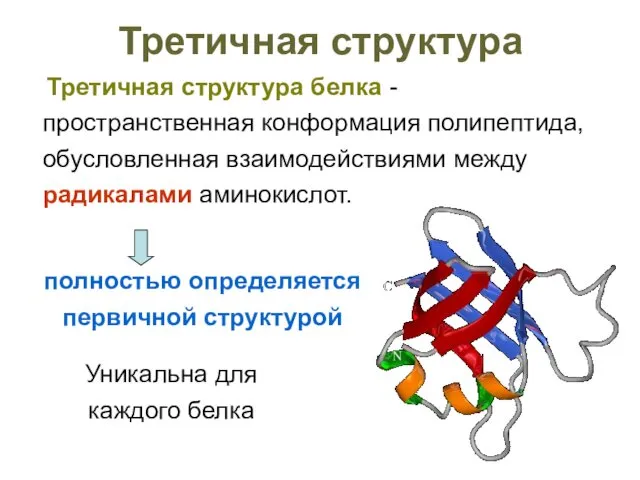
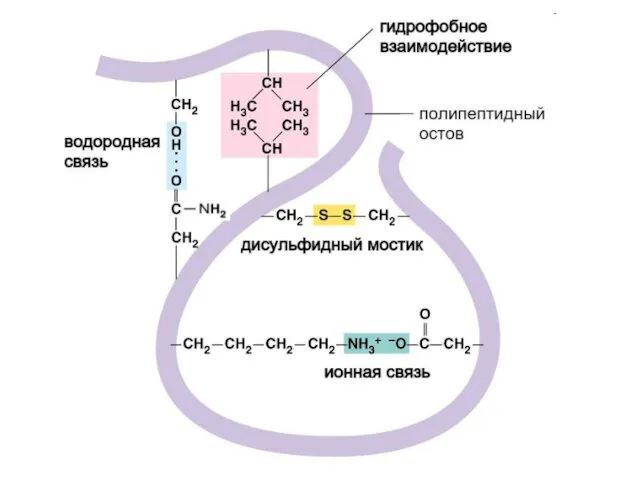
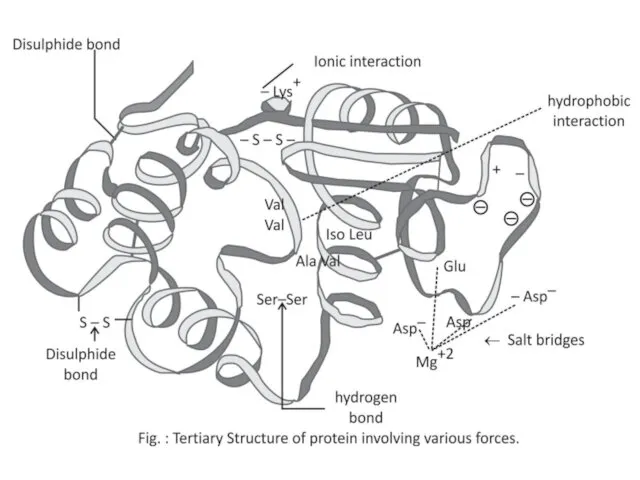
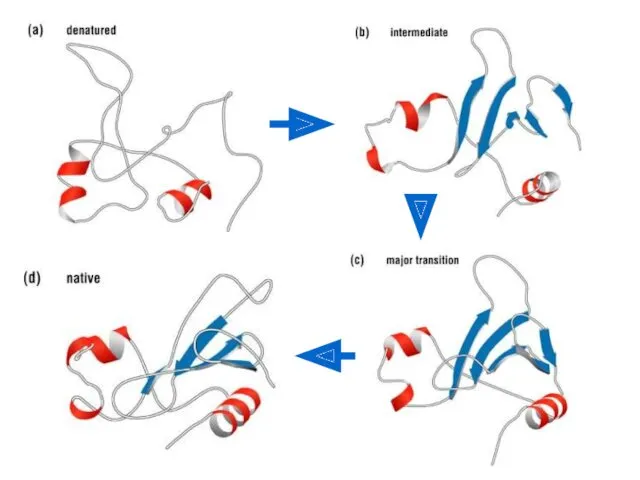
- 50. Третичная структура Третичная структура белка - пространственная конформация полипептида, обусловленная взаимодействиями между радикалами аминокислот. Уникальна для
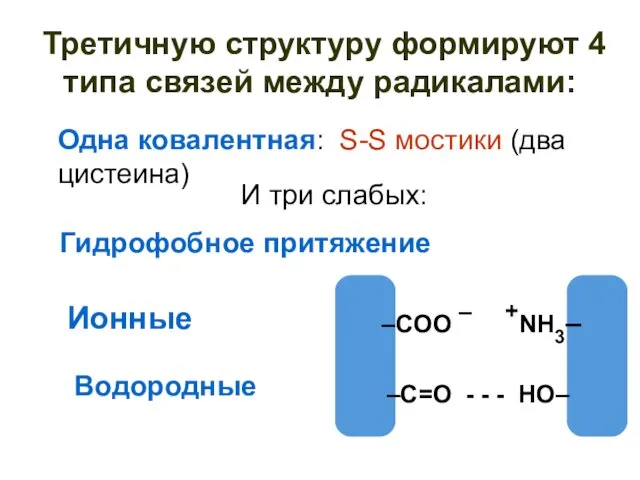
- 51. Третичную структуру формируют 4 типа связей между радикалами: Ионные –COO – +NH3– –C=O - - -
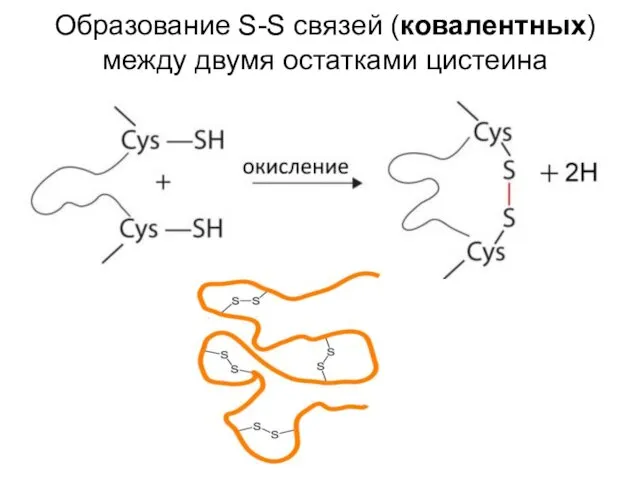
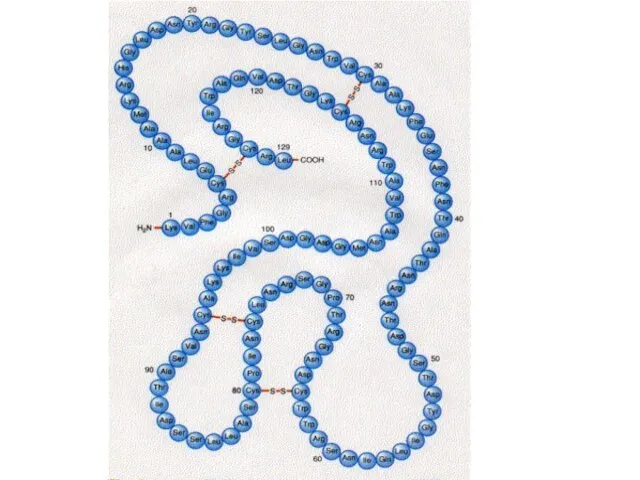
- 52. Образование S-S связей (ковалентных) между двумя остатками цистеина
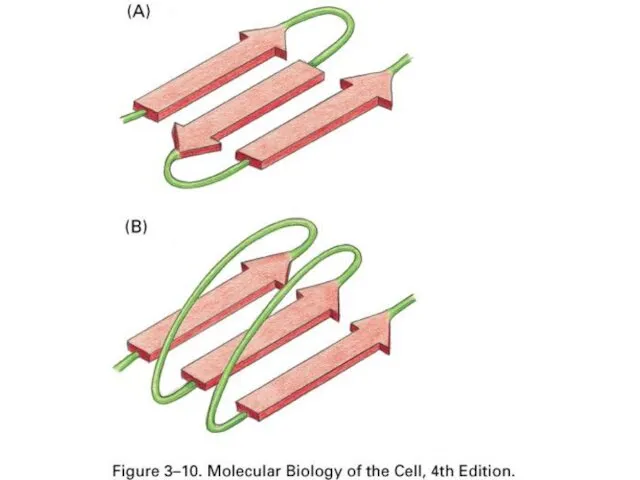
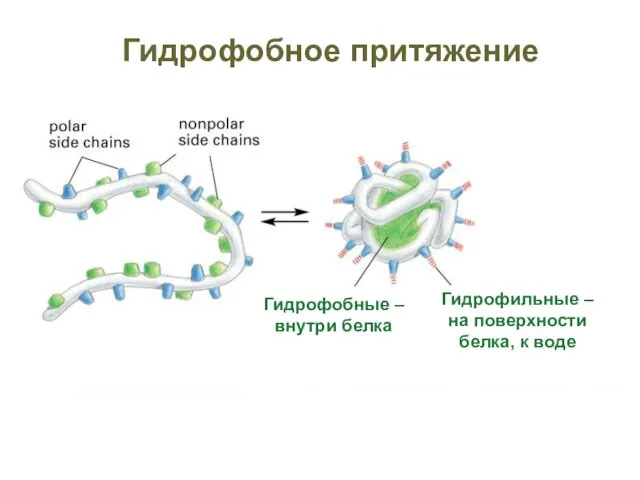
- 54. Гидрофобное притяжение
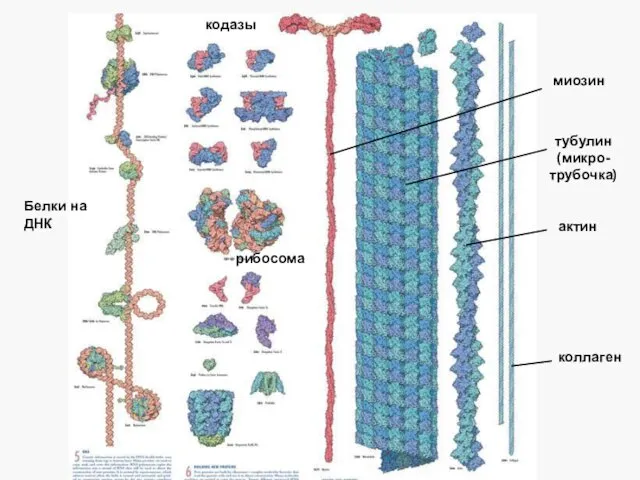
- 57. Глобулярный белок Фибриллярный белок Глобула - шарик Фибрилла - нить
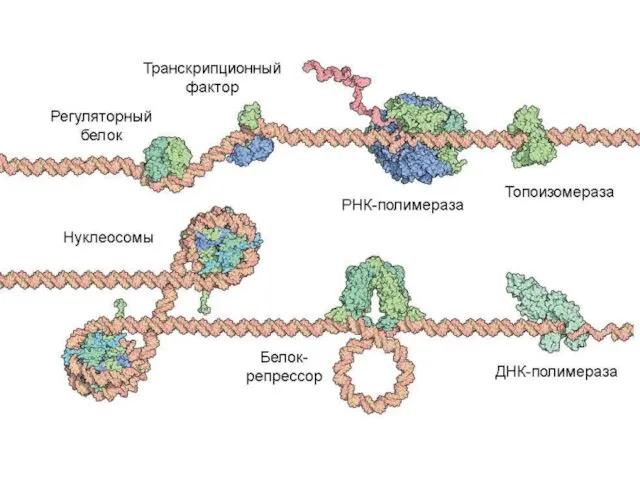
- 58. коллаген актин миозин тубулин (микро-трубочка) кодазы Белки на ДНК рибосома
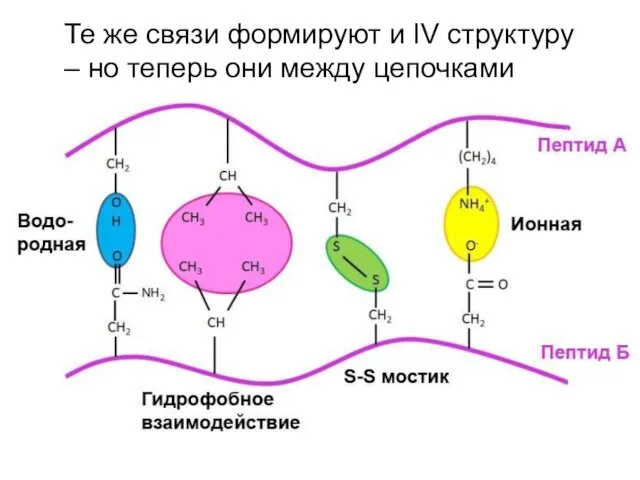
- 59. Четвертичная структура Объединение двух и более (до 20) полипептидных цепочек в один белок. Одна цепочка =
- 60. Те же связи формируют и IV структуру – но теперь они между цепочками
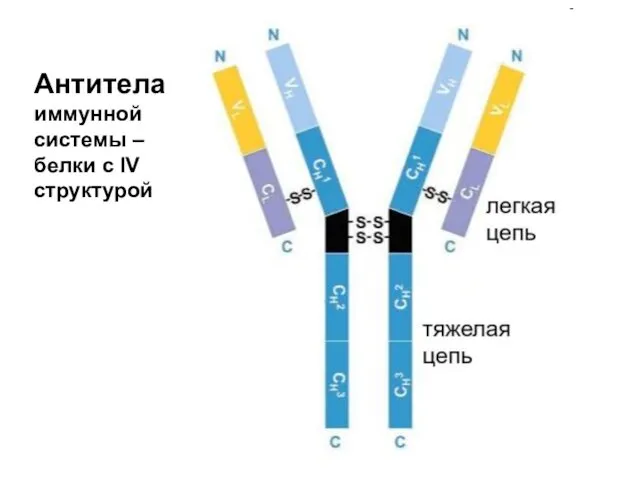
- 61. Антитела иммунной системы – белки с IV структурой
- 62. Четвертичная структура IV Разные цепочки – разным цветом
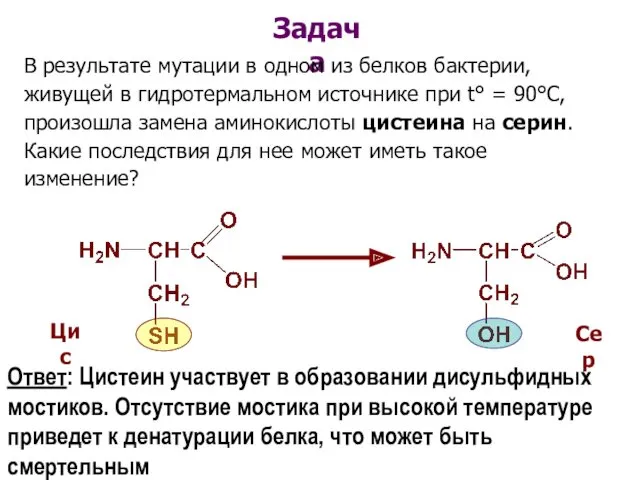
- 63. Задача В результате мутации в одном из белков бактерии, живущей в гидротермальном источнике при t° =
- 64. Белковые домены
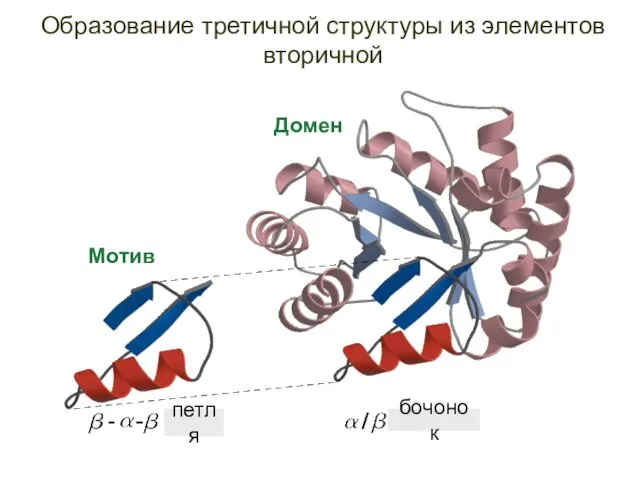
- 65. Образование третичной структуры из элементов вторичной Мотив Домен
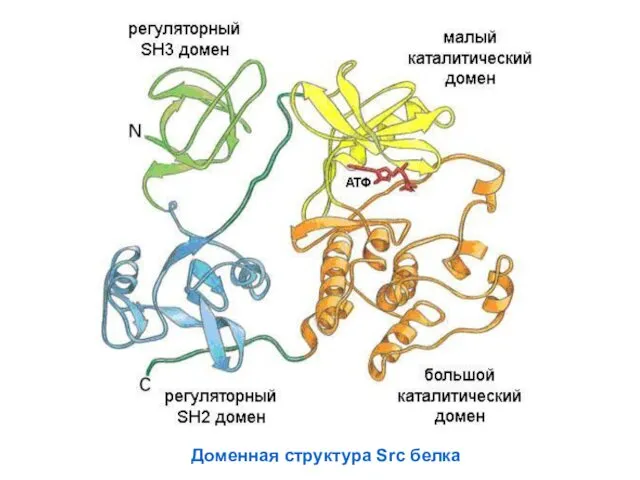
- 67. Доменная структура Src белка
- 68. Домен – часть белка выделенная структурно (сворачивается почти независимо) выполняет одну функцию В эволюции домены –
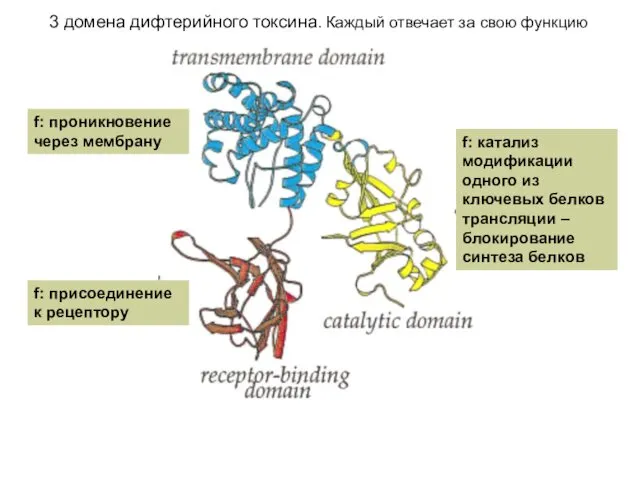
- 69. 3 домена дифтерийного токсина. Каждый отвечает за свою функцию f: присоединение к рецептору f: проникновение через
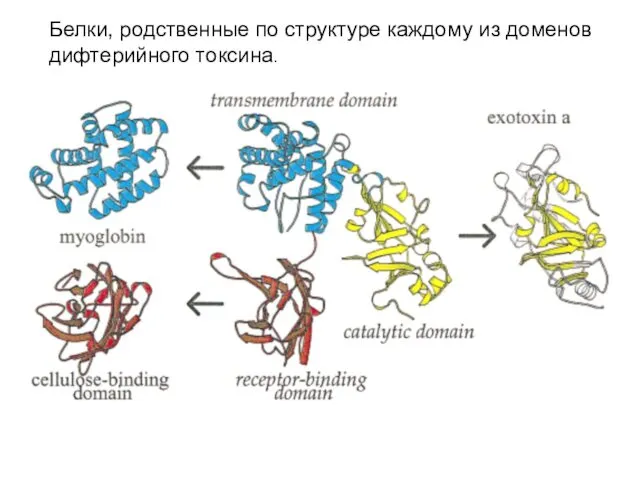
- 70. Белки, родственные по структуре каждому из доменов дифтерийного токсина.
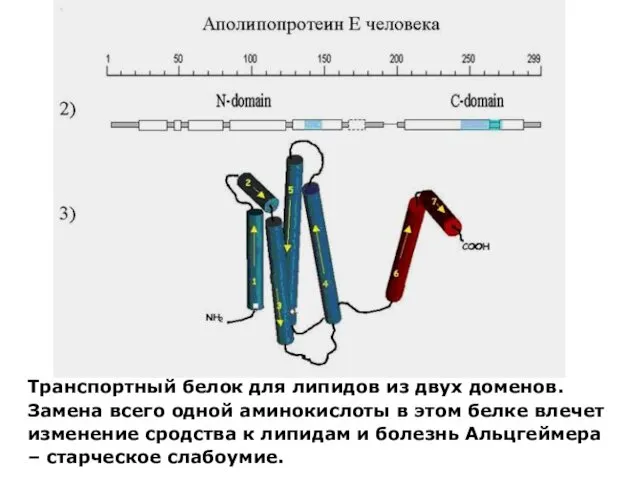
- 71. Транспортный белок для липидов из двух доменов. Замена всего одной аминокислоты в этом белке влечет изменение
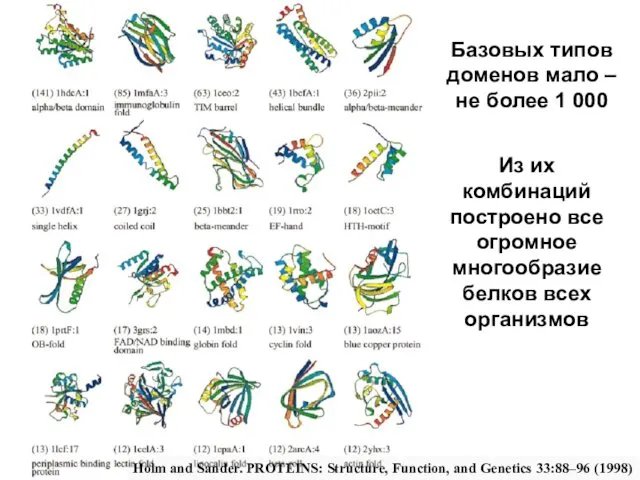
- 72. Базовых типов доменов мало – не более 1 000 Holm and Sander. PROTEINS: Structure, Function, and
- 73. Белки разных биологических видов с одной функцией – похожи по пространственной форме Хотя первичная последователь-ность может
- 74. Транспортный белок железа – ферритин человека (зеленый) и лошади (голубой)
- 75. Домашнее задание Уметь нарисовать аминокислоту и пептидную связь. Знать, что такое I, II, III и IV
- 76. Лишние слайды
- 79. Для биологических молекул важны не только химическая формула, но и форма Узнавание «ключ к замку»
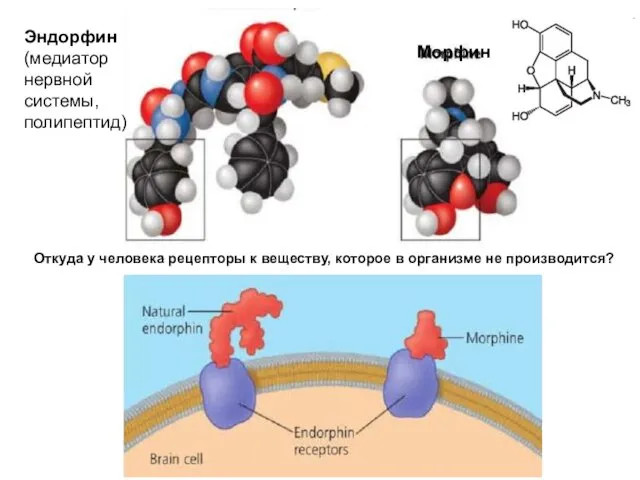
- 80. Эндорфин (медиатор нервной системы, полипептид) Морфин Откуда у человека рецепторы к веществу, которое в организме не
- 82. Скачать презентацию
























 Web Telex Release System
Web Telex Release System Студенческая футбольная лига
Студенческая футбольная лига Безопасность детей - забота взрослых
Безопасность детей - забота взрослых Интерактивная физминутка Путешествие с облаками
Интерактивная физминутка Путешествие с облаками Белый тигр
Белый тигр Cheese production
Cheese production Турбины ТЭС и АЭС. Часть1. Теория теплового процесса
Турбины ТЭС и АЭС. Часть1. Теория теплового процесса Преимущество новой формы плинтуса QSSK(-)
Преимущество новой формы плинтуса QSSK(-) Творчески - информационный проект Один дома
Творчески - информационный проект Один дома Язвенная болезнь
Язвенная болезнь Орнамент в полосе (урок технологии, 1 класс)
Орнамент в полосе (урок технологии, 1 класс) Средства физического воспитания
Средства физического воспитания исИстория органов внутренних дел Российской Федерации.тория
исИстория органов внутренних дел Российской Федерации.тория Портфолио профессиональной деятельности Агачкиной Надежды Александровны, учителя начальных классов МОУ СОШ п.Заволжский Пугачевского района Саратовской области
Портфолио профессиональной деятельности Агачкиной Надежды Александровны, учителя начальных классов МОУ СОШ п.Заволжский Пугачевского района Саратовской области Использование предлога НА
Использование предлога НА Основы андрогогики или секреты обучения взрослых людей
Основы андрогогики или секреты обучения взрослых людей Презентация защита прав и достоинства ребенка
Презентация защита прав и достоинства ребенка Теории X и Y Дугласа Мак Грегора
Теории X и Y Дугласа Мак Грегора Үгінді печенье
Үгінді печенье Презентация Тюльпан
Презентация Тюльпан Анафилактикалық шок
Анафилактикалық шок Тақырыбы: Миокардит
Тақырыбы: Миокардит Основы военной службы. Тест. 11 класс
Основы военной службы. Тест. 11 класс Внеклассное мероприятие по математике Интеллектуальный марафон
Внеклассное мероприятие по математике Интеллектуальный марафон Способы подготовки различных поверхностей под оклейку различными видами обоев
Способы подготовки различных поверхностей под оклейку различными видами обоев Возникновение искусства и религиозных верований
Возникновение искусства и религиозных верований Календарные Христианские праздники
Календарные Христианские праздники Относись к каждому гостю, как к другу
Относись к каждому гостю, как к другу