Содержание
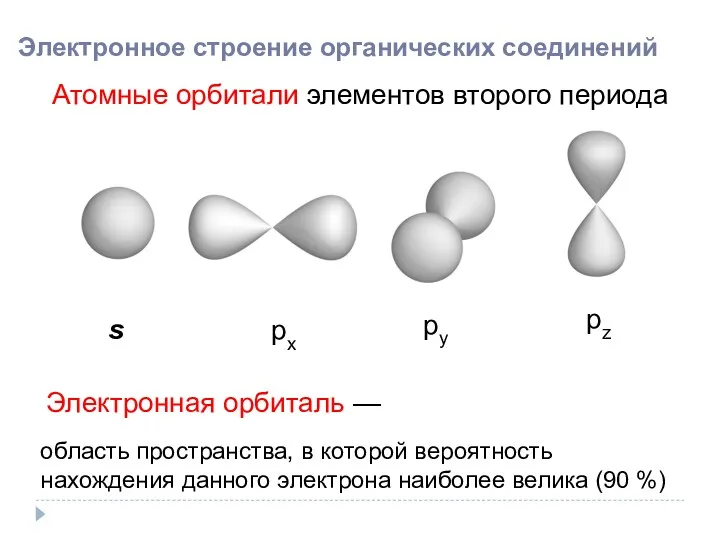
- 2. Электронное строение органических соединений Электронная орбиталь — Атомные орбитали элементов второго периода s px py pz
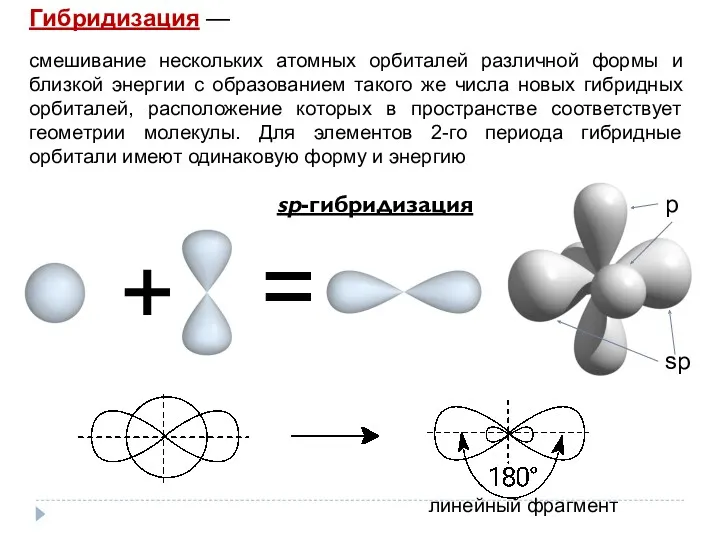
- 3. = + sp-гибридизация Гибридизация — смешивание нескольких атомных орбиталей различной формы и близкой энергии с образованием
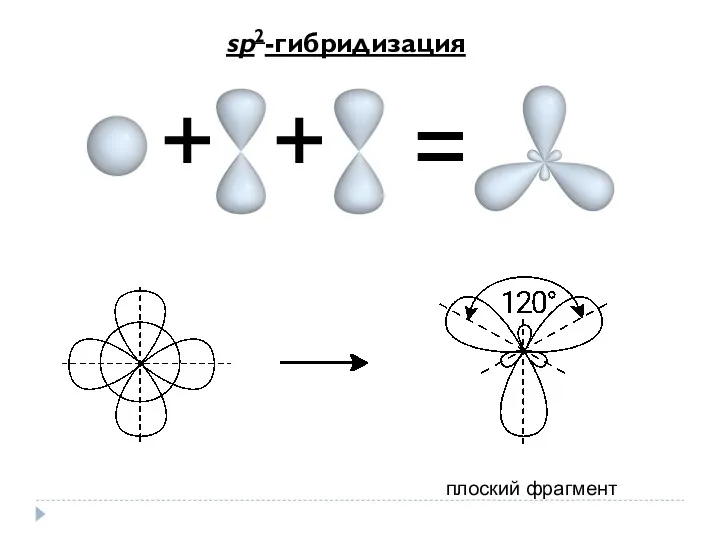
- 4. = + + sp2-гибридизация плоский фрагмент
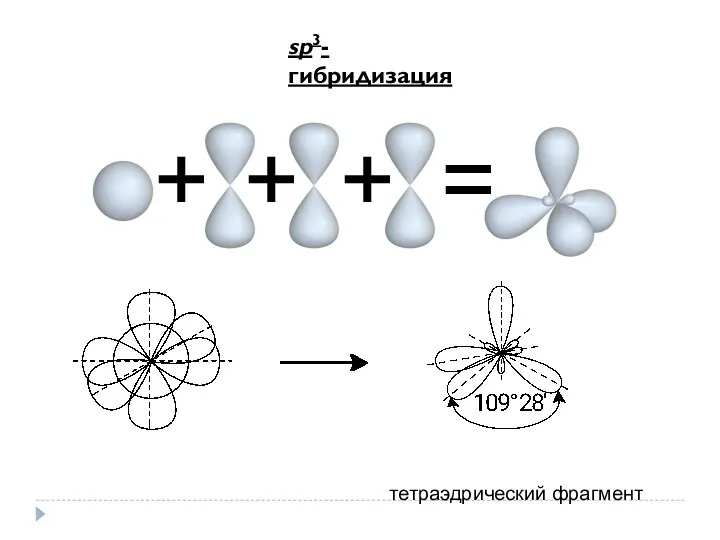
- 5. sp3-гибридизация = + + + тетраэдрический фрагмент
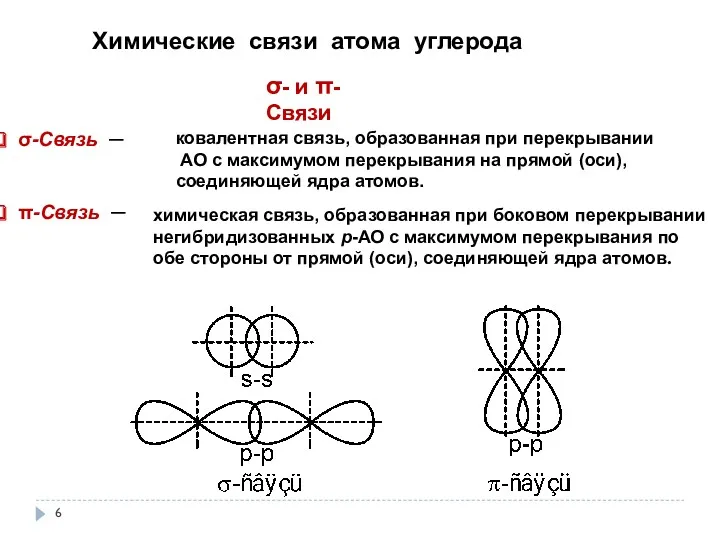
- 6. π-Связь ─ σ-Связь ─ σ- и π-Связи Химические связи атома углерода ковалентная связь, образованная при перекрывании
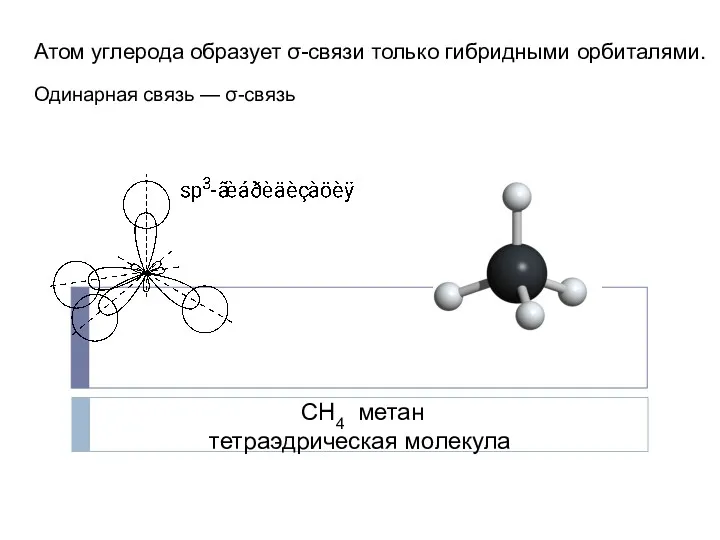
- 7. Атом углерода образует σ-связи только гибридными орбиталями. СН4 метан тетраэдрическая молекула Одинарная связь — σ-связь
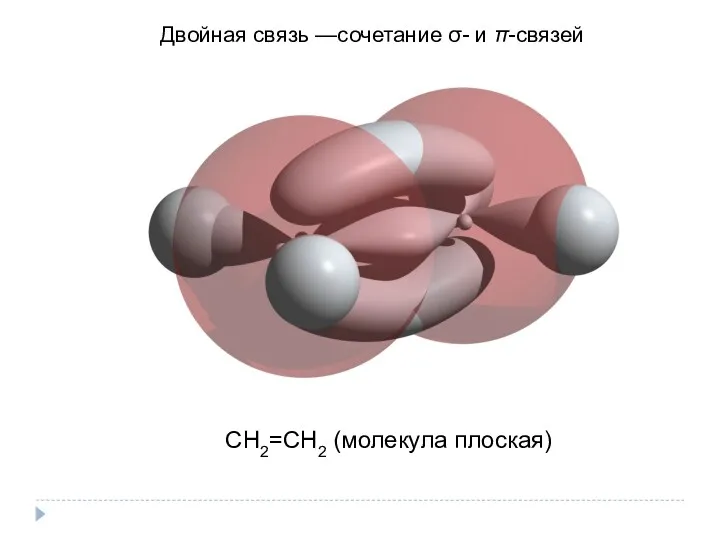
- 8. Двойная связь —сочетание σ- и π-связей СН2=СН2 (молекула плоская)
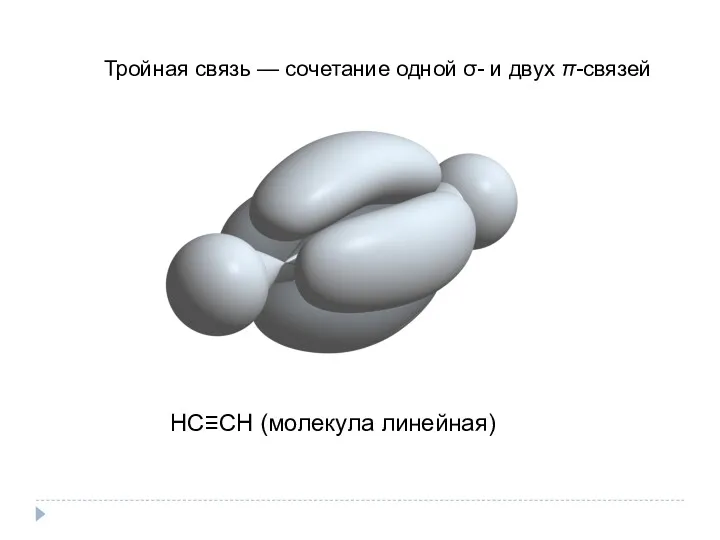
- 9. Тройная связь — сочетание одной σ- и двух π-связей НС≡СН (молекула линейная)
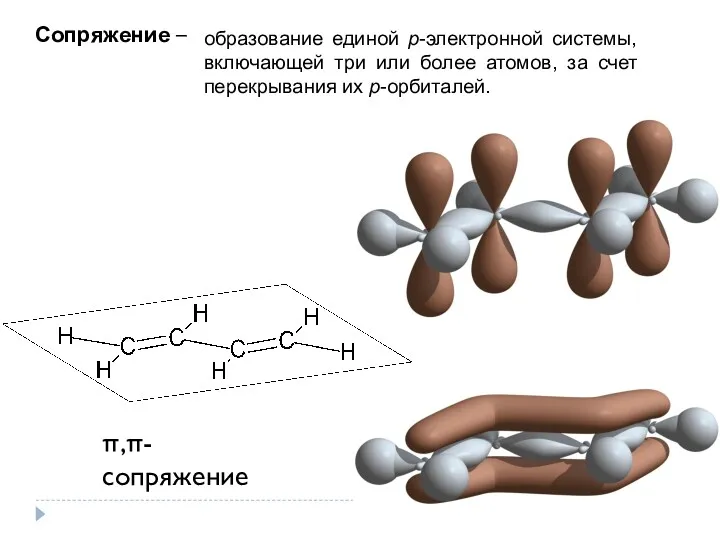
- 10. Сопряжение – π,π-сопряжение образование единой р-электронной системы, включающей три или более атомов, за счет перекрывания их
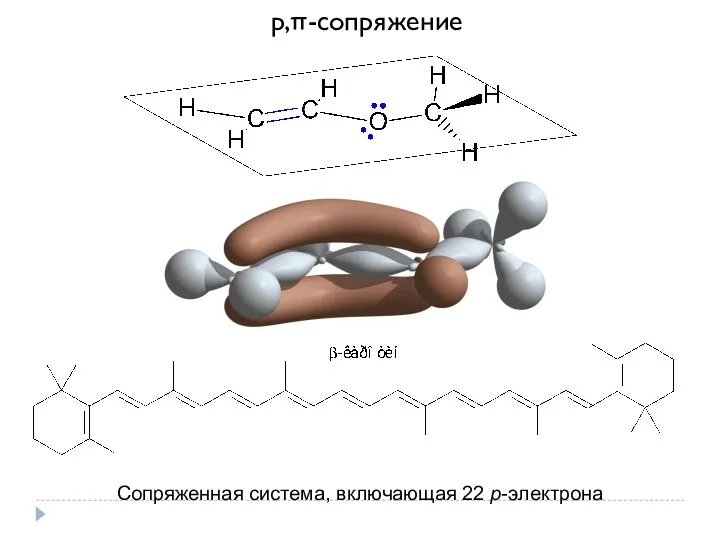
- 11. p,π-cопряжение Сопряженная система, включающая 22 р-электрона
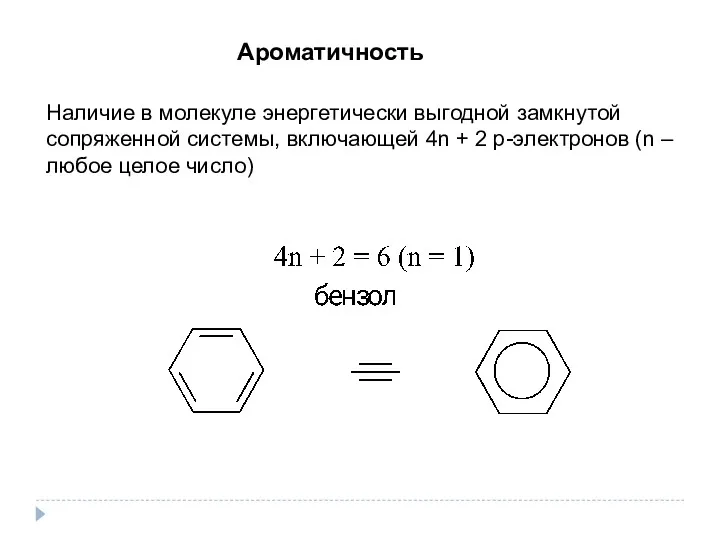
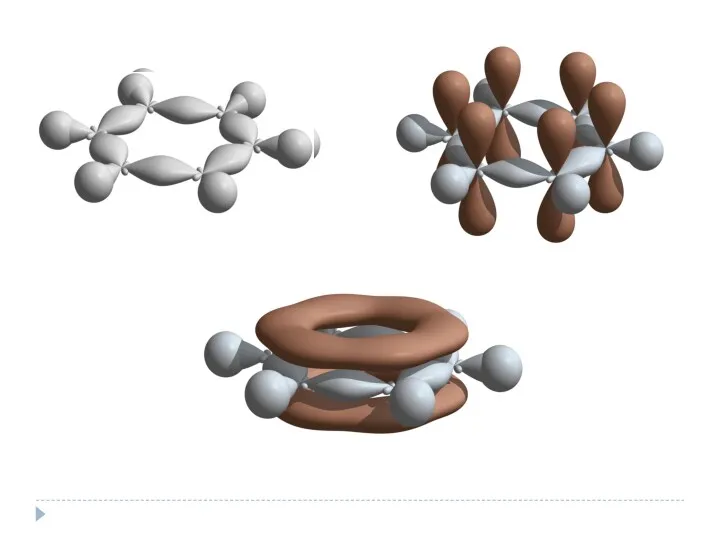
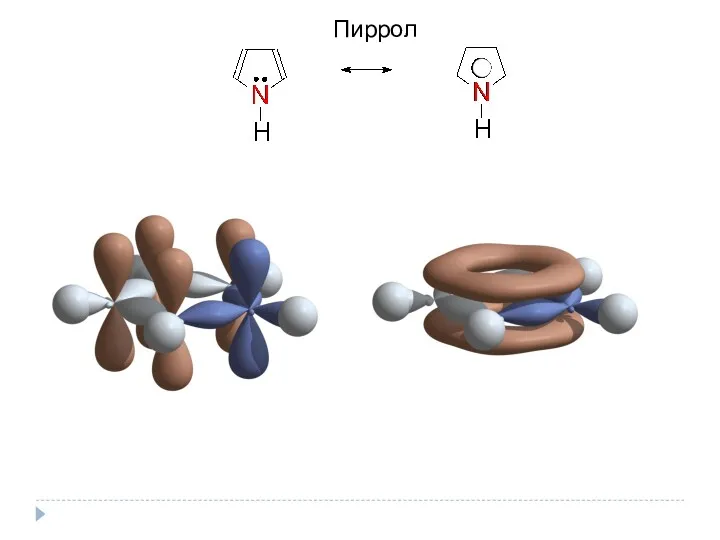
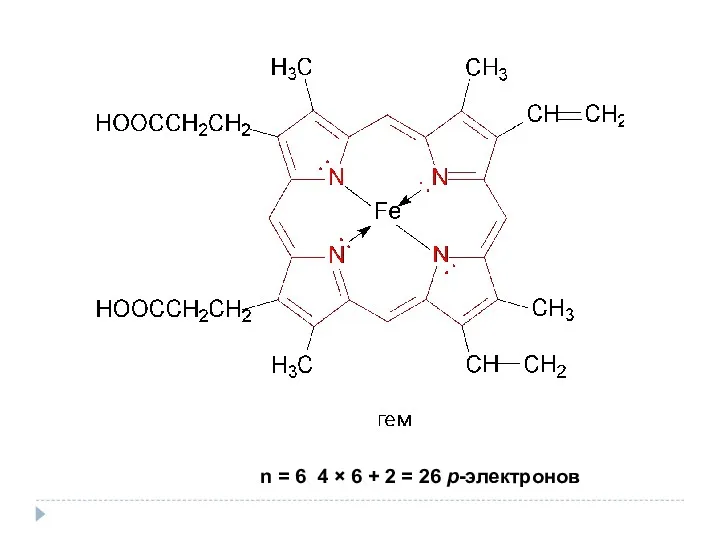
- 12. Ароматичность Наличие в молекуле энергетически выгодной замкнутой сопряженной системы, включающей 4n + 2 р-электронов (n –
- 14. Пиррол
- 15. n = 6 4 × 6 + 2 = 26 p-электронов
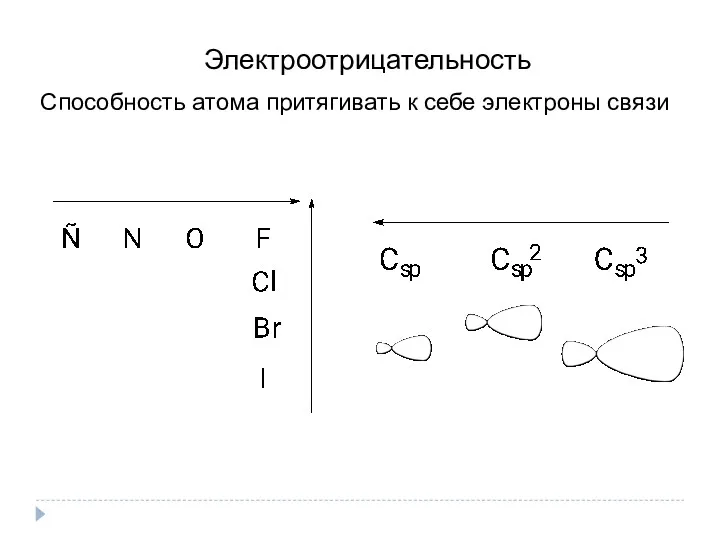
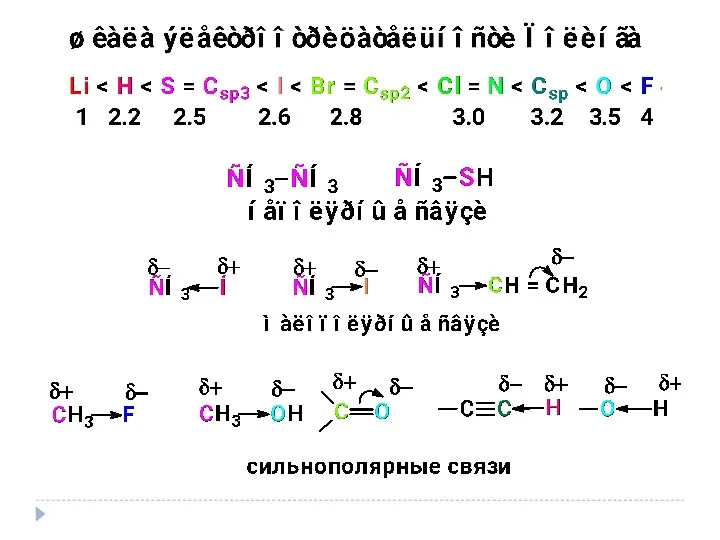
- 16. Электроотрицательность Способность атома притягивать к себе электроны связи
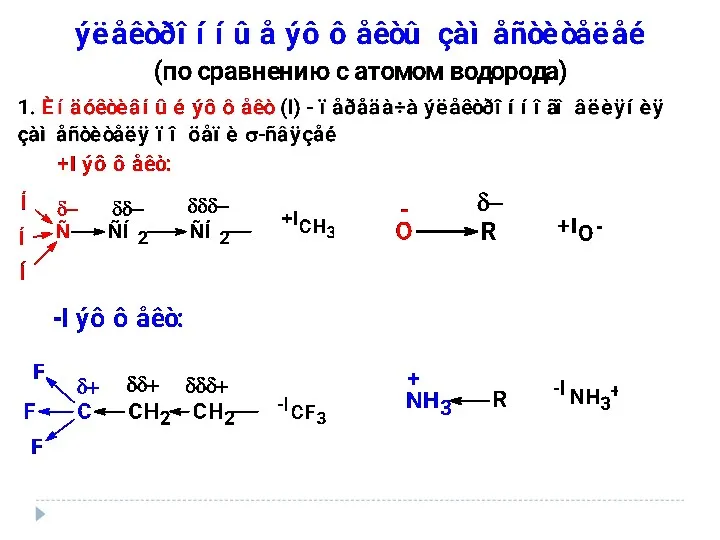
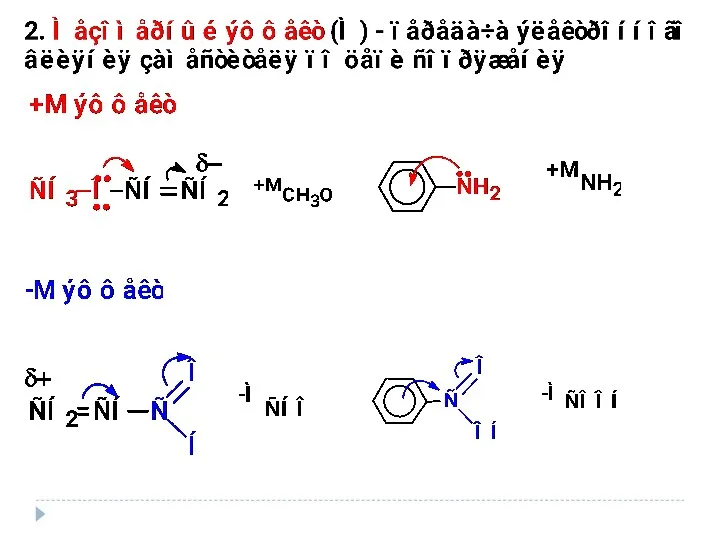
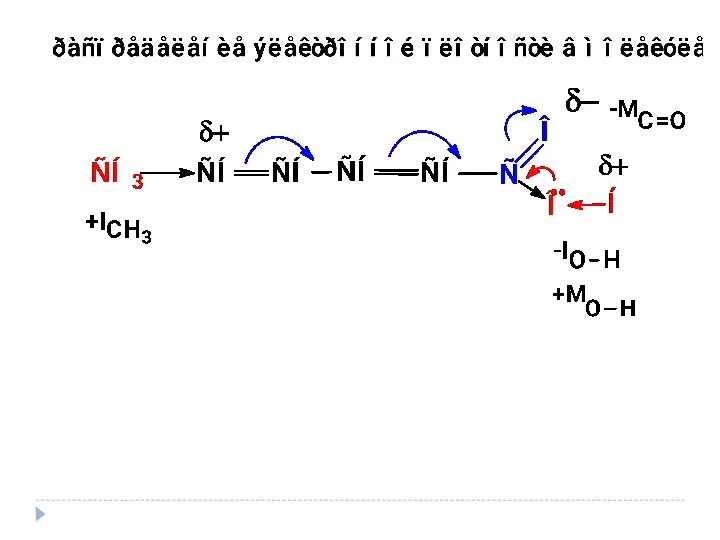
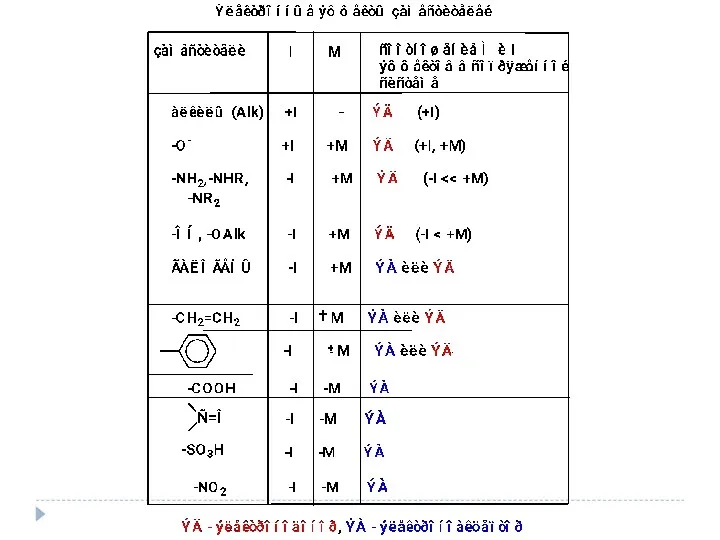
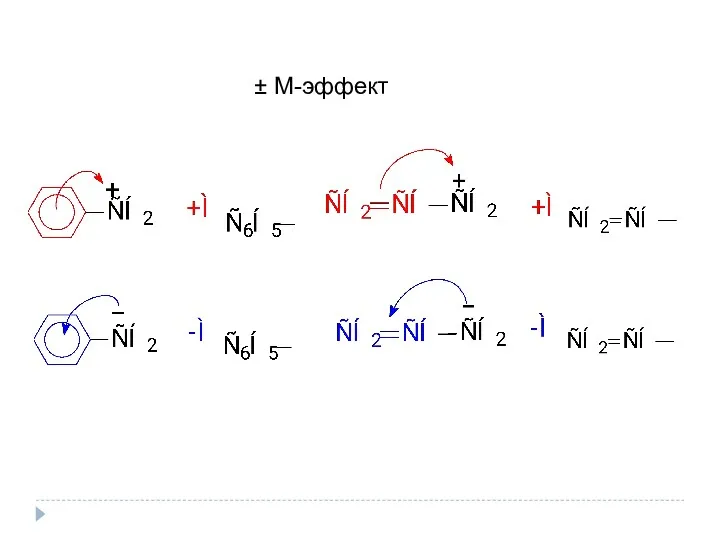
- 22. ± М-эффект
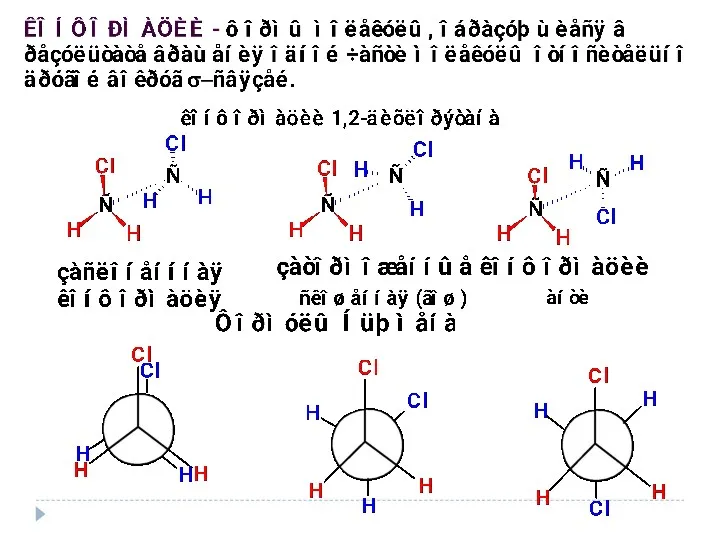
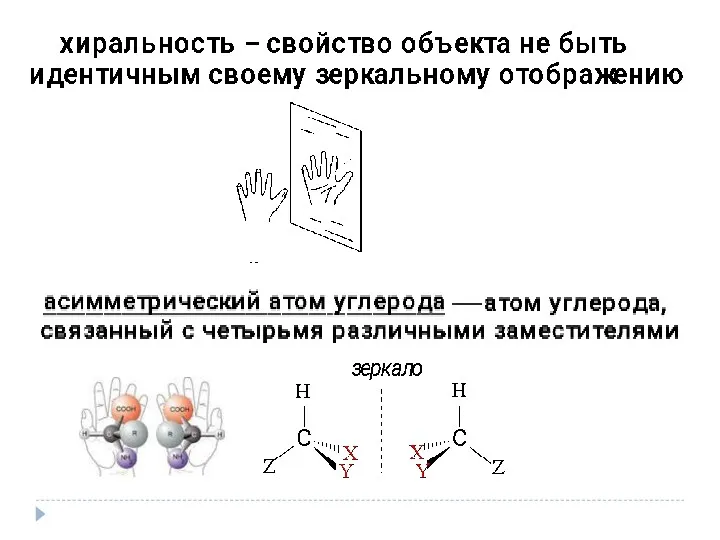
- 23. Пространственное строение органических соединений
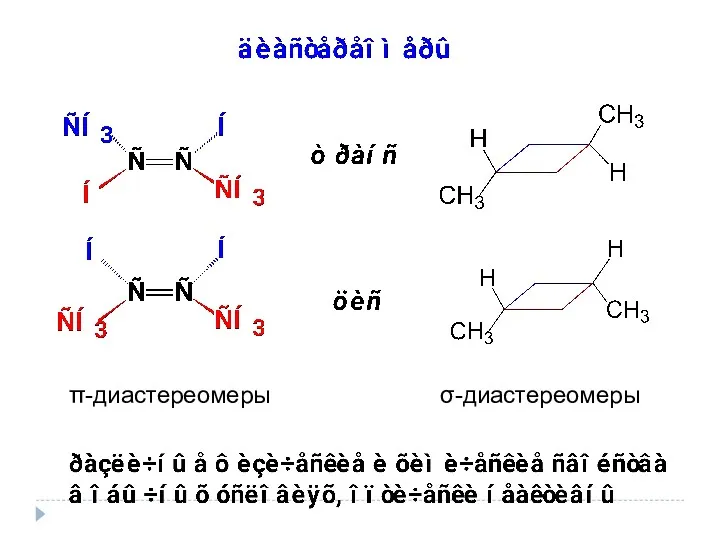
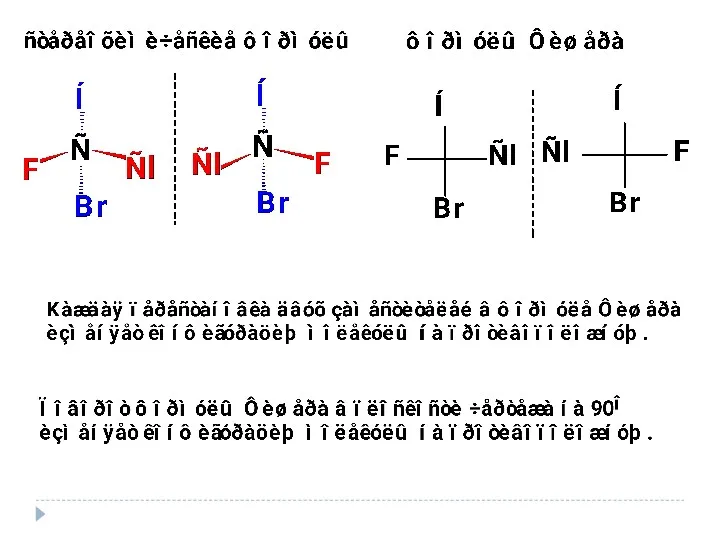
- 27. π-диастереомеры σ-диастереомеры
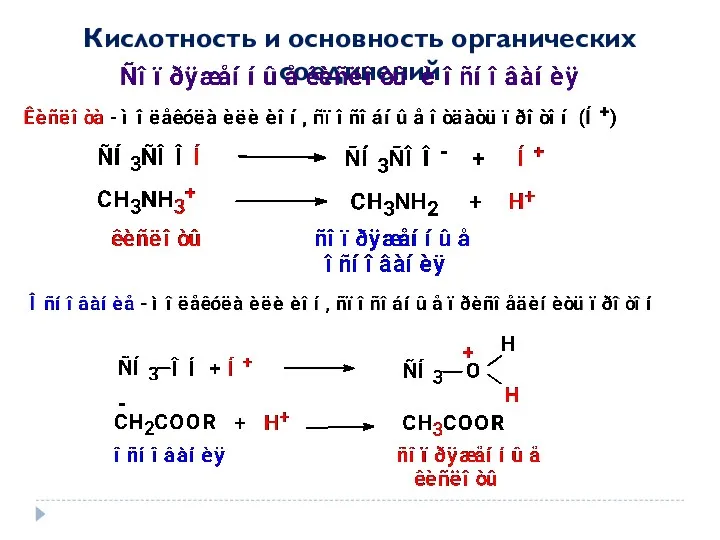
- 32. Кислотность и основность органических соединений
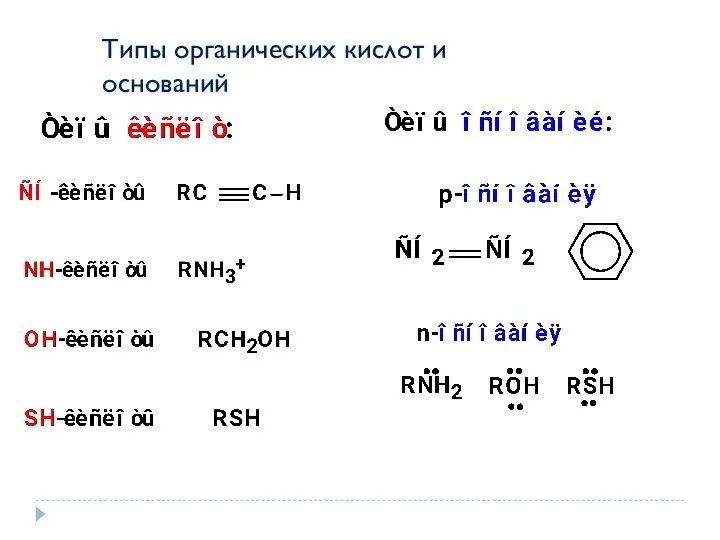
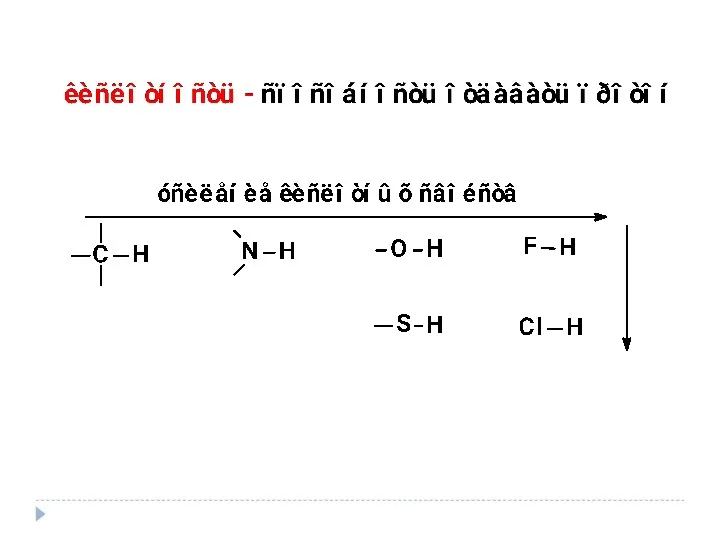
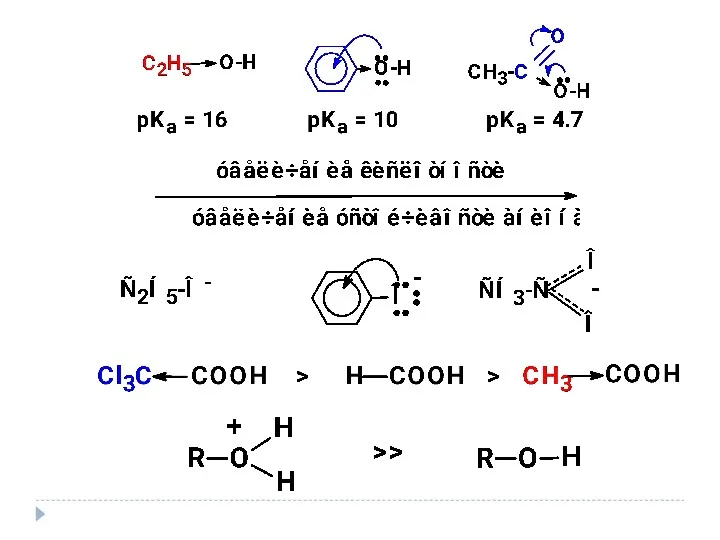
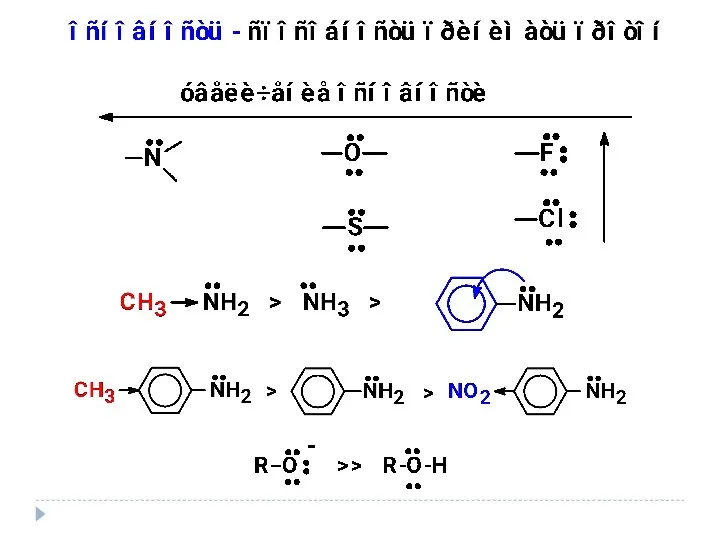
- 33. Типы органических кислот и оснований
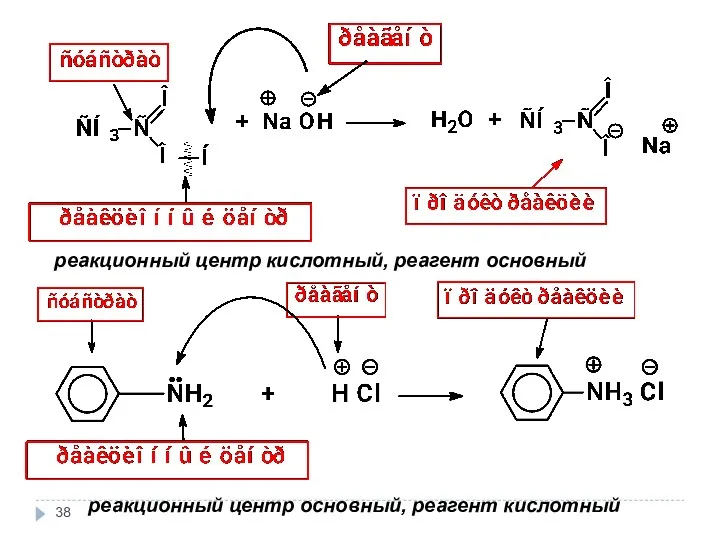
- 37. Реакционная способность – Реакционный центр – Реагент – Некоторые термины и определения способность вещества вступать в
- 38. реакционный центр кислотный, реагент основный реакционный центр основный, реагент кислотный
- 39. Типы реагентов Кислотные реагенты (кислоты) – Основные реагенты (основания) – доноры протона по отношению к реакционному
- 40. Нуклеофильные реагенты (нуклеофилы) – Электрофильные реагенты (электрофилы) – частицы, образующие новую ковалентную связь за счет своей
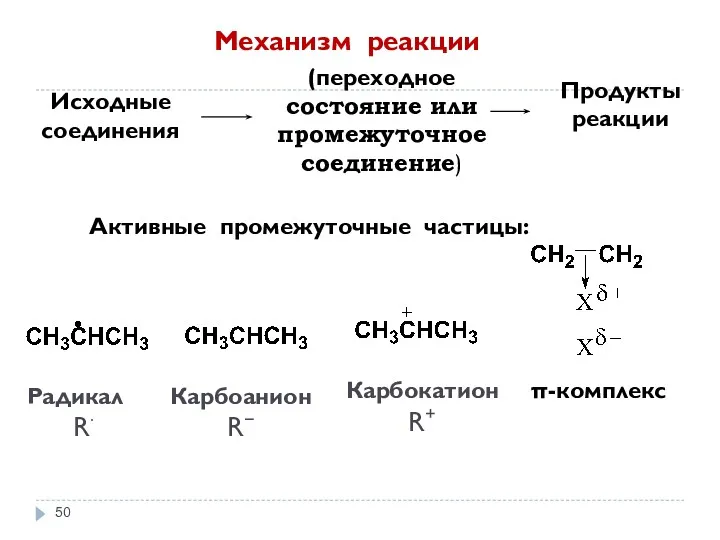
- 41. Радикальные реагенты (радикалы) – Окислители – Восстановители – свободные атомы или частицы с неспаренным электроном. R•
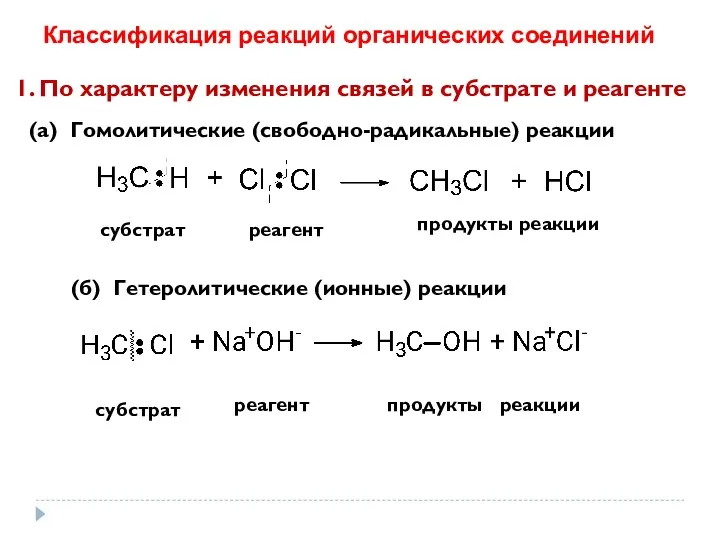
- 42. 1. Гомолитический (свободнорадикальный) 2. Гетеролитический (ионный) образующиеся активные промежуточные частицы – свободные радикалы образующиеся активные органические
- 43. (а) Гомолитические (свободно-радикальные) реакции (б) Гетеролитические (ионные) реакции субстрат реагент продукты реакции субстрат реагент продукты реакции
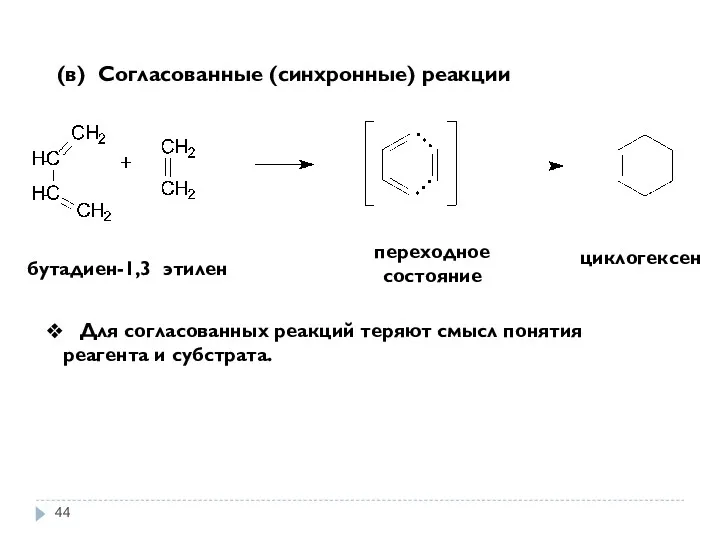
- 44. (в) Согласованные (синхронные) реакции бутадиен-1,3 циклогексен переходное состояние Для согласованных реакций теряют смысл понятия реагента и
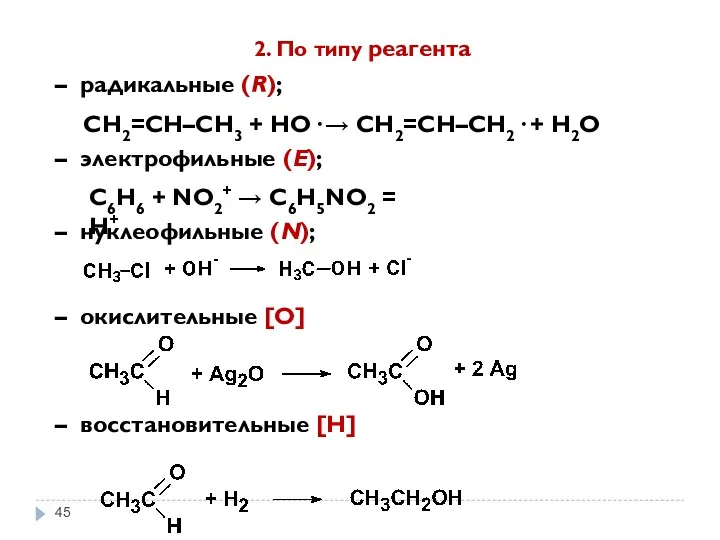
- 45. – нуклеофильные (N); 2. По типу реагента – радикальные (R); СН2=СН–СН3 + НО· → СН2=СН–СН2· +
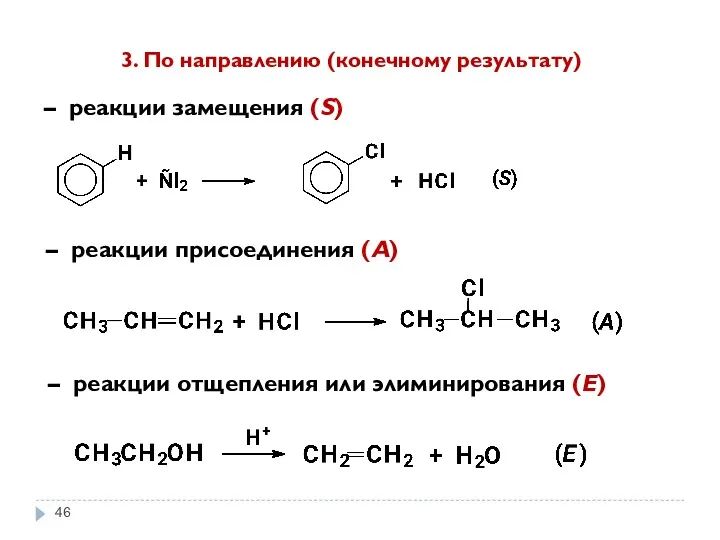
- 46. 3. По направлению (конечному результату) – реакции замещения (S) – реакции присоединения (A) – реакции отщепления
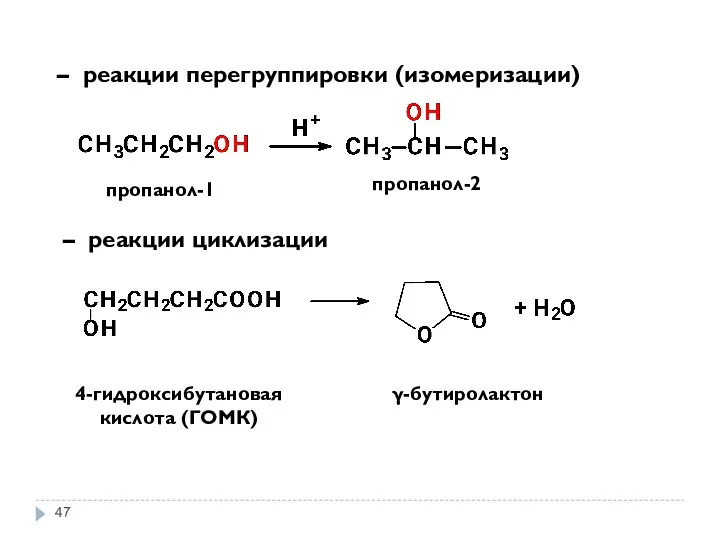
- 47. – реакции перегруппировки (изомеризации) пропанол-1 пропанол-2 – реакции циклизации γ-бутиролактон 4-гидроксибутановая кислота (ГОМК)
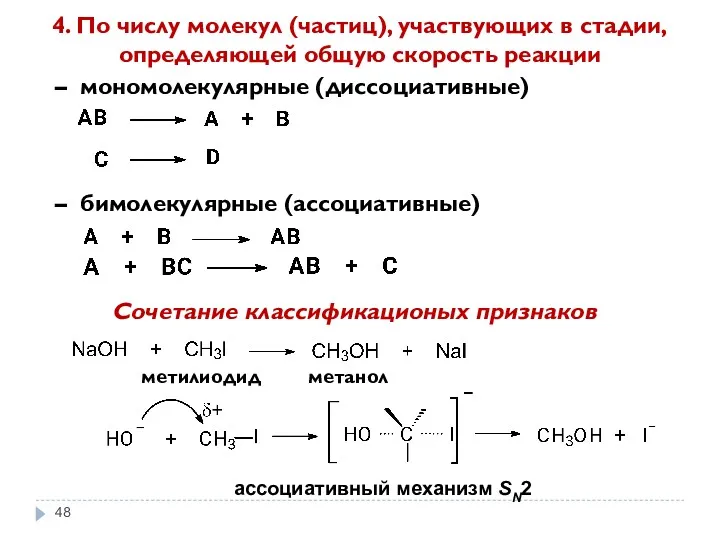
- 48. 4. По числу молекул (частиц), участвующих в стадии, определяющей общую скорость реакции – мономолекулярные (диссоциативные) –
- 49. (2) способ разрыва и образования связей на каждой стадии. (5) термодинамикой процесса. – детальное описание всех
- 50. (переходное состояние или промежуточное соединение) Механизм реакции Исходные соединения Продукты реакции Активные промежуточные частицы: Радикал R∙
- 51. электронный пространственный (статические и динамические) (молекула в нереагирующем состоянии) распределение электронной плотности в молекуле (электроотрицательность атомов,
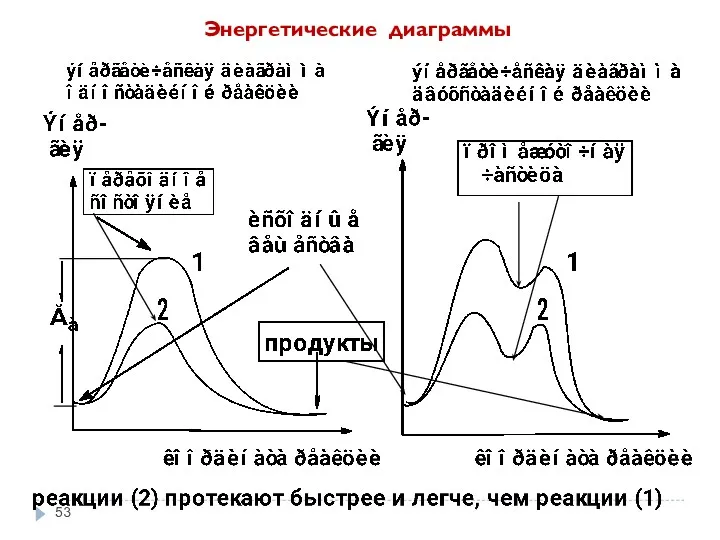
- 52. Включают оценку энергии промежуточных частиц или переходного состояния. Чем больше возможностей для делокализации (рассредоточения) электронной плотности
- 53. Энергетические диаграммы
- 55. Скачать презентацию










 Преобразование видеопотока в поток семантической информации
Преобразование видеопотока в поток семантической информации Здоровьесберегающие технологии. Метод В. Ф. Базарного
Здоровьесберегающие технологии. Метод В. Ф. Базарного Конструирование радиоэлектронной аппаратуры
Конструирование радиоэлектронной аппаратуры Порядок расчета отпускных и выплат по нетрудоспособности
Порядок расчета отпускных и выплат по нетрудоспособности Исследовательская работа Вечен подвиг народа
Исследовательская работа Вечен подвиг народа Малышам о безопасности Диск
Малышам о безопасности Диск Презентация Явление природы
Презентация Явление природы Организация деятельности первичного отделения РДШ на базе отделения дополнительного образования детей: перспективы развития
Организация деятельности первичного отделения РДШ на базе отделения дополнительного образования детей: перспективы развития Презентация к уроку основ православной культуры Высокий иконостас.
Презентация к уроку основ православной культуры Высокий иконостас. Последствия извержения вулканов. Защита населения
Последствия извержения вулканов. Защита населения Портфоліо. Кожемяко Анастасія Володимирівна
Портфоліо. Кожемяко Анастасія Володимирівна Поверхностно-диффузионная модификация ПВХ изделий эпоксидными смолами. Магистерская диссертация
Поверхностно-диффузионная модификация ПВХ изделий эпоксидными смолами. Магистерская диссертация Компоненты системы безопасности
Компоненты системы безопасности Классный час Путешествие в стану Добра
Классный час Путешествие в стану Добра Высокое Возрождение
Высокое Возрождение Внедрение регионального компонента в учебный процесс
Внедрение регионального компонента в учебный процесс План организации и проведения конференции Медицинская весна – 2016
План организации и проведения конференции Медицинская весна – 2016 Война во Вьетнаме 1 ноября 1957 - 30 апреля 1975
Война во Вьетнаме 1 ноября 1957 - 30 апреля 1975 Внешность человека
Внешность человека Беременность и заболевания сердечно-сосудистой системы
Беременность и заболевания сердечно-сосудистой системы Роль твердой фазы в формировании осадков. Рост ледяной фазы.Тема 5 2013
Роль твердой фазы в формировании осадков. Рост ледяной фазы.Тема 5 2013 Фонтанная арматура
Фонтанная арматура Общественное движение 1830-х – 1850-х гг
Общественное движение 1830-х – 1850-х гг Религиоведение. Функции и роль религии в обществе
Религиоведение. Функции и роль религии в обществе Доклад на тему Методики мониторинга личностных, предметных и метапредметных результатов в условиях новых ФГОС, 2014 г.
Доклад на тему Методики мониторинга личностных, предметных и метапредметных результатов в условиях новых ФГОС, 2014 г. Опробование. Основные понятия
Опробование. Основные понятия Современные технологии обучения
Современные технологии обучения Сборка ПК с монитором, с бюджетом 200000р на Advanced Micro Devices
Сборка ПК с монитором, с бюджетом 200000р на Advanced Micro Devices