Содержание
- 2. Электрод - система состоящая из проводника I рода (металл или полупроводник), контактирующего с проводником II рода
- 3. Классификация электродов Электрод I рода – металл погруженный в раствор содержащий ионы данного металла. Обозначение: Меz+/Ме
- 4. Рассчитывается по уравнению Нернста: Электродный потенциал (E) зависит от температуры, природы металла и концентрации его ионов
- 5. Е0(2Н+/Н2(Pt)) = 0,00 В Абсолютное значение E0 определить невозможно. Обозначение: (Pt)H2|2H+ Электродная реакция: H2 ↔ 2H+
- 6. Ряд стандартных электродных потенциалов металлов
- 7. Электрод второго рода – металл покрытый труднорастворимой солью этого металла и погруженный в раствор содержащий анионы
- 8. Пример: Стеклянный электрод Ионоселективный (мембранный) электрод Обозначение: Н+ |стекло |HCl (0,1М)|AgCl,Ag или при 250С (298К)
- 9. Электрохимические цепи, способные вырабатывать электрическую энергию, называют гальваническими элементами.
- 11. Элемент Даниэля – Якоби схематически может быть изображен следующим образом: (Анод) Zn │ZnSO4 CuSO4│Cu (Катод). φ1
- 12. Электродвижущая сила (ЭДС) гальванического элемента равна алгебраической сумме скачков потенциала: ∆Е = φ1 + φ2 +
- 13. Для устранения φд между растворами помещают солевой мостик – стеклянная трубка, заполненная конц. раствор нейтральной соли,
- 14. Если диффузионный потенциал устранен, между растворами ставится двойная черта: (Анод) Zn│ZnSO4 ║ CuSO4│Cu (Катод) ЭДС этого
- 15. 1. Химические цепи Пример: Zn⎪ZnSO4 ⎪⎪ CuSO4⎪Cu 2. Концентрационные Пример: Ag⎪AgNO3 ⎪⎪ AgNO3⎪Ag а1 ЭДС такой
- 17. Скачать презентацию
 Здоровьесберегающие технологии в педагогическом процессе ДОУ
Здоровьесберегающие технологии в педагогическом процессе ДОУ Нерезенко.Курсовая работа
Нерезенко.Курсовая работа Внимание. Виды и свойства внимания
Внимание. Виды и свойства внимания Этнометодологические исследования. Инициирование смеха
Этнометодологические исследования. Инициирование смеха Дарение. Отказ от исполнения договора, запрещение, ограничение и отмена дарения
Дарение. Отказ от исполнения договора, запрещение, ограничение и отмена дарения We make a date the perfect match…
We make a date the perfect match… Магистральные трубопроводы
Магистральные трубопроводы Гиперпластические процессы эндометрии
Гиперпластические процессы эндометрии Микробиология, как наука. (Лекция 1)
Микробиология, как наука. (Лекция 1) Внеклассное мероприятие Спор трех королев
Внеклассное мероприятие Спор трех королев Мексиканские Соединенные Штаты
Мексиканские Соединенные Штаты Развитие личности ребёнка в детском коллективе.
Развитие личности ребёнка в детском коллективе. Промышленная коллекция программных продуктов Autodesk
Промышленная коллекция программных продуктов Autodesk Аппликация Ёжик
Аппликация Ёжик Протестантизм
Протестантизм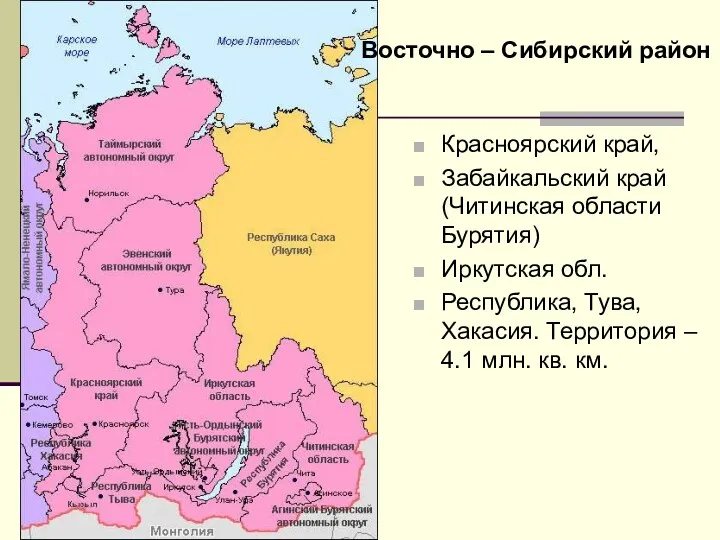 9 класс. Восточно-Сибирский район
9 класс. Восточно-Сибирский район KUMA_презентация
KUMA_презентация Организация, вооружение и боевая техника подразделений армии США. Разведывательная подготовка
Организация, вооружение и боевая техника подразделений армии США. Разведывательная подготовка Бессмертный полк
Бессмертный полк Project: Global Social Media Plan // June Topic: Flower Fields Format: image Date: Flexible Content
Project: Global Social Media Plan // June Topic: Flower Fields Format: image Date: Flexible Content Базовые реанимационные мероприятия
Базовые реанимационные мероприятия МАЛЬЧИК ИЗ ХОЛМОГОР
МАЛЬЧИК ИЗ ХОЛМОГОР Кроссворд с применением национально-регионального компонента
Кроссворд с применением национально-регионального компонента Геометрия для малышей Знакомство с объемной геометрической фигурой - конус
Геометрия для малышей Знакомство с объемной геометрической фигурой - конус Свойства продукции. Классификация показателей
Свойства продукции. Классификация показателей The most unusual houses all over the world
The most unusual houses all over the world Метод кейса
Метод кейса Сыктывкар - мой родной город!
Сыктывкар - мой родной город!