Содержание
- 2. Цель урока формирование представлений об электролитической диссоциации, ее механизме для веществ с различным типом химической связи.
- 3. Планируемые результаты урока Предметные: Уметь характеризовать процесс растворения веществ с позиции представлений об электролитической диссоциации Уметь
- 4. Планируемые результаты урока Метапредметные: Познавательные: Уметь находить сходство и различие между объектами, обобщать полученную информацию. Уметь
- 5. Планируемые результаты урока Личностные: Проявлять эмоционально – ценностное отношение к учебной проблеме. Проявлять творческое отношение к
- 6. План урока 1. Организационный момент. 2. Повторение пройденного материала. 3. Актуализация знаний. 4. Изучение нового материала:
- 7. Задание 1 1 вариант – выписать формулы кислот, дать им названия. 2 вариант – выписать формулы
- 8. Тема урока: «Электролитическая диссоциация
- 9. Процесс распада электролита на ионы в растворе называется электролитической диссоциацией (от лат. dissociatio – «разделение»
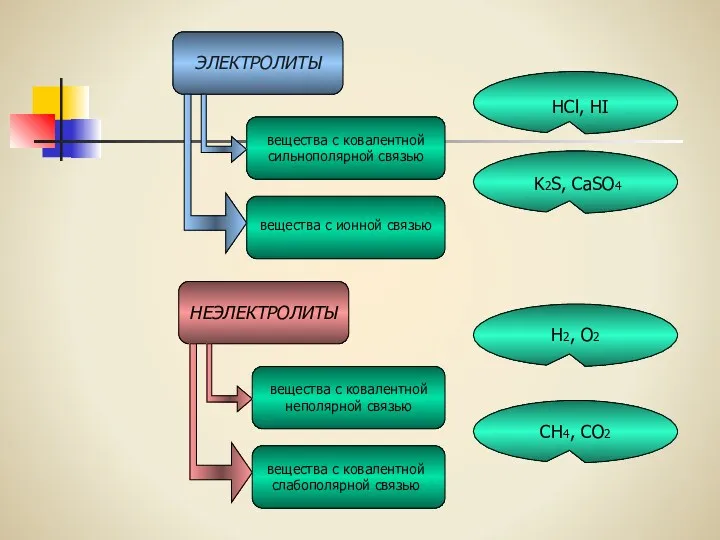
- 10. Запомните! Вещества, растворы которых проводят электрический ток, называются электролитами. Вещества, растворы которых не проводят электрический ток,
- 11. ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ вещества с ковалентной сильнополярной связью вещества с ионной связью вещества с ковалентной неполярной связью
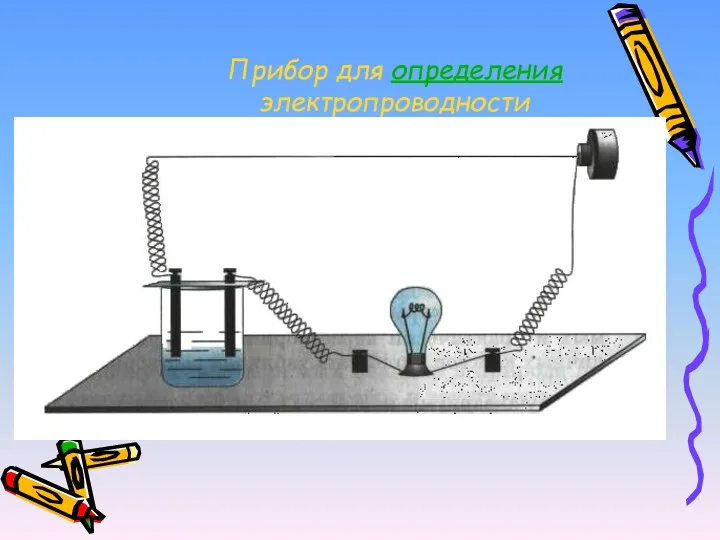
- 12. Прибор для определения электропроводности
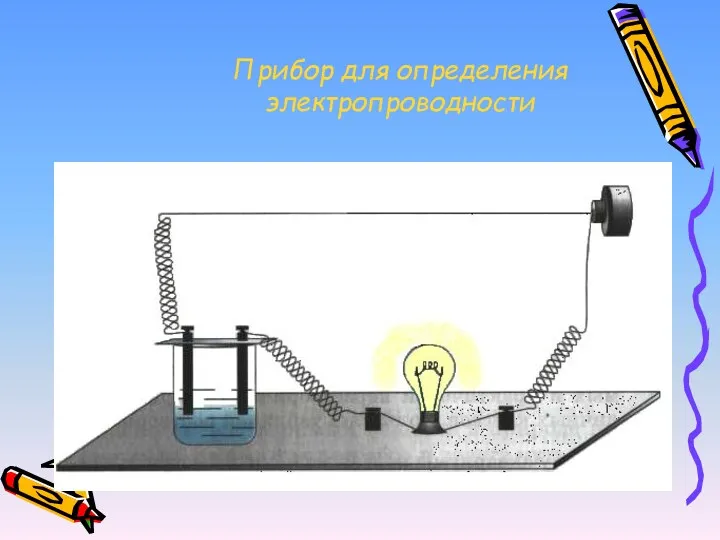
- 13. Прибор для определения электропроводности
- 14. Задание №2 На столах находятся растворы веществ: хлорида натрия, сахарозы, глицерина, гидроксида натрия, серной кислоты, спирта.
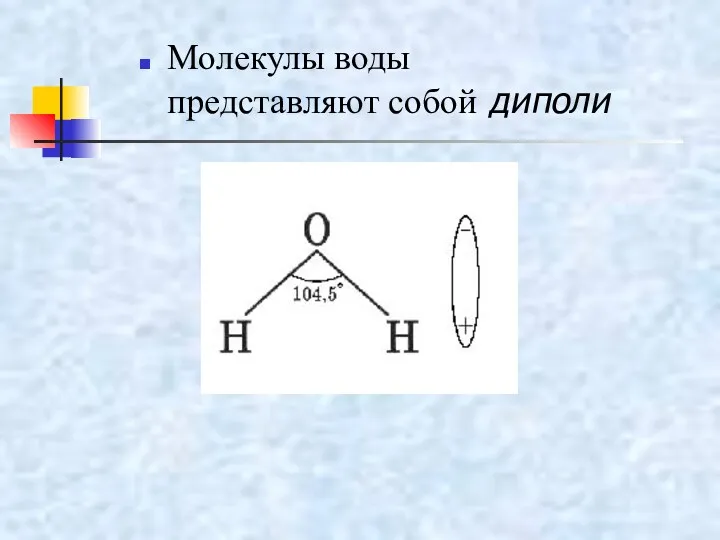
- 15. Молекулы воды представляют собой диполи
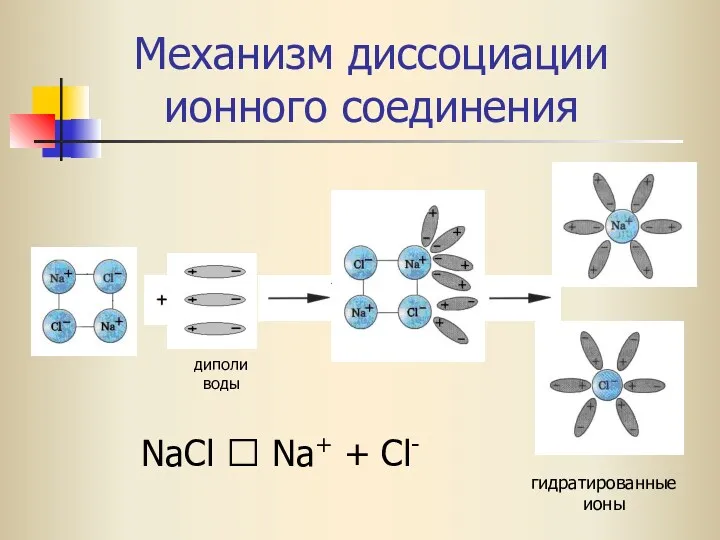
- 16. Механизм диссоциации ионного соединения NaCl ⮀ Na+ + Cl- гидратированные ионы диполи воды
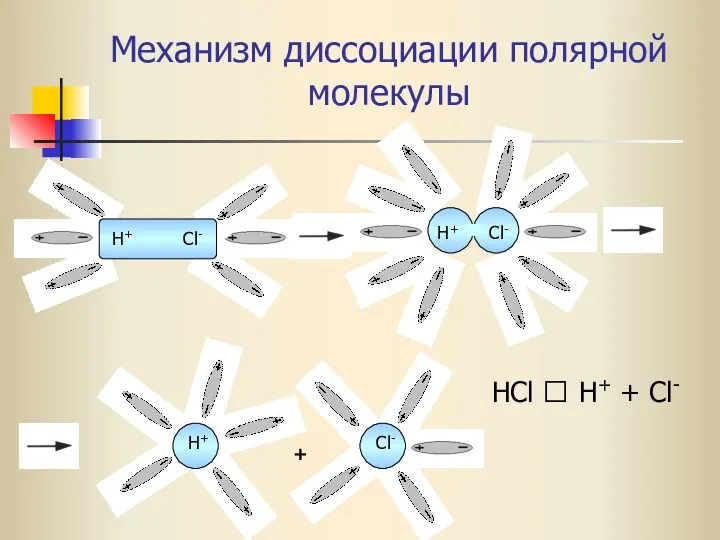
- 17. Механизм диссоциации полярной молекулы H+ Cl- H+ Cl- H+ Cl- + HCl ⮀ H+ + Cl-
- 18. Степень диссоциации (α)
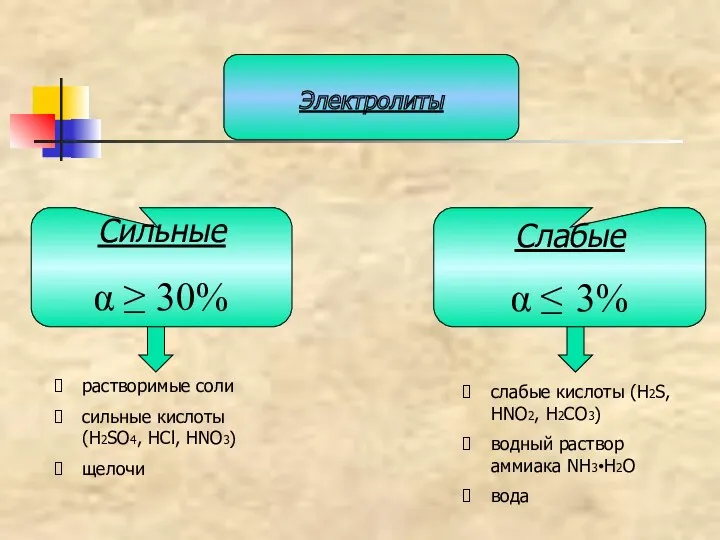
- 19. Сильные α ≥ 30% Слабые α ≤ 3% Электролиты растворимые соли сильные кислоты (H2SO4, HCl, HNO3)
- 20. Упражнения
- 21. Задание №3 (репродуктивный уровень) Определите сильные и слабые электролиты в ряду веществ: H2S, K2SO4, KOH, K2CO3,
- 22. Задание №4 (частично-поисковый уровень) В растворах находятся следующие вещества. Карбонат натрия Серная кислота Гидроксид калия Хлорид
- 23. Задание №5* (эвристический уровень) В одном стакане растворили несколько неизвестных веществ. В результате анализа, выяснили, что
- 24. Домашнее задание §35. Завершить работу по карточке Подготовить сообщения о В.А. Кистяковском, И.А. Каблукове, С. Аррениусе
- 26. Скачать презентацию
















 Использование логосказки в коррекционной работе
Использование логосказки в коррекционной работе Совещание по итогам деятельности группы Лукойл-Пермь
Совещание по итогам деятельности группы Лукойл-Пермь Органическое молоко в мире и в России
Органическое молоко в мире и в России Памятники природы Новосибирской области
Памятники природы Новосибирской области 20230724_ekzamen_bez_stressa
20230724_ekzamen_bez_stressa Wall contiguity
Wall contiguity Управление денежными потоками
Управление денежными потоками Стиль канзаши
Стиль канзаши Монитор последовательного порта
Монитор последовательного порта Guide to Russian winter holidays
Guide to Russian winter holidays Учёба А.С. Пушкина в лицее
Учёба А.С. Пушкина в лицее Мастера живописи Саратовского края (урок по Культуре края 8 класс)
Мастера живописи Саратовского края (урок по Культуре края 8 класс) Презентация проекта Развитие познавательной активности детей дошкольного возраста через использование методов и приёмов технологии ТРИЗ в образовательной деятельности
Презентация проекта Развитие познавательной активности детей дошкольного возраста через использование методов и приёмов технологии ТРИЗ в образовательной деятельности Правила поведения в автомобиле и поезде
Правила поведения в автомобиле и поезде Модуль. Графики функций, содержащих переменную под знаком модуля
Модуль. Графики функций, содержащих переменную под знаком модуля Квадрат суммы. Квадрат разности. Алгебра. 7 класс
Квадрат суммы. Квадрат разности. Алгебра. 7 класс Острые осложнения сахарного диабета
Острые осложнения сахарного диабета Образование первых государств
Образование первых государств Народные сказки устами молодых
Народные сказки устами молодых Скульптура. Виды скульптуры
Скульптура. Виды скульптуры Поджелудочная железа
Поджелудочная железа Термины для конструирования
Термины для конструирования Педсовет Владение современными педагогическими технологиями - залог успешной деятельности педагога
Педсовет Владение современными педагогическими технологиями - залог успешной деятельности педагога Процесори (9 клас)
Процесори (9 клас) Символика Росии, РТ, Новошешминского района
Символика Росии, РТ, Новошешминского района Электронная выставка Раскроем бережно страницы
Электронная выставка Раскроем бережно страницы Приборы полупроводниковой микро- и наноэлектроники
Приборы полупроводниковой микро- и наноэлектроники Фонтанная эксплуатация скважин
Фонтанная эксплуатация скважин