Содержание
- 2. Квантовая механика НАЧАЛО КВАНТОВОЙ МЕХАНИКИ - ИДЕЯ ПЛАНКА (1900 Г.) О ПРЕРЫВИСТОСТИ ИЗЛУЧЕНИЯ И РАСПРОСТРАНЕНИЯ СВЕТА.
- 3. Первая лекция раздела Лекция ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ СВЕТА АТОМАМИ И МОЛЕКУЛАМИ 1. КВАНТОВАНИЕ ЭНЕРГИИ. 2. ЭНЕРГЕТИЧЕСКИЕ
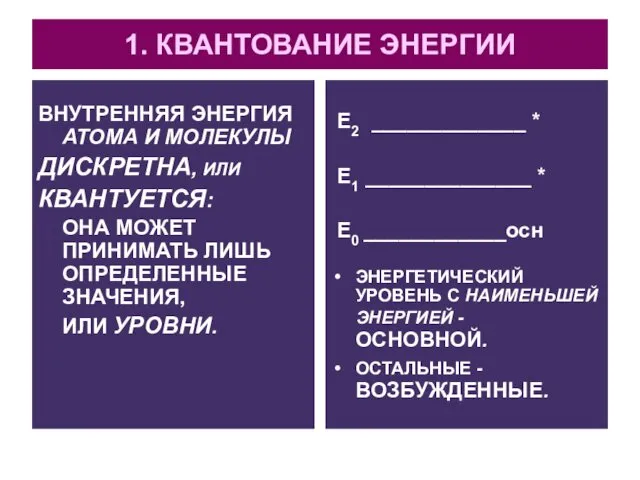
- 4. 1. КВАНТОВАНИЕ ЭНЕРГИИ ВНУТРЕННЯЯ ЭНЕРГИЯ АТОМА И МОЛЕКУЛЫ ДИСКРЕТНА, ИЛИ КВАНТУЕТСЯ: ОНА МОЖЕТ ПРИНИМАТЬ ЛИШЬ ОПРЕДЕЛЕННЫЕ
- 5. Постулаты Бора КАЖДОМУ ЭНЕРГЕТИЧЕСКОМУ УРОВНЮ СООТВЕТСТВУЕТ ОПРЕДЕЛЕННОЕ СТАЦИОНАРНОЕ СОСТОЯНИЕ ЧАСТИЦЫ. В СТАЦИОНАРНОМ СОСТОЯНИИ ЧАСТИЦЫ ЕЕ ЭНЕРГИЯ
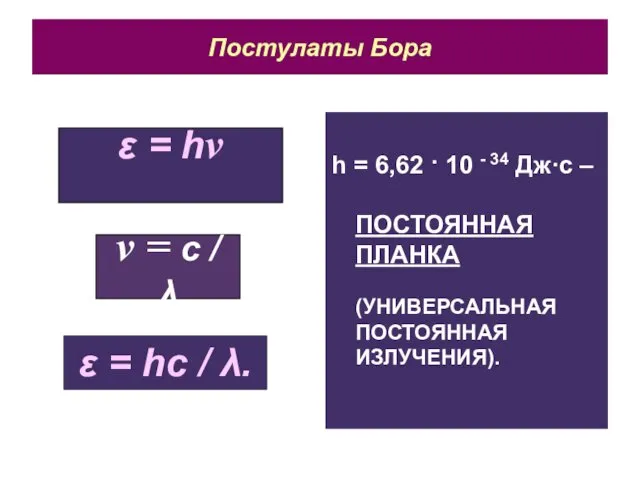
- 6. Постулаты Бора h = 6,62 · 10 - 34 Дж·с – ПОСТОЯННАЯ ПЛАНКА (УНИВЕРСАЛЬНАЯ ПОСТОЯННАЯ ИЗЛУЧЕНИЯ).
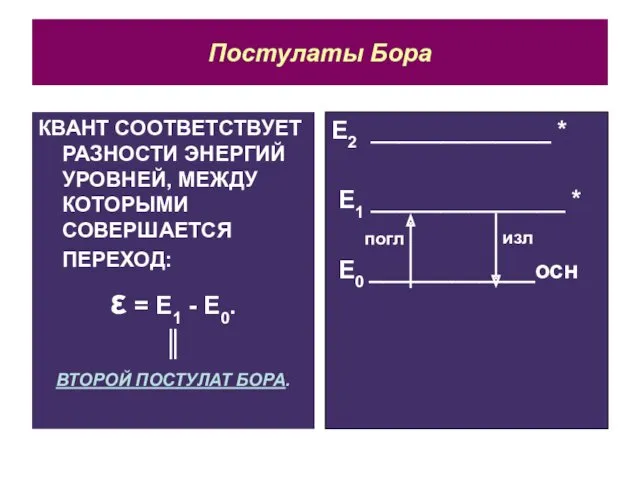
- 7. Постулаты Бора КВАНТ СООТВЕТСТВУЕТ РАЗНОСТИ ЭНЕРГИЙ УРОВНЕЙ, МЕЖДУ КОТОРЫМИ СОВЕРШАЕТСЯ ПЕРЕХОД: ε = Е1 - Е0.
- 8. 2. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ АТОМА. КВАНТОВЫЕ ЧИСЛА Энергетическое состояние атома определяется состоянием его электронов. ЭЛЕКТРОН - ДВИЖУЩАЯСЯ
- 9. Квантовые числа СОБСТВЕННЫЙ МЕХ. МОМЕНТ ИМПУЛЬСА, ИЛИ СПИН, И СПИНОВЫЙ МАГНИТНЫЙ МОМЕНТ - ВРАЩЕНИЕМ ЭЛЕКТРОНА ВОКРУГ
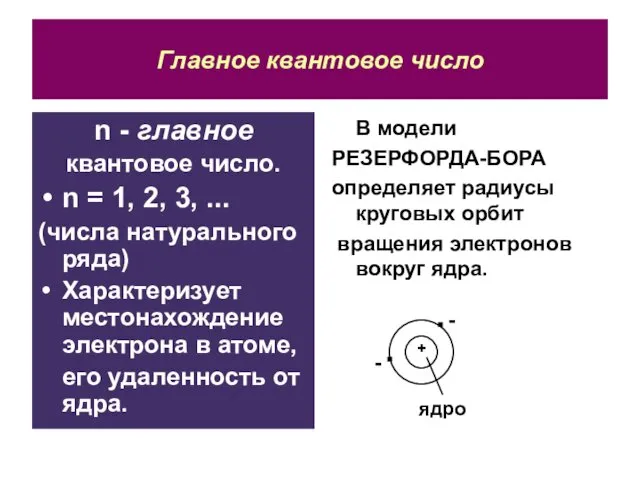
- 10. Главное квантовое число n - главное квантовое число. n = 1, 2, 3, ... (числа натурального
- 11. Условие квантования Радиусы орбит должны удовлетворять УСЛОВИЮ КВАНТОВАНИЯ: m νn rn = n·h / 2π =
- 12. Современная коррекция БОРОВСКАЯ МОДЕЛЬ АТОМА – УДОБНОЕ ПРИБЛИЖЕНИЕ. НЕВОЗМОЖНО ТОЧНО УКАЗАТЬ ОДНОВРЕМЕННО ЭНЕРГИЮ ЭЛЕКТРОНА И ЕГО
- 13. Орбитальное квантовое число l - орбитальное квантовое число. l = 0, 1, 2, …, n-1 (целые
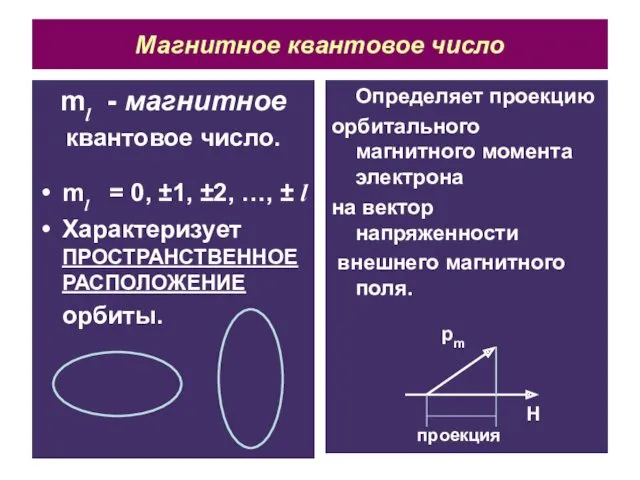
- 14. Магнитное квантовое число ml - магнитное квантовое число. ml = 0, ±1, ±2, …, ± l
- 15. Спиновое число ms – спиновое число. ms = ± 1/2 Определяет проекцию СПИНОВОГО магнитного момента электрона
- 16. 3. СИСТЕМА ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ И ПОДУРОВНЕЙ МОЛЕКУЛЫ Внутренняя энергия молекулы включает следующие составляющие: А) ЭНЕРГИЯ ДВИЖЕНИЯ
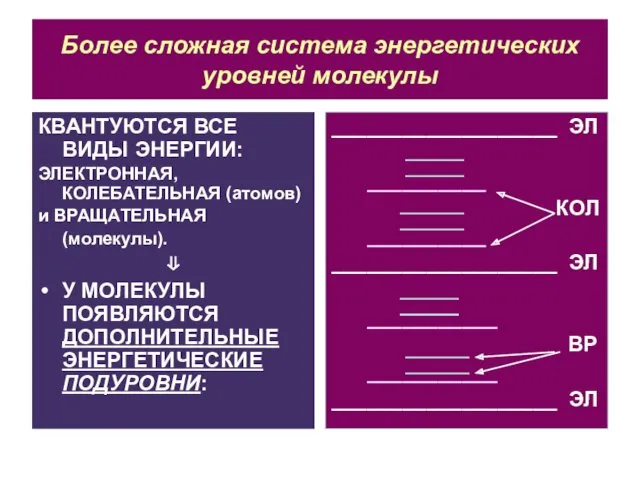
- 17. Более сложная система энергетических уровней молекулы КВАНТУЮТСЯ ВСЕ ВИДЫ ЭНЕРГИИ: ЭЛЕКТРОННАЯ, КОЛЕБАТЕЛЬНАЯ (атомов) и ВРАЩАТЕЛЬНАЯ (молекулы).
- 18. Величина квантов КВАНТЫ УМЕНЬШАЮТСЯ В РЯДУ ЕЭЛ → ЕКОЛ → ЕВР. ПОЭТОМУ РАДИОВОЛНЫ СВЧ-ДИАПАЗОНА И ДАЛЬНИЙ
- 19. 4. ВИДЫ СТАЦИОНАРНЫХ СОСТОЯНИЙ ОСНОВНОЕ ВОЗБУЖДЕННОЕ СИНГЛЕТНОЕ ТРИПЛЕТНОЕ
- 20. Синглетное и триплетное состояния ЧАСТИЦА В ОСНОВНОМ СОСТОЯНИИ, ЕСЛИ ОНА НЕ ПОДВЕРГАЕТСЯ ВНЕШНИМ ВОЗДЕЙСТВИЯМ. ЧАСТИЦА ПЕРЕХОДИТ
- 21. ОСНОВНОЕ СОСТОЯНИЕ БОЛЬШИНСТВА ОРГАНИЧЕСКИХ МОЛЕКУЛ - СИНГЛЕТНОЕ. ПРИ ВОЗБУЖДЕНИИ - ПЕРЕХОД ТАКЖЕ НА СИНГЛЕТНЫЙ ВОЗБУЖДЕННЫЙ УРОВЕНЬ.
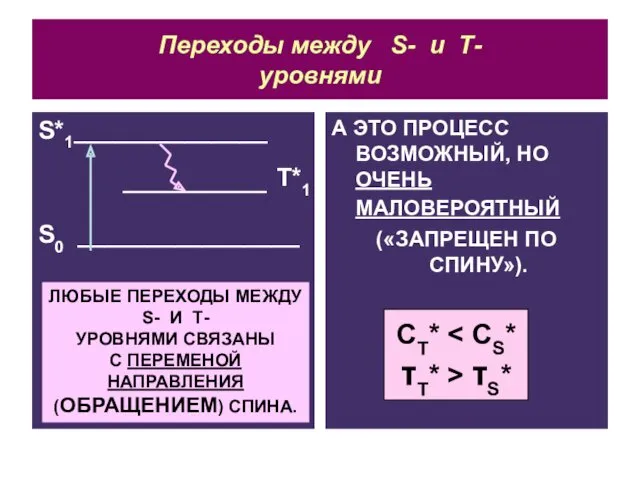
- 22. Переходы между S- и Т- уровнями S*1______________ S0 ________________ А ЭТО ПРОЦЕСС ВОЗМОЖНЫЙ, НО ОЧЕНЬ МАЛОВЕРОЯТНЫЙ
- 23. 5. СПОСОБЫ РАСХОДОВАНИЯ МОЛЕКУЛОЙ ЭНЕРГИИ ВОЗБУЖДЕНИЯ Молекула в возбужден- ном состоянии неустойчива. Она стремится растратить энергию
- 24. Способы БЕЗИЗЛУЧАТЕЛЬНОГО перехода А) РАСТРАТА ЭНЕРГИИ В ВИДЕ ТЕПЛА: А* → А0 + тепло. Именно так
- 25. ИЗЛУЧАТЕЛЬНЫЙ переход С ВЫСВЕЧИВАНИЕМ КВАНТОВ ИЗЛУЧЕНИЯ - ЛЮМИНЕСЦЕНЦИИ: А* → А0 + hν. ВИДЫ ЛЮМИНЕСЦЕНЦИИ: СПОНТАННАЯ
- 26. Определения СПОНТАННАЯ – самопроизвольная; ИНДУЦИРОВАННАЯ, ВЫНУЖДЕННАЯ – при воздействии на уже возбужденную частицу нового фотона (лежит
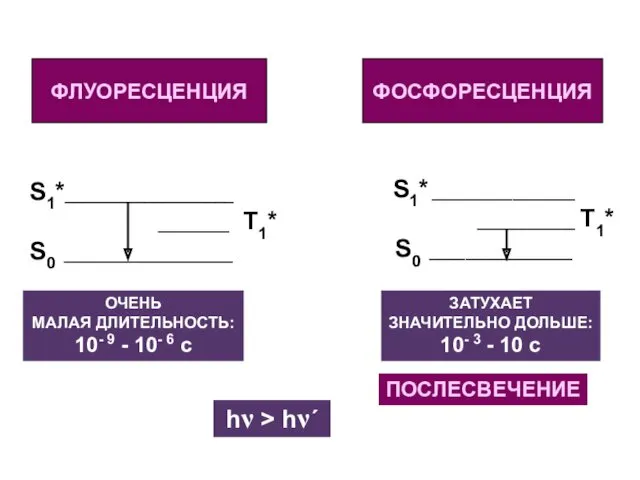
- 27. Флуоресценция и фосфоресценция ФЛУОРЕСЦЕНЦИЯ - испускание фотона при переходе С ПЕРВОГО СИНГЛЕТНОГО ВОЗБУЖДЕННОГО УРОВНЯ НА ОСНОВНОЙ:
- 28. ФЛУОРЕСЦЕНЦИЯ ФОСФОРЕСЦЕНЦИЯ S1*___________________ ________ T1* S0 ___________________ S1* ________________ ___________ T1* S0 ________________ ОЧЕНЬ МАЛАЯ ДЛИТЕЛЬНОСТЬ:
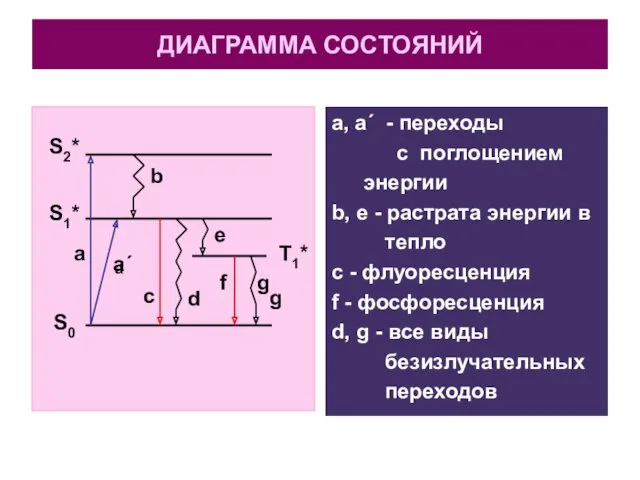
- 29. ДИАГРАММА СОСТОЯНИЙ ЭТО СХЕМА, НА КОТОРОЙ ПРЕДСТАВЛЕНЫ ОСНОВНЫЕ ТИПЫ ПЕРЕХОДОВ МЕЖДУ ЭНЕРГЕТИЧЕСКИМИ УРОВНЯМИ. НА СХЕМЕ ПРЯМЫЕ
- 30. ДИАГРАММА СОСТОЯНИЙ a, a΄ - переходы с поглощением энергии b, e - растрата энергии в тепло
- 31. 6. СПЕКТРЫ ПОГЛОЩЕНИЯ И ЛЮМИНЕСЦЕНЦИИ У КАЖДОГО ВЕЩЕСТВА – ХАРАКТЕРНАЯ СИСТЕМА ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ. ⇓ ИЗЛУЧЕНИЯ РАЗНЫХ
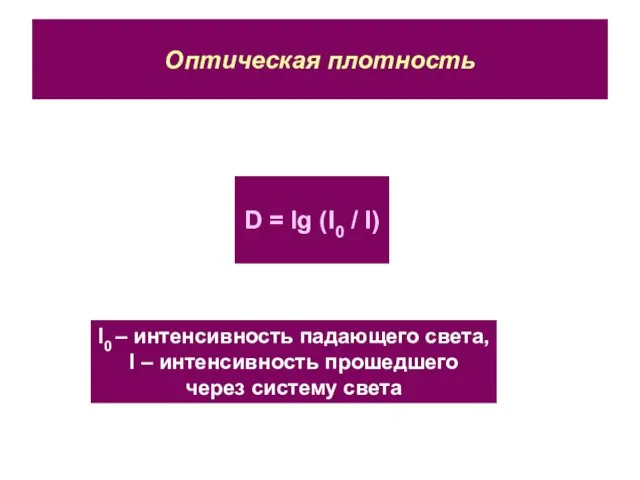
- 32. Оптическая плотность D = lg (I0 / I) I0 – интенсивность падающего света, I – интенсивность
- 33. ПРАВИЛО СТОКСА Так как часть энергии высших возбужденных уровней растрачивается в виде тепла, ЭНЕРГИЯ КВАНТОВ ЛЮМИНЕСЦЕНЦИИ
- 35. Скачать презентацию





















 проектОрганизация кружковой и студийной работы ДОУ в рамках части ООПДО, формируемой участниками образовательных отношений в соответствии с ФГОС
проектОрганизация кружковой и студийной работы ДОУ в рамках части ООПДО, формируемой участниками образовательных отношений в соответствии с ФГОС інформація проходження технологічної практики
інформація проходження технологічної практики Теория ноосферы В. И. Вернадского и её развитие в XXI веке
Теория ноосферы В. И. Вернадского и её развитие в XXI веке ӨСОА және БА : клиникасы, диагностикасы және емі
ӨСОА және БА : клиникасы, диагностикасы және емі Эпоха Просвещения
Эпоха Просвещения 12.5. Контроль за состоянием ТЗ
12.5. Контроль за состоянием ТЗ Презентация ко Дню защитника Отечества
Презентация ко Дню защитника Отечества Ученые биологи
Ученые биологи Матеріали хімічного походження (штучні) та їх властивості
Матеріали хімічного походження (штучні) та їх властивості Презентация Проблемы и перспективы математического образования.
Презентация Проблемы и перспективы математического образования. Разработка классного часа тема 1 сентября
Разработка классного часа тема 1 сентября Соединения на гвоздях
Соединения на гвоздях Спасение, вера, покаяние и рождение свыше
Спасение, вера, покаяние и рождение свыше Істория розвитку ТЗН
Істория розвитку ТЗН История образования Ульяновской области
История образования Ульяновской области Пять дней из жизни
Пять дней из жизни Golden era of mankind
Golden era of mankind Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Презентация к проетно-исследовательской работе Что мы знаем о храмах города Каширы и Каширского района?
Презентация к проетно-исследовательской работе Что мы знаем о храмах города Каширы и Каширского района? Эскизный альбом для проведения экспертизы на земельный участок по адресу: пр-т Маршала Жукова, вл. 52 (СЗАО)
Эскизный альбом для проведения экспертизы на земельный участок по адресу: пр-т Маршала Жукова, вл. 52 (СЗАО) Электронды есептеуіш машиналардың екі түрі. Аналогтық және цифрлық машиналар
Электронды есептеуіш машиналардың екі түрі. Аналогтық және цифрлық машиналар Цветы. Загадки о цветах
Цветы. Загадки о цветах Heart and Blood
Heart and Blood Универсальные поисковые системы
Универсальные поисковые системы Подготовка к участию в практических олимпиадах по робототехнике
Подготовка к участию в практических олимпиадах по робототехнике e4a5c39cbb9149888d85a10b8f177a84
e4a5c39cbb9149888d85a10b8f177a84 Лабораторная работа с применением Ц. Л. Архимед
Лабораторная работа с применением Ц. Л. Архимед Полдня пытался встать с кровати...
Полдня пытался встать с кровати...