Содержание
- 2. Открытию Периодического закона предшествовало накопление знаний о веществах и их свойствах. По мере открытия новых химических
- 4. БЕРЦЕЛИУС Йёнс Якоб (1779 г. - 1848 г.) ввёл современные обозначения химических элементов и формулы химических
- 10. В общей сложности до Д.И. Менделеева было предпринято более 50 попыток классификации химических элементов. Ни одна
- 12. В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных
- 13. Что же было обнаружено? При переходе от лития к фтору происходит закономерное ослабление металлических свойств и
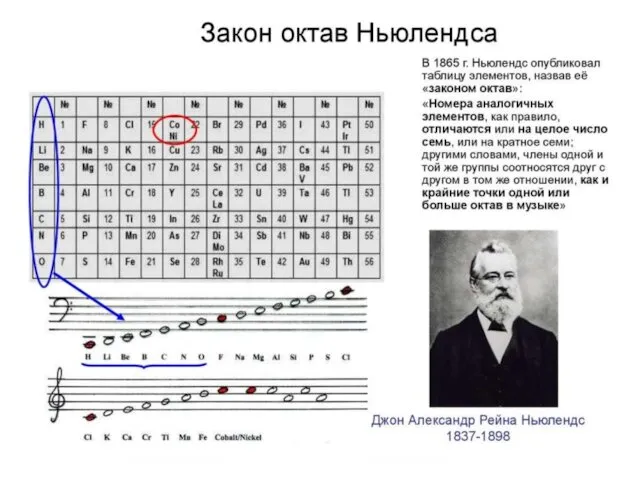
- 14. Если написать ряды химических элементов один под другим так, чтобы под литием находился натрий, а под
- 15. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал Периодический закон, который в начальной
- 16. Уязвимым моментом Периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с
- 17. Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что
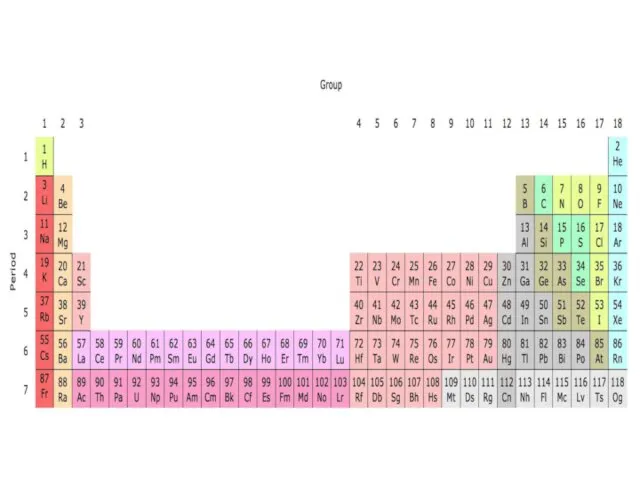
- 18. Структура Периодической системы химических элементов Д.И. Менделеева
- 22. Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и большие
- 23. Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы.
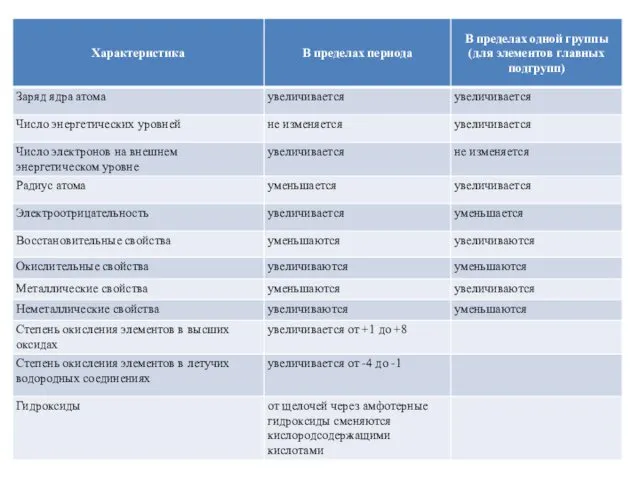
- 26. Закономерности изменения некоторых свойств химических элементов в Периодической системе
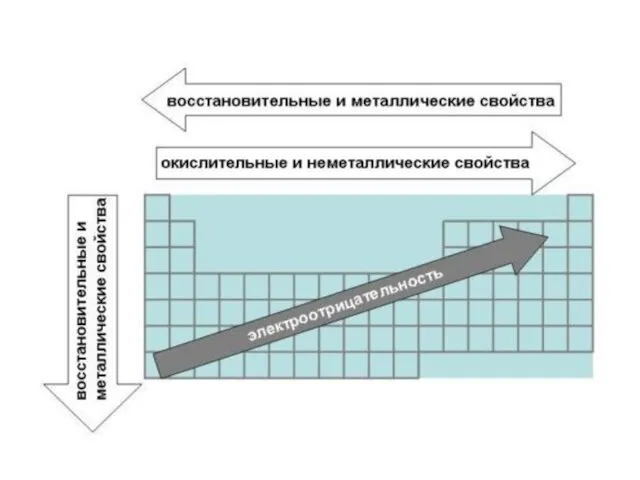
- 28. Окислительно-восстановительные свойства Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в главных подгруппах возрастают,
- 30. Электроотрицательность Электроотрицательность - способность атомов оттягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у
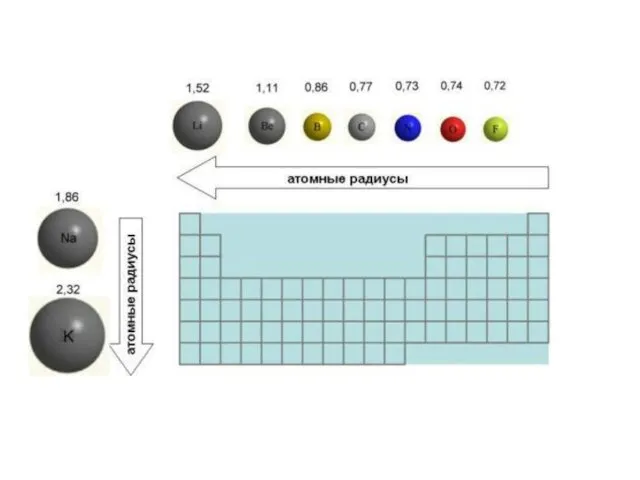
- 32. Изменение радиуса атома Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром
- 34. Смысл и значение Периодического закона Открытый Д.И. Менделеевым Периодический закон и построенная на основе закона Периодическая
- 35. ПЛАН ХАРАКТЕРИСТИКИ ХИМИЧЕСКОГО ЭЛЕМЕНТА ПО ЕГО ПОЛОЖЕНИЮ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Положение элемента в Периодической системе и
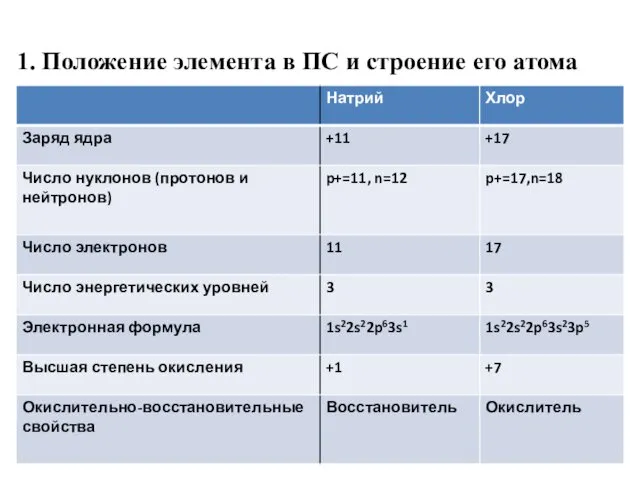
- 36. 1. Положение элемента в ПС и строение его атома
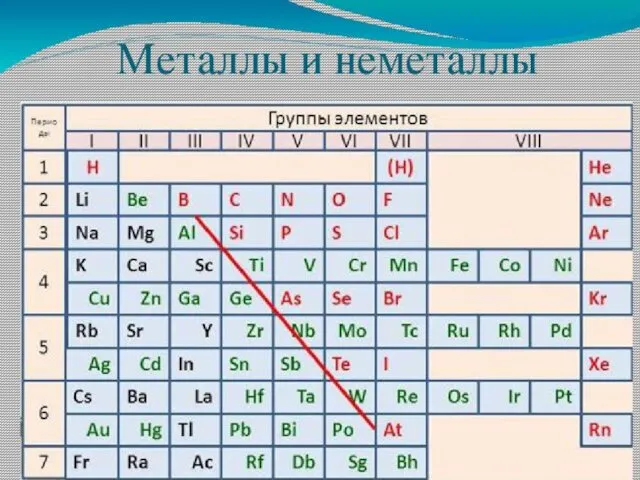
- 37. 2. Характеристика простого вещества (металл, неметалл)
- 38. 3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
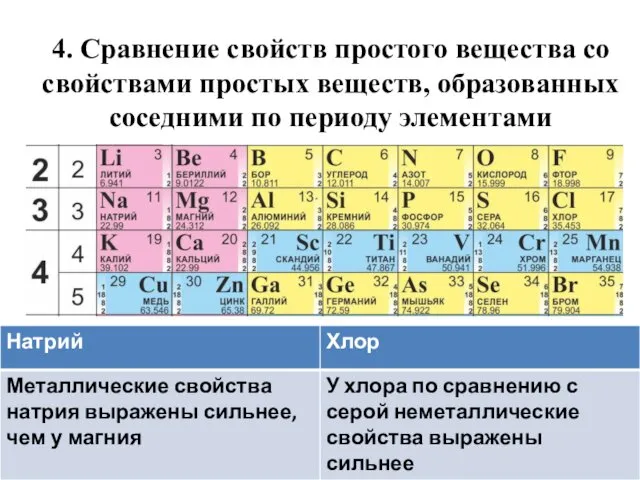
- 39. 4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
- 40. 5. Формула высшего оксида и его кислотно-основные свойства
- 41. 6. Формула высшего гидроксида, его кислотно-основные свойства
- 43. Скачать презентацию
































 Блок D350. Мифы о газобетоне
Блок D350. Мифы о газобетоне Мой инновационный продукт
Мой инновационный продукт Внеклассное мероприятие В гостях у сказки
Внеклассное мероприятие В гостях у сказки Архитектура современного города
Архитектура современного города анализ воспитательной работы
анализ воспитательной работы Идеи и ниши для бизнеса
Идеи и ниши для бизнеса Проектная технология как средство воспитания и развития детей дошкольного возраста
Проектная технология как средство воспитания и развития детей дошкольного возраста Родительское собрание Семья и школа Диск
Родительское собрание Семья и школа Диск Республика Конго
Республика Конго Клас Ссавці. Особливості будови
Клас Ссавці. Особливості будови ВТР - бизнес. 100 идеальных ниш для старта бизнеса с нуля
ВТР - бизнес. 100 идеальных ниш для старта бизнеса с нуля Порядок пересмотра и внесения поправок в Конституцию России
Порядок пересмотра и внесения поправок в Конституцию России Отчет о работе социального педагога ДОУ
Отчет о работе социального педагога ДОУ Принцип построения МРТ
Принцип построения МРТ Безопасность информации и ее правовое обеспечение, компьютерные преступления
Безопасность информации и ее правовое обеспечение, компьютерные преступления Зимующие птицы
Зимующие птицы Портфолио 1 класса
Портфолио 1 класса игра Космическое путешествие
игра Космическое путешествие Склонение сложных количественных числительных. 6 класс
Склонение сложных количественных числительных. 6 класс Библиотечный урок к 100-летию со дня рождения С. Михалкова
Библиотечный урок к 100-летию со дня рождения С. Михалкова Принципы наладки оборудования, режущего инструмента для технологического процесса изготовления деталей различных типов
Принципы наладки оборудования, режущего инструмента для технологического процесса изготовления деталей различных типов Педагогический проект Развитие связной речи посредством тетрализованной деятельности
Педагогический проект Развитие связной речи посредством тетрализованной деятельности Митькина Е. 9 А 13.04
Митькина Е. 9 А 13.04 колумбия
колумбия Современная Front-End разработка. (Лекция 8)
Современная Front-End разработка. (Лекция 8) Військове право
Військове право Трудности при овладении чтением учащимися и пути их преодоления.
Трудности при овладении чтением учащимися и пути их преодоления. Гремячая Грива
Гремячая Грива