Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление и катализатор). Принцип Ле Шателье. Роль смещения химического равновесия в увеличении выхода продукта в химической промышленности презентация
Содержание
- 2. Состояние химического равновесия обратимой реакции сохраняется при неизменных условиях (концентрация, температура и давление), но стоит только
- 3. Переход реакции из одного равновесного состояния в другое равновесное состояние, отвечающее изменившимся условиям, называют смещением равновесия
- 4. Принцип Ле Шателье Если изменить одно из условий, при которых реакция находится в состоянии равновесия (концентрация,
- 5. Ле Шателье Анри Луи Французский физикохимик и металловед. Сформулировал (1884) общий закон смещения термодинамического равновесия (принцип
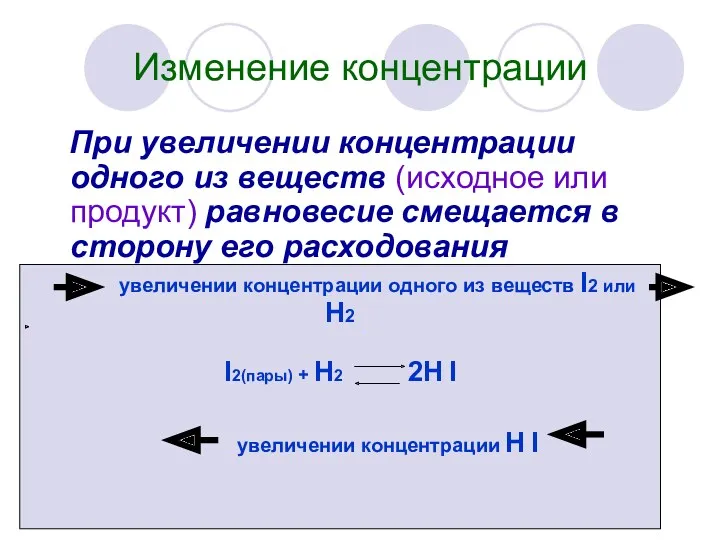
- 6. Изменение концентрации При увеличении концентрации одного из веществ (исходное или продукт) равновесие смещается в сторону его
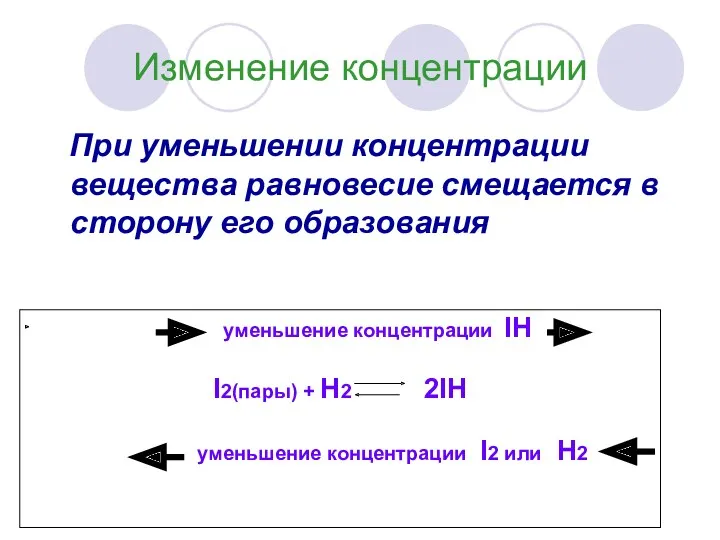
- 7. Изменение концентрации При уменьшении концентрации вещества равновесие смещается в сторону его образования уменьшение концентрации IH I2(пары)
- 8. В обратимых гетерогенных реакциях введение дополнительной массы твердого вещества не влияет на состояние равновесия t CaCO3(тв.)
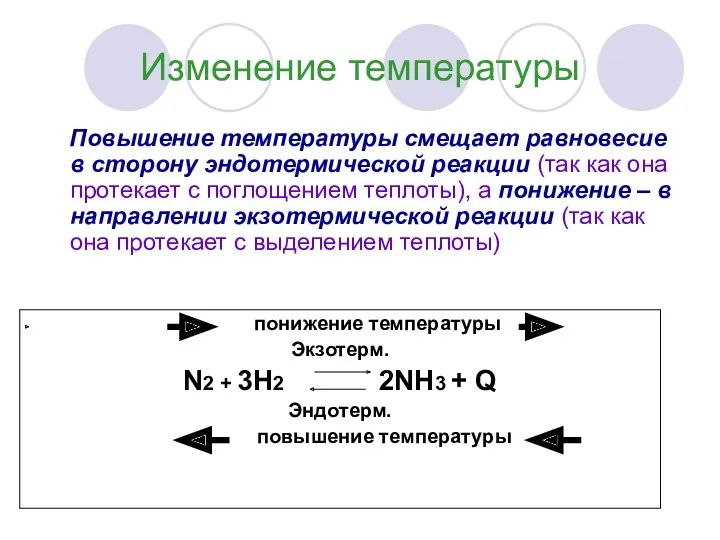
- 9. Изменение температуры Повышение температуры смещает равновесие в сторону эндотермической реакции (так как она протекает с поглощением
- 10. Изменение давления Сжимаемы только газообразные вещества, поэтому изменением давления можно смещать равновесие в реакциях, где хотя
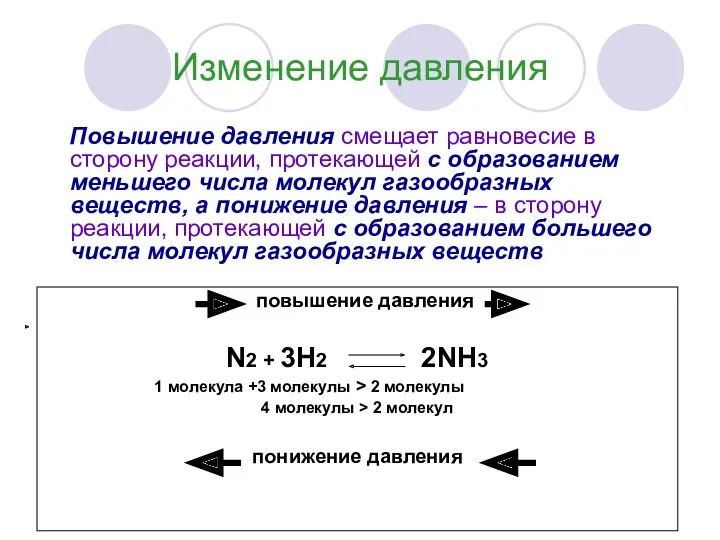
- 11. Изменение давления Повышение давления смещает равновесие в сторону реакции, протекающей с образованием меньшего числа молекул газообразных
- 12. Изменение давления Если реакция протекает без изменения числа молекул газообразных веществ, то изменение давления не влияет
- 13. Введение катализатора Введение в реакцию катализатора не влияет на состояние химического равновесия, так как катализатор снижает
- 14. Роль смещения химического равновесия в увеличении выхода продукта в химической промышленности
- 15. Применение принципа Ле Шателье к обратимым химическим реакциям позволяет управлять химическими процессами
- 16. Производство серной кислоты контактным способом Химизм производства серной кислоты состоит из трех стадий: Получение оксида серы
- 17. Рассмотрим вторую стадию получения серной кислоты: Каталитическое окисление оксида серы (IV) до оксида серы (VI) Реакция
- 18. Рассмотрим Производство аммиака Реакция синтеза NH3 экзотермическая, обратимая и протекает с уменьшение объема N2 + 3H2
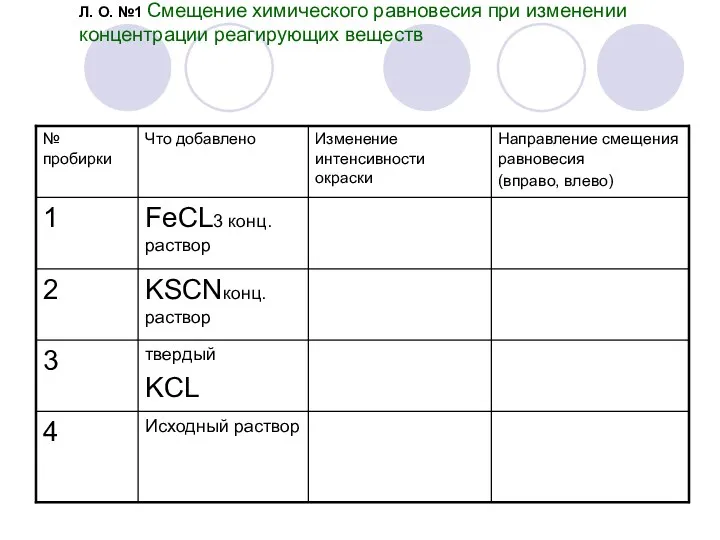
- 19. Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ Влияние изменения концентрации реагирующих веществ
- 20. Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ Красное окрашивание роданида железа (III)
- 21. Описание опыта №1 Смещение химического равновесия при изменении концентрации реагирующих веществ 1. Смешайте приблизительно по 3
- 22. Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ Напишите выражение для константы химического
- 23. Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ
- 25. Скачать презентацию

















 Отчет 11января 2022 (2)
Отчет 11января 2022 (2) Чем питаются хищные звери
Чем питаются хищные звери Дене шынықтыру және спорт білім беру бағдарламасы
Дене шынықтыру және спорт білім беру бағдарламасы Архитектура параллельных вычислительных систем. Лекция 2
Архитектура параллельных вычислительных систем. Лекция 2 Производство алюминия
Производство алюминия Манометры. Контрольно – измерительные приборы
Манометры. Контрольно – измерительные приборы ВКР: Проблемы стимулирования деятельности государственных служащих
ВКР: Проблемы стимулирования деятельности государственных служащих Музейная педагогика как фактор приобщения дошкольников к социокультурным ценностям
Музейная педагогика как фактор приобщения дошкольников к социокультурным ценностям Проводниковая анестезия
Проводниковая анестезия Writing an essay (C2)
Writing an essay (C2) Презентация к клубному часу Великая Отечественная война
Презентация к клубному часу Великая Отечественная война Специальные способы сварки. Гидродинамические явления при формировании сварного шва
Специальные способы сварки. Гидродинамические явления при формировании сварного шва Оказание первой помощи при всех видах острых хирургических заболеваний и травмах
Оказание первой помощи при всех видах острых хирургических заболеваний и травмах Чувашии символы родные
Чувашии символы родные Завоевание Римом Италии
Завоевание Римом Италии Приміщення
Приміщення Презентация к уроку по курсу ОРКСЭ. Тема: Совесть (ОСЭ) 4 класс.
Презентация к уроку по курсу ОРКСЭ. Тема: Совесть (ОСЭ) 4 класс. Презентация Требования к современному уроку
Презентация Требования к современному уроку Основы автоматизации технологических процессов ОМД
Основы автоматизации технологических процессов ОМД Герберт Спенсер (1820-1903)
Герберт Спенсер (1820-1903) Українська вишиванка. Види орнаментів в українській вишиванці
Українська вишиванка. Види орнаментів в українській вишиванці Презентация по теме Особо охраняемые природные территории. Воронежский заповедник 8 класс 2015 год
Презентация по теме Особо охраняемые природные территории. Воронежский заповедник 8 класс 2015 год Шуточные загадки с подвохом.
Шуточные загадки с подвохом. Качур П.А. - презентация ВКР
Качур П.А. - презентация ВКР Модели логических устройств
Модели логических устройств Лучевое исследование органов дыхания
Лучевое исследование органов дыхания Проект Моя буква.
Проект Моя буква. презентация к уроку технология УМК Гармония 1 класс Работа с разными материалами
презентация к уроку технология УМК Гармония 1 класс Работа с разными материалами